-
基因工程抗体ch4E5是近年来研制出的针对CD80分子的人-鼠嵌合抗体[1],其与人B细胞淋巴瘤Raji细胞有较高的亲和力,并能抑制该类肿瘤细胞的生长增殖[2]。放射免疫治疗(radioimmunotherapy, RIT)是将单克隆抗体与放射性核素连接,注入体内后与肿瘤细胞特异性结合,并利用射线对肿瘤的辐射生物效应而达到治疗目的,对于放射线敏感的淋巴瘤的治疗有重要的理论意义和临床价值[3-4]。放射性核素131I标记技术已被广泛应用于基础和临床医学研究,但其对ch4E5的放射性核素标记尚未见报道。本研究采用 Iodogen法对ch4E5进行131I标记制备分子探针131I-ch4E5,并探索131I-ch4E5在体外对人B细胞淋巴瘤Raji细胞的亲和作用,及其在荷瘤裸鼠体内的生物学分布和对荷瘤裸鼠的抑瘤作用。
-
人-鼠嵌合抗体ch4E5及人B细胞淋巴瘤Raji细胞均由苏州大学医学部免疫学系提供。Iodogen购自美国Sigma公司,Na131I购自成都中核高通同位素股份有限公司,PD10柱购自美国GE HealthcareLife SCiences 公司,RPMI 1640培养基购自美国Gibco公司,碘化钾(分析纯)购自国药集团化学试剂上海有限公司。CRC-15R放射性活度计购自美国Capintec公司,AR-2000放射性薄层色谱仪购自美国Bioscan公司,GC-911 γ放射免疫计数器购自安徽中科中佳科学仪器有限公司,CR3低温离心机和CO2培养箱均购自法国Jouan公司。
-
30只CBALB/C裸鼠购自中国科学院上海实验动物中心[许可证号:SYXK(沪)2019-0004],4周龄,体重16~20 g,雌雄不限。饲养条件:温度(22±2)℃,湿度(50±10)%,12 h光明、12 h黑暗交替,自由饮用无菌水和进食无特定病原体级鼠繁殖饲料。实验期间观察动物活动及生存状态。
-
采用 Iodogen法进行131I标记。在含有30 μg Iodogen的反应管中依次加入ch4E5 80 μg、Na131I溶液100 μl (55.5 MBq),轻轻摇动,室温反应10 min。反应完毕后加入0.05 mol/L 磷酸缓冲液250 μl,将反应液移入另一管中,静置5 min。将反应混合物用PD10柱分离纯化,收集所有的流出液,即为131I-ch4E5。采用放射性薄层色谱扫描法测定标记率和放射化学纯度。
-
将131I-ch4E5分别加入到人血清和PBS(pH=7.4)中(1∶10),置37℃条件下,检测放置第1、3、5天后131I-ch4E5的放射化学纯度。
-
配制细胞数分别为1×108、1×109、1×1010、5×1010、1×1011个/L的Raji细胞悬液,各取100 μl细胞悬液加入离心管中,每个浓度均设3支平行管。每管加入20 μl的131I-ch4E5溶液(每分钟脉冲数约5×104),混匀,37℃培养2 h;加入0.05 mol/L的PBS 500 μl(pH=7.4),摇匀,4℃低温离心(2000 r/min,离心半径12 cm)10 min,吸出上清液,用PBS洗涤沉淀2次,测量沉淀的放射性计数,计算细胞结合率。同时设置非特异结合对照管:分别取各浓度细胞悬液100 μl加入离心管中,均设3支平行管,先加入2 μl ch4E5(1 g/L),然后加入20 μl的131I-ch4E5溶液,其余步骤同上。特异性结合率(%)=总细胞结合率(%)−非特异性细胞结合率(%)。
-
采用皮下种植的方法,将处于对数生长期的Raji 细胞悬液按每只1×107个/L(0.1 ml)接种于裸鼠右侧腋窝皮下。待肿瘤生长至长径1 cm左右时用于实验。
-
3只荷瘤裸鼠于给药前3天,每天用10%碘化钾溶液200 μl灌胃。每只荷瘤裸鼠均经尾静脉注射131I-ch4E5 7.4 MBq(0.2 ml),72 h后处死裸鼠,分别取血液、心脏、肝、脾、肺、肾、胃、肠、胰腺、肌肉、骨、甲状腺、脑和肿瘤组织,称重并用γ放射免疫计数器测量放射性计数,计算T/NT。
-
将15只荷瘤裸鼠按随机数字表法分为3组,每组5只,给药前3天各组小鼠持续用0.1%碘化钾溶液作为饮用水至实验结束。131I-ch4E5组:尾静脉注射131I-ch4E5 11.1 MBq/只;ch4E5组:尾静脉注射ch4E5 20 μg/只;对照组:尾静脉注射生理盐水0.2 ml/只。
观察肿瘤体积变化:每隔3天测量肿瘤的长径和短径,计算肿瘤体积,肿瘤体积V=a×b2/2(a为长径、b为短径,单位:mm),将用药前的各组体积归1,计算体积变化,持续观察15 d。计算肿瘤生长抑制率,抑制率(%)=(V0−Vn)/V0×100%(V0为对照组的肿瘤体积,Vn为治疗组的肿瘤体积)。
组织病理学检查: 用药后第15天处死荷瘤裸鼠,分离肿瘤,用10 %甲醛固定,采用苏木精-伊红染色法做组织病理学检查。
-
应用SPSS17.0软件对数据进行统计学分析。符合正态分布的数据以
$\bar{x} \pm s$ 表示,2组间的比较采用两独立样本t检验(方差齐)。P<0.05为差异有统计学意义。 -
131I-ch4E5的标记率为(84.2±2.4)%、放射化学纯度为(97.1±1.1)%、比活度为584.1 MBq/mg。
-
131I-ch4E5分别在血清和PBS中第5天后的放射化学纯度均大于90%(表1),这说明标记抗体有较好的稳定性。
类别 0 d 1 d 3 d 5 d 血清 97.10±1.07 96.88±1.51 96.14±0.33 94.76±0.28 PBS 97.10±1.07 95.23±1.09 93.03±1.91 91.32±1.27 注:PBS为磷酸盐缓冲液 表 1 131I-ch4E5在血清和PBS中不同时间点的放射化学纯度(
$\bar x \pm s $ Table 1. Radiochemical purity of 131I-ch4E5 at different time points in serum and PBS (
$\bar x \pm s $ -
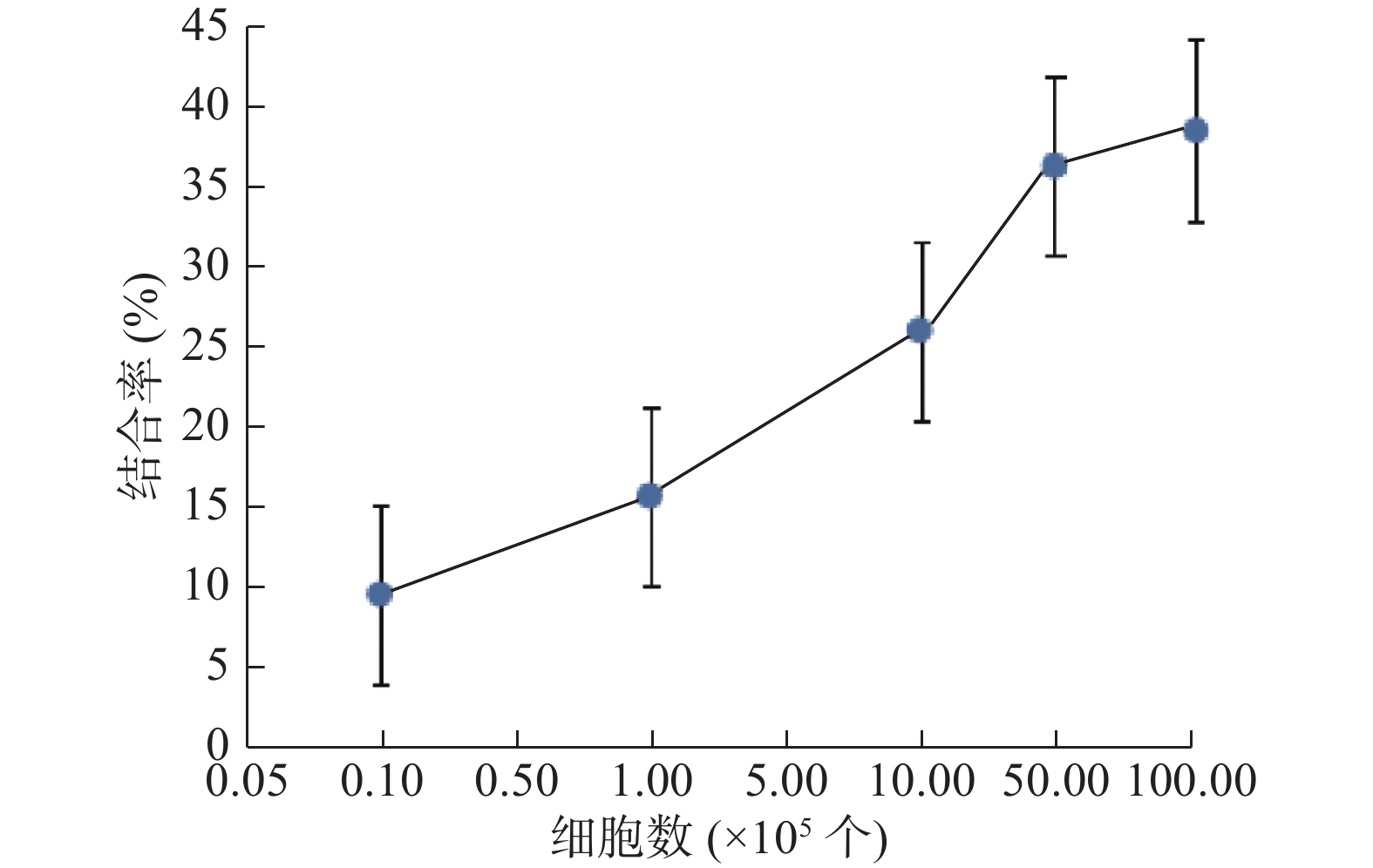
131I-ch4E5与Raji细胞的结合率如图1所示,随着Raji细胞数量的增加其结合率逐渐升高,当细胞数达到5×106以后则升高不明显,其最大结合率为(38.2±2.3)%。
-
荷瘤裸鼠注射131I-ch4E5 72 h后,肿瘤与血液、心脏、肝、脾、肺、肾、胃、肠、胰腺、肌肉、骨、甲状腺、脑组织的T/NT分别为1.01±0.15、2.55±0.85、1.31±0.38、1.69±0.54、2.05±0.17、2.14±0.57、5.16±0.96、3.84±0.93、2.18±0.35、6.05±1.20、3.46±1.27、1.25±0.06、18.99±4.18,肿瘤与肌肉的T/NT最大为7.30,这表明131I-ch4E5在荷瘤裸鼠体内的分布具有靶向性。
-
由图2可见,对照组肿瘤生长较快,ch4E5组肿瘤生长慢于对照组,2组比较差异有统计学意义(t=3.309,P=0.030);131I-ch4E5组肿瘤生长明显缓慢,与ch4E5组、对照组比较差异均有统计学意义(t=2.889 、6.516,P=0.044、0.003)。治疗后第15天,131I-ch4E5组肿瘤抑制率为71.7%,ch4E5组肿瘤抑制率为43.4%。

图 2 对照组、ch4E5组、131I-ch4E5组荷人B细胞淋巴瘤裸鼠的肿瘤生长曲线
Figure 2. Tumor growth curves of the human B-cell lymphoma-bearing nude mice in the control group, ch4E5 group, and 131I-ch4E5 group
各组荷瘤裸鼠肿瘤的组织病理学检查结果如图3所示,对照组肿瘤细胞增生活跃,见较多的病理性核分裂像。与对照组比较,ch4E5组病理性核分裂像相对较少,肿瘤细胞稀疏、个别核染色质浓缩、碎裂;131I-ch4E5组肿瘤细胞显著减少,大片肿瘤细胞凝固性坏死。
-
近年来,RIT在淋巴瘤治疗的基础研究和临床应用方面取得了较大的进展,目前对淋巴瘤以CD20为靶点的RIT研究已有报道[5-8],而针对CD80为靶点的RIT研究国内外报道较少。CD80在B淋巴瘤细胞表面有较高的表达,据文献报道,其阳性表达率可达92.7%,且该分子介导的信号与肿瘤细胞的恶性增殖及转移相关[9]。本研究用131I标记针对CD80的人-鼠嵌合抗体ch4E5,制备了分子探针131I-ch4E5,通过体内外实验为B细胞淋巴瘤CD80为靶点的RIT研究提供实验依据。
人-鼠嵌合抗体是常见的基因工程抗体,即采用DNA重组技术将鼠源性抗体的重、轻链可变区基因插入到含有人抗体恒定区的表达载体中,转染哺乳动物细胞表达,其人源化程度达到70%左右。嵌合抗体能完整地保留鼠源性抗体的可变区,最大限度保持其亲和活性[10-11]。采用基因工程技术构建的人-鼠嵌合抗体ch4E5既保留了其结构中天然结合抗原的完整Fab段,同时又可通过人Fc段发挥高效的抗体依赖细胞介导的细胞毒作用及调节免疫等功能[12]。由于嵌合抗体中鼠源蛋白含量减少65%~70%,故应用人体后免疫原性将大大降低[13],从而减少人抗鼠抗体的产生。本研究中,131I标记ch4E5采用Iodogen法,Iodogen是一种温和的氧化剂,利用其化合物不溶于水的特性,可将碘化反应置于液相与固相之间,因此只将反应后的液相与固相分离即可自行终止反应,无需加入还原剂,故蛋白质在碘化反应过程中的损伤较小。Iodogen法操作简便,反应温度和反应时间易于控制,标记产物易于分离。本方法制备的分子探针131I-ch4E5具有较高的标记率和放射化学纯度,其分别在血清和PBS中显示了较好的稳定性,符合体内外示踪技术的要求。在体外131I-ch4E5与人B细胞淋巴瘤Raji细胞的结合率较高,这说明其与人B细胞淋巴瘤细胞有较好的亲和力。
在淋巴瘤治疗方面,RIT具有诸多独特的优势[14-15]:放射性核素释放的β射线能穿透多个细胞直径的距离,发挥“交叉火力作用”;淋巴瘤细胞对射线高度敏感;在机体免疫缺陷、抗原表达不良或肿瘤免疫逃避等因素导致抗体及免疫毒素无效时,内照射仍可发挥杀伤作用;标记抗体保留了抗体本身所固有的抗肿瘤效应;淋巴瘤患者缺乏正常淋巴细胞及免疫力,产生人抗鼠抗体的概率较其他肿瘤低等等。本研究结果表明,131I-ch4E5对荷人B细胞淋巴瘤裸鼠的抑瘤作用明显,治疗后第15天对肿瘤的抑制率达到最高;组织病理学检查结果同样提示了131I-ch4E5治疗作用更为明显。这些结果说明131I-ch4E5结合到肿瘤细胞表面,利用抗体及射线对肿瘤的双效作用达到了更显著的治疗效果。
综上所述,本研究制备的分子探针131I-ch4E5标记率和放射化学纯度高,体内外实验结果均显示与人B细胞淋巴瘤有较好的亲和力,靶向性好,对荷人B细胞淋巴瘤裸鼠的肿瘤生长有明显的抑制作用,为进一步研究131I-ch4E5在RIT中的应用提供了实验依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 罗阳子负责文献的查阅、实验的实施、论文的撰写;邱玉华负责抗体的制备、参与论文的审核;张玉娜负责数据的整理及分析;翟士军负责研究命题的提出、实验的指导、论文的审阅
分子探针131I-ch4E5的制备及其动物实验研究
Preparation of molecular probe 131I-ch4E5 and its animal experiment research
-
摘要:
目的 探讨靶向B细胞淋巴瘤的分子探针131I-ch4E5的制备方法及其对荷人B细胞淋巴瘤裸鼠的抑瘤作用。 方法 采用Iodogen法用131I标记抗CD80的人-鼠嵌合抗体ch4E5,采用放射性薄层色谱扫描法测定标记率和放射化学纯度。(1)体外实验:在含细胞数为1×108、1×109、1×1010、5×1010、1×1011个/L的人B细胞淋巴瘤Raji细胞的离心管中分别加入131I-ch4E5溶液,同时设置非特异结合对照管,测量每管沉淀的放射性计数,计算Raji细胞与131I-ch4E5的特异性结合率。(2)体内实验: 3只荷瘤裸鼠尾静脉注射7.4 MBq的131I-ch4E5,72 h后处死,分别取肿瘤、血等14种脏器或组织,分别计算肿瘤与正常组织的放射性比值(T/NT);将15只荷瘤裸鼠按随机数字表法分为3组,分别经尾静脉注射131I-ch4E5(131I-ch4E5组)、未标记的ch4E5(ch4E5组)及生理盐水(对照组),观察3组荷瘤裸鼠的肿瘤生长情况,给药后第15天计算肿瘤生长抑制率;之后处死荷瘤裸鼠取肿瘤组织,采用苏木精-伊红染色法做组织病理学检查。2组间的比较采用两独立样本t检验。 结果 131I-ch4E5的标记率为(84.2±2.4)%、放射化学纯度为(97.1±1.1)%。(1)体外实验:131I-ch4E5与Raji细胞的结合率随细胞数量的增加而升高,最大结合率为(38.2±2.3)%。(2)体内实验:131I-ch4E5在荷人B细胞淋巴瘤裸鼠体内的分布具有靶向性,肿瘤与肌肉的T/NT最大为7.30;与ch4E5组、对照组比较,131I-ch4E5组肿瘤生长减慢,差异均有统计学意义(t=2.889 、6.516,均P<0.05);给药后第15天,131I-ch4E5组肿瘤抑制率为71.7%、ch4E5组为43.4 %。组织病理学检查结果同样显示131I-ch4E5的治疗效果更明显。 结论 自制分子探针131I-ch4E5的标记率及放射化学纯度高,且对荷人B细胞淋巴瘤裸鼠肿瘤生长有明显的抑制作用,为进一步研究131I-ch4E5在放射免疫治疗中的应用提供了实验依据。 Abstract:Objective To investigate the preparation method of a molecular probe 131I-ch4E5 for targeting B-cell lymphoma and its anti-tumor effect in human B-cell lymphoma-bearing nude mouse model. Methods The anti-CD80 human-mouse chimeric antibody ch4E5 was labeled with 131I through the Iodogen method, and its labeling rate and radiochemical purity were determined by radioactive thin layer chromatography scanning method. (1)In vitro experiments: 131I-ch4E5 solution was added to cytocentrifuge tubes containing 1×108, 1×109, 1×1010, 5×1010, and 1×1011 cells/L of human B-cell lymphoma cells (Raji cells) and to non-specific binding control tubes. Radioactivity counts per tube of precipitation were measured to calculate the specific binding rate of Raji cells to 131I-ch4E5. (2) In vivo experiments: 7.4 MBq of 131I-ch4E5 was injected into three tumor-bearing nude mice via the tail vein. After 72 h, the tumor-bearing nude mice were sacrificed. Fourteen organs or tissues, such as tumor and blood, were harvested and weighed, and their radioactivity was measured. The radioactivity ratio of tumor to normal tissue (T/NT) was calculated. In the treatment study, 15 tumor-bearing nude mice were divided into three groups according to the random number table method and injected with 131I-ch4E5 (131I-ch4E5 group), unlabeled ch4E5 (ch4E5 group), and normal saline (control group) through the tail vein. Tumor growth was observed in the three groups. After 15 days, the tumor inhibition rate was calculated, and then the tumor-bearing nude mice were sacrificed to harvest tumor tissues for histopathological examination by hematoxylin-eosin staining. Comparisons between the two groups were performed using two independent samples t-test. Results The labeling rate of 131I-ch4E5 was (84.2±2.4)%, and the radiochemical purity was (97.1±1.1)%. (1) In vitro experiments: the binding rate of 131I-ch4E5 to Raji cells increased with increasing cell concentration, and the maximum binding rate was (38.2±2.3)%. (2) In vivo experiments: the distribution of 131I-ch4E5 in human B-cell lymphoma-bearing nude mice was targeted, and the maximum T/NT ratio of tumor to muscle was 7.30. Compared with the ch4E5 and control groups, the 131I-ch4E5 group exhibited decreased tumor growth, and the difference was statistically significant (t=2.889, 6.516; both P<0.05). Fifteen days after the administration, the tumor inhibition rate was 71.7% in the 131I-ch4E5 group and 43.4% in the ch4E5 group. The histopathological examination results showed that tumor cell necrosis was observed in both treatment groups, and the therapeutic efficacy of the 131I-ch4E5 group was superior to that of the ch4E5 group. Conclusion The self-made molecular probe 131I-ch4E5 has high labeling rate and radiochemical purity, and has a significant inhibitory effect on the tumor growth of human B-cell lymphoma-bearing nude mice, which provides an experimental basis for further research on the application of 131I-ch4E5 in radioimmunotherapy. -
Key words:
- Molecular probes /
- Iodine radioisotopes /
- ch4E5 /
- Lymphoma, B-cell /
- Radioimmunotherapy /
- Tumor-bearing nude mice
-
表 1 131I-ch4E5在血清和PBS中不同时间点的放射化学纯度(
$\bar x \pm s $ Table 1. Radiochemical purity of 131I-ch4E5 at different time points in serum and PBS (
$\bar x \pm s $ 类别 0 d 1 d 3 d 5 d 血清 97.10±1.07 96.88±1.51 96.14±0.33 94.76±0.28 PBS 97.10±1.07 95.23±1.09 93.03±1.91 91.32±1.27 注:PBS为磷酸盐缓冲液 -
[1] 徐耀瑜, 胡玲玲, 陈永井, 等. CD80鼠-人嵌合抗体的CHO细胞表达及体外生物学功能的初步研究[J]. 中国免疫学杂志, 2009, 25(2): 114−117.
Xu YY, Hu LL, Chen YJ, et al. Expression of human-mouse chimeric antibody against CD80 in CHO cells and preliminary study on the biological activity in vitro[J]. Chin J Immunol, 2009, 25(2): 114−117.[2] 王艳茹, 邱玉华. 抗人B7-1人-鼠嵌合抗体体内外抑瘤作用研究[J]. 免疫学杂志, 2015, 31(9): 753−756. DOI: 10.13431/j.cnki.immunol.j.20150159.
Wang YR, Qiu YH. Inhibitory action of human-mouse chimeric antibody against B7-1 on tumor cell in vivo and in vitro[J]. Immunological Journal, 2015, 31(9): 753−756. DOI: 10.13431/j.cnki.immunol.j.20150159.[3] Storto G, Renzo AD, Pellegrino T, et al. Assessment of metabolic response to radioimmunotherapy with 90Y-ibritumomab tiuxetan in patients with relapsed or refractory B-Cell non-Hodgkin lymphoma[J]. Radiology, 2010, 254(1): 245−252. DOI: 10.1148/radiol.09090603. [4] Samaniego F, McLaughlin P, Neelapu SS, et al. Initial report of a phase Ⅱ study with R-FND followed by ibritumomab tiuxetan radioimmunotherapy and rituximab maintenance in patients with untreated high-risk follicular lymphoma[J]. Leuk Lymphoma, 2021, 62(1): 58−67. DOI: 10.1080/10428194.2020.1821005. [5] Umyarova E, Chhabra S, Mims A, et al. Anti CD20 radioimmunotherapy and mtor inhibition in reduced intensity conditioning hematopoietic stem cell transplantation for relapsed/refractory B Cell lymphomas[J]. J American Society Blood Marrow Transplant, 2015, 21(2 Suppl 1): S316−317. DOI: 10.1016/j.bbmt.2014.11.504. [6] Puronen CE, Cassaday RD, Stevenson PA, et al. Long-term follow-up of 90Y-ibritumomab tiuxetan, fludarabine, and total body irradiation–based nonmyeloablative allogeneic transplant conditioning for persistent high-risk B cell lymphoma[J]. Biol Blood Marrow Transplant, 2018, 24(11): 2211−2215. DOI: 10.1016/j.bbmt.2018.06.033. [7] Kitajima K, Okada M, Kashiwagi T, et al. Early evaluation of tumor response to 90Y-ibritumomab radioimmunotherapy in relapsed/refractory B cell non-Hodgkin lymphoma: what is the optimal timing for FDG-PET/CT?[J]. Eur Radiol, 2019, 29(7): 3935−3944. DOI: 10.1007/s00330-019-06134-7. [8] Bouroumeau A, Bussot L, Bonnefoix T, et al. Evaluation of CYCLON as a predictive biomarker of anti CD20 response in diffuse large B-Cell lymphoma[J]. Virchows Archiv Int J Pathol, 2019, 475 Suppl 1: S338. [9] 邱玉华, 季玉红, 郭玲, 等. 鼠抗人B7-1分子功能性单克隆抗体的制备及生物学特性[J]. 中国免疫学杂志, 2000, 16(11): 589−593. DOI: 10.3321/j.issn:1000-484X.2000.11.006.
Qiu YH, Ji YH, Guo L, et al. Preparation of functional monoclonal antibody against human CD80 (B7-1) and analysis of its biological effects[J]. Chin J Immunol, 2000, 16(11): 589−593. DOI: 10.3321/j.issn:1000-484X.2000.11.006.[10] Li SS, Shen DY, Guo XP, et al. Construction, expression, and characterization of a novel human-mouse chimeric antibody, Hm3A4: a potential therapeutic agent for B and myeloid lineage leukemias[J]. DNA Cell Biol, 2018, 37(9): 778−785. DOI: 10.1089/dna.2018.4199. [11] Ikeda K, Koga T, Sasaki F, et al. Generation and characterization of a human-mouse chimeric high-affinity antibody that detects the DYKDDDDK FLAG peptide[J]. Biochem Biophys Res Commun, 2017, 486(4): 1077−1082. DOI: 10.1016/j.bbrc.2017.03.165. [12] Kaneko MK, Yamada S, Nakamura T, et al. Antitumor activity of chLpMab-2, a human-mouse chimeric cancer-specific antihuman podoplanin antibody, via antibody-dependent cellular cytotoxicity[J/OL]. Cancer Med, 2017, 6(4): 768−777[2021-05-13]. https://onlinelibrary.wiley.com/doi/10.1002/cam4.1049. DOI: 10.1002/cam4.1049. [13] Mi L, Li W, Li MH, et al. Immunogenicity screening assay development for a novel human-mouse chimeric anti-CD147 monoclonal antibody (Metuzumab)[J]. J Immunol Methods, 2016, 433: 38−43. DOI: 10.1016/j.jim.2016.02.022. [14] Witzig TE. Yttrium-90-ibritumomab tiuxetan radioimmunotherapy: a new treatment approach for B-cell non-Hodgkin's lymphoma[J]. Drugs Today, 2004, 40(2): 111−119. DOI: 10.1358/dot.2004.40.2.799423. [15] Press OW, Rasey J. Principles of radioimmunotherapy for hematologists and oncologists[J]. Semin Oncol, 2000, 27(6 Suppl 12): S62−73. -






 下载:
下载: