-
DTC患者经手术、131I和TSH抑制治疗后大部分预后良好,然而,仍有部分DTC患者逐渐失去摄碘能力而进展成为碘难治性DTC(radioiodine-refractory DTC,RAIR-DTC)且预后不佳[1-2]。分子靶向药物在RAIR-DTC的治疗中具有重要作用,在我国,索拉非尼已被批准用于晚期DTC的治疗并被纳入相关指南[3]。分子靶向药物所致不良反应的防治是影响治疗成功与否的重要因素。笔者报道了1例目前在临床中极为少见的RAIR-DTC经索拉非尼治疗致亚急性肝衰竭的病例,其不良反应严重且持续时间较长,期望通过对该病例的临床资料进行分析以及对相关文献进行复习,加深对RAIR-DTC经索拉非尼治疗致亚急性肝衰竭这一不良反应的认识。
-
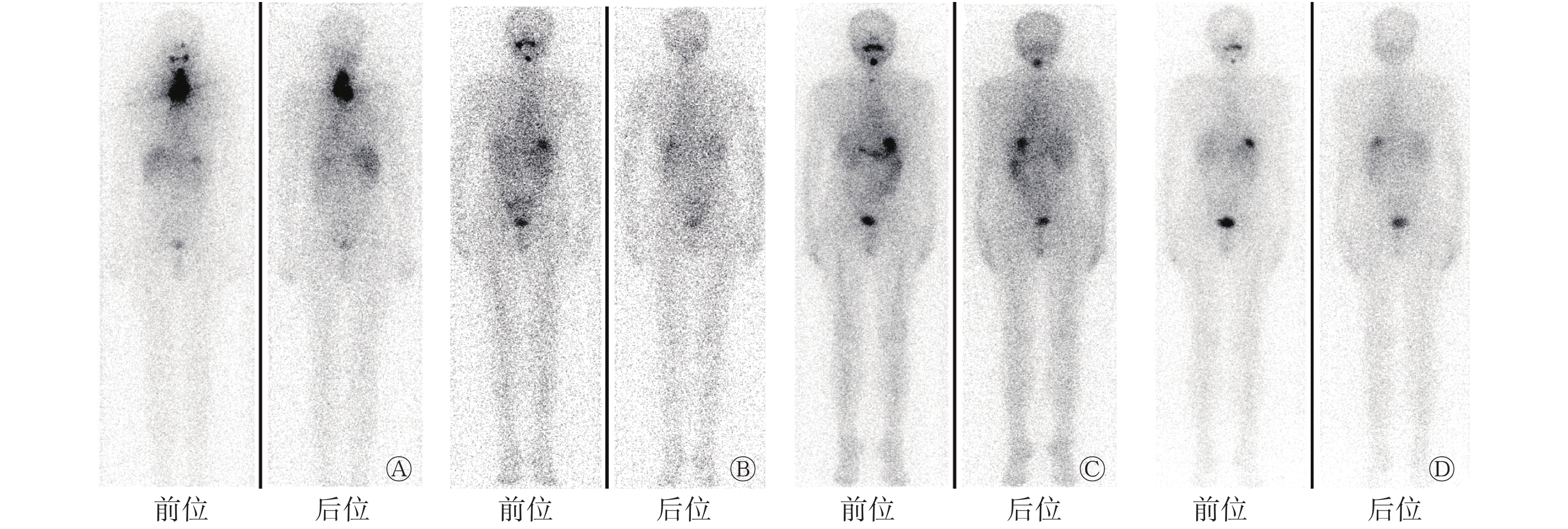
患者男性,64岁,于2010年3月1日因甲状腺癌行双叶甲状腺全切术,组织病理学检查结果为右侧甲状腺乳头状癌。术后规律进行TSH抑制治疗(口服左甲状腺素片,每日1次,每次100 μg),9个月后复查TSH抑制状态,结果显示,甲状腺球蛋白(thyroglobulin,Tg)水平由0.10 μg/L升至10.74 μg/L,131I诊断性全身显像结果为阴性,诊断为RAIR-DTC。全身骨显像结果显示,右侧第一肋骨的骨质代谢活跃,考虑为骨转移,遂行X射线放疗,总剂量为40 Gy,分20次完成。术后3年内共行4次131I治疗和131I诊断性全身显像(图1)。2014至2017年间规律复查TSH抑制状态,结果显示,Tg水平呈进行性升高(由2.56 μg/L升至9.84 μg/L)(图2)。

图 1 碘难治性分化型甲状腺癌患者(男性,64岁)行4次131I治疗后的131I诊断性全身显像图
Figure 1. 131I diagnostic whole body imaging of a 64-year-male patient with radioiodine-refractory differentiated thyroid cancer after 4 times of 131I treatments
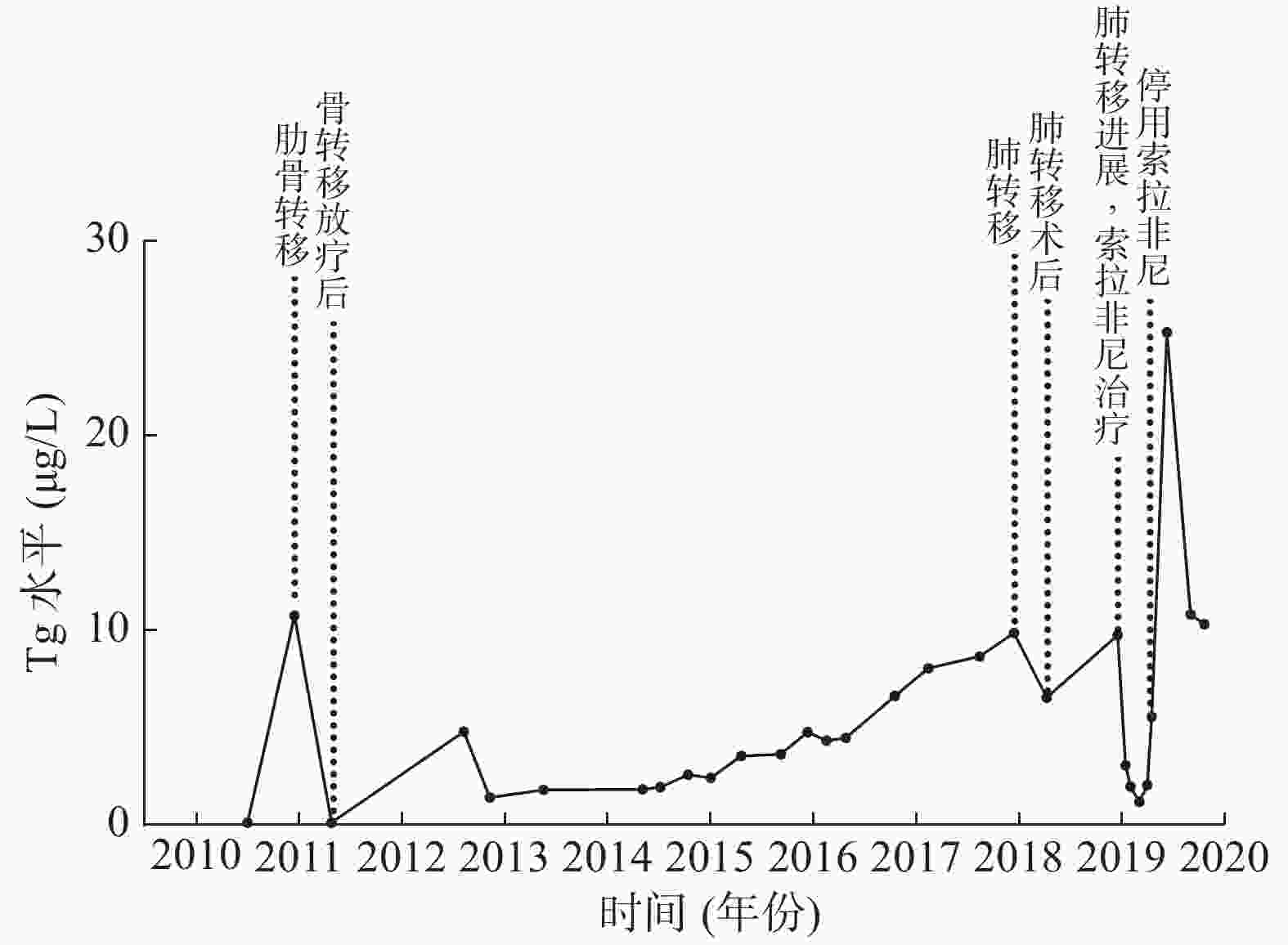
图 2 碘难治性分化型甲状腺癌患者(男性,64岁)术后复查Tg水平的变化
Figure 2. Line chart of rechecking Tg level of a 64-year-male patient with radioiodine-refractory differentiated thyroid cancer after surgery
2017年12月5日,行全身PET/MRI显像,结果显示,双肺多发小结节,部分代谢增高(较大结节位于右肺下叶基底段,长径=0.8 cm,SUVmax=4.1),考虑为肺转移,于CT引导的胸腔镜下行右下肺和右中肺楔形切除术,术后组织病理学检查结果为右下肺结节腺癌,结合病史和免疫组织化学结果,符合甲状腺来源。术后肺部Tg水平降至6.56 μg/L,继续行TSH抑制治疗,维持TSH<0.1 mU/L。1年后复查肺部CT,结果显示,肺部转移性进展,Tg水平升至9.73 μg/L,诊断为进展期RAIR-DTC,常规肝功能检查结果均正常。
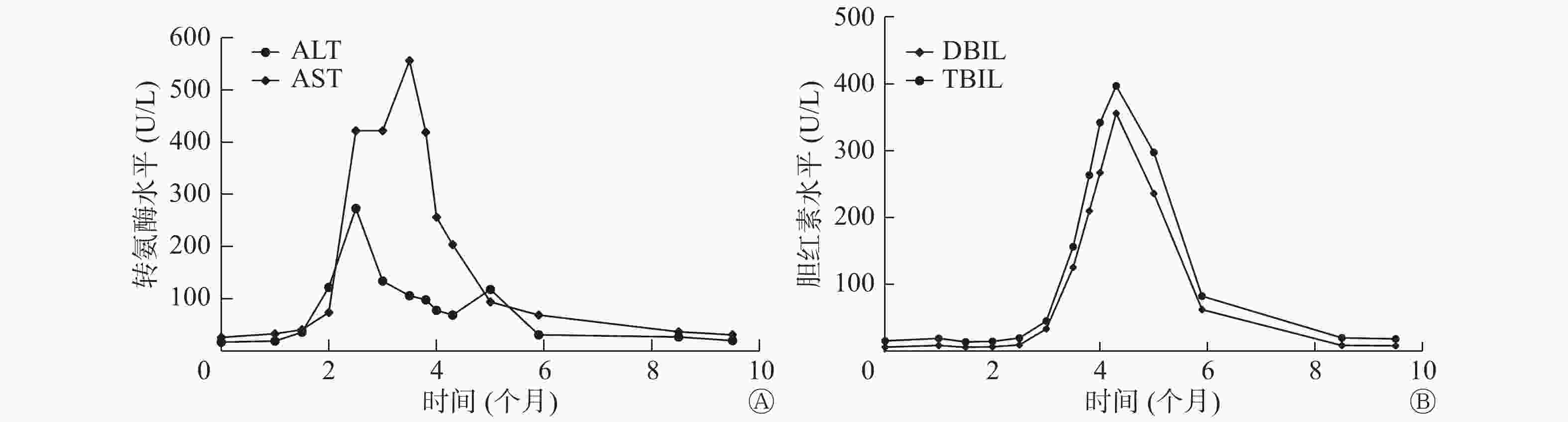
2018年12月31日,行索拉非尼治疗(口服,每日2次,每次0.4 g)2周后,Tg水平由9.73 μg/L降至3.04 μg/L,患者出现手足反应,行走困难,以双手和双足掌皮肤色红、脱皮为主要表现,伴有明显的疼痛症状,索拉非尼减量(口服,每日2次,每次0.2 g)后上述症状有所缓解。2个月后,肝功能异常,谷丙转氨酶(alanine aminotransferase,ALT)水平由36 U/L升至122 U/L,谷草转氨酶(aspartate aminotransferase,AST)水平由40 U/L升至74 U/L,给予双环醇片(口服,每日3次,每次50 mg)行护肝治疗。3个月后,转氨酶和胆红素水平均进行性升高,遂住院进行护肝治疗(异甘草酸镁,静脉滴注,每日1次,每次150 mg;还原谷胱甘肽,静脉滴注,每日1次,每次1.2 g)。4个月后,转氨酶和胆红素水平仍进行性升高,患者出现明显乏力、纳差、腹胀、双下肢水肿以及全身皮肤和巩膜黄染等症状,遂停服索拉非尼,继续加强护肝和降酶治疗,半个月后,上述临床症状无明显缓解,转氨酶水平有所下降(ALT水平由最高值273 U/L降至78 U/L,AST水平由最高值556 U/L降至256 U/L);胆红素水平仍继续升高,总胆红素水平最高值为396.8 μmol/L,直接胆红素水平最高值为355.8 μmol/L。行肝炎全套检查、EB病毒抗体组合检查、自身免疫性肝炎及肿瘤全套检查,结果均未见明显异常,腹部MRI结果显示弥漫性肝损害,结合病史,诊断为药物性亚急性肝衰竭。遂行3次人工肝血浆置换+吸附术,黄疸明显减退,肝功能明显改善(总胆红素水平为68 μmol/L,直接胆红素水平为59.8 μmol/L,ALT水平为31 U/L,AST水平为54 U/L)(图3)。2019年6月出院后继续行护肝治疗4月余,2019年10月复查肝功能,结果显示已恢复正常。
-
索拉非尼是酪氨酸激酶抑制剂,可通过抑制Raf-1和B-Raf激酶活性以及血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)2、VEGFR-3、c-Kit和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)β等多种受体的酪氨酸激酶活性,阻断由Raf/丝裂原活化蛋白激酶激酶(MEK)/细胞外调节蛋白激酶(ERK)介导的细胞信号通路来直接抑制肿瘤细胞的增殖[4],或直接作用于VEGFR和PDGFR来阻断肿瘤新生血管的生成并切断肿瘤细胞的营养供应,从而间接抑制肿瘤细胞的生长。索拉非尼可用于RAIR-DTC的治疗[5-6]。
索拉非尼致肝损伤较为少见且程度较轻[7]。肝损伤通常表现为ALT和(或)AST水平的升高,多为无症状的轻至中度升高,一般给予常规护肝治疗后即可恢复,同时伴胆红素水平的升高较为少见。在索拉非尼所致不良反应的临床研究中,发生急性肝损伤的病例少见,其发生率为0.5%[8-9],而发生药物性肝衰竭的病例更为罕见。
该病例经双侧甲状腺全切术和多次131I治疗后,出现骨和肺转移,期间虽经局部放疗和肺转移灶切除治疗,但其病情仍进展,131I诊断性全身显像结果为阴性,符合RAIR-DTC进展期的诊断,为靶向药物的适应证,经索拉非尼治疗后病情得到缓解(Tg水平明显下降),可见治疗有效。随之出现的手足反应等不良反应在药物减量后得以缓解,但肝功能受损则进行性加重,经常规护肝治疗和停服索拉非尼等措施后,临床症状仍未缓解,胆红素水平持续升高,最终发展为亚急性肝衰竭,后经人工肝治疗后上述临床症状得以缓解,肝功能指标逐步恢复正常。该病例在行索拉非尼治疗前肝功能基线结果正常,排除了肝脏相关基础疾病导致的肝功能异常,且无饮酒、熬夜和营养不良等诱导因素,故考虑为药物治疗导致的亚急性肝衰竭,程度较为严重且持续时间较长,这在临床中极为少见。由此我们认为,临床医师在关注索拉非尼疗效的同时,需提高对应用靶向药物治疗RAIR-DTC所致不良反应的认知和管理,从而提高靶向治疗的疗效和安全性。
我们建议在对RAIR-DTC患者进行索拉非尼治疗前,先进行肝功能基线检查以排除其他肝脏病变,若基线检查结果异常,则需密切监测肝功能并宜降低靶向药物的起始剂量;若基线检查结果无异常,仍需规律监测肝功能,患者一旦出现不良反应,应立即按照不良事件通用术语标准(CTCAE)[10]进行评估和分级,并进行快速有效的处理,将不良反应的风险和严重程度降至最低。对于复杂的不良反应,建议进行多学科会诊。若不良反应程度较轻,重要器官功能良好,则应尽可能维持靶向药物的应用,以获得靶向药物的最大疗效,最终实现患者生存获益。当观察到转氨酶水平>5~20倍正常值上限时,应暂停服用药物,并请专科医师会诊进行护肝治疗;当转氨酶水平恢复至3~5倍正常值上限或基线水平后,可降低服药剂量;若不良反应持续存在或加重,应终止服用药物;当转氨酶水平>20倍正常值上限时,应立即永久停服药物,请专科医师会诊,积极处理并严密监测患者的生命体征。总而言之,索拉非尼在临床应用中的减量或停药取决于肝脏不良反应的严重程度和持续性。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 闫新宇负责论文的撰写;张雅婧、张晓负责论文的修订;胡胜清负责数据的统计与处理;高再荣负责命题的提出与设计、论文的审阅。
碘难治性分化型甲状腺癌经索拉非尼治疗致亚急性肝衰竭一例
A case of subacute liver failure caused by sorafenib treatment of radioiodine-refractory differentiated thyroid cancer
-
摘要: 笔者报道了1例碘难治性分化型甲状腺癌(RAIR-DTC)经索拉非尼治疗致亚急性肝衰竭的病例,并从临床症状、实验室检查、影像学检查、组织病理学检查结果以及患者的临床处置与转归等方面综合分析了该病的特点。笔者通过文献复习加深了对RAIR-DTC以及索拉非尼治疗晚期甲状腺癌的疗效和相关不良反应的认识,旨在提示临床医师在遇到相似病例时,不仅要关注索拉非尼的疗效,也要提高对应用靶向药物治疗RAIR-DTC所致不良反应的认知和管理,从而提高靶向治疗的疗效和安全性。Abstract: This paper reports a case of subacute liver failure caused by sorafenib treatment of radioiodine-refractory differentiated thyroid cancer (RAIR-DTC), and comprehensively analyzes the characteristics of the disease from clinical symptoms, laboratory examinations, imaging examinations, histopathological examination results as well as the patient's clinical treatment and outcome. Through literature review, the authors deepen the understanding of the characteristics of the disease, the efficacy and adverse reactions of sorafenib in the treatment of advanced thyroid cancer. This paper aims to remind clinicians that when encountering similar cases, they should not only pay attention to the efficacy of sorafenib treatment, but also improve the clinical awareness and management of adverse reactions related to the application of targeted drug therapy in RAIR-DTC, and ultimately improve the efficacy and safety of targeted therapy.
-
Key words:
-
-
[1] Haugen BR, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1−133. DOI: 10.1089/thy.2015.0020. [2] 丛慧, 梁军, 林岩松. 碘难治性分化型甲状腺癌的诊断与靶向治疗[J]. 国际放射医学核医学杂志, 2015, 39(1): 25−31. DOI: 10.3760/cma.j.issn.1673-4114.2015.01.007.
Cong H, Liang J, Lin YS. Diagnosis and targeted therapy of radioactive iodine-refractory differentiated thyroid cancer[J]. Int J Radiat Med Nucl Med, 2015, 39(1): 25−31. DOI: 10.3760/cma.j.issn.1673-4114.2015.01.007.[3] 中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2014版)[J]. 中华核医学与分子影像杂志, 2014, 34(4): 264−278. DOI: 10.3760/cma.j.issn.2095-2848.2014.04.002.
Nuclear Medicine Society of Chinese Medical Association. Guidelines for the treatment of differentiated thyroid cancer with 131I (2014 ed)[J]. Chin J Nucl Med Mol Imaging, 2014, 34(4): 264−278. DOI: 10.3760/cma.j.issn.2095-2848.2014.04.002.[4] Licitra L, Locati LD. Antiangiogenic TKIs and advanced RAI-resistant thyroid cancer: time for rethinking treatment strategies?[J]. Thyroid, 2014, 24(12): 1815. DOI: 10.1089/thy.2014.0288. [5] 中国临床肿瘤学会(CSCO)甲状腺癌专家委员会, 中国研究型医院学会甲状腺疾病专业委员会, 中国医师协会外科医师分会甲状腺外科医师委员会, 等. 碘难治性分化型甲状腺癌的诊治管理共识(2019年版)[J]. 中国癌症杂志, 2019, 29(6): 476−480. DOI: 10.19401/j.cnki.1007-3639.2019.06.013.
Thyroid Cancer Expert Committee of the Chinese Society of Clinical Oncology (CSCO), Thyroid Disease Professional Committee of the Chinese Society of Research Hospitals, Thyroid Surgeon Committee of the Surgeon Branch of the Chinese Medical Doctor Association, et al. Consensus on the diagnosis, treatment and management of radioiodine-refractory differentiated thyroid cancer (2019 ed)[J]. China Oncol, 2019, 29(6): 476−480. DOI: 10.19401/j.cnki.1007-3639.2019.06.013.[6] Schlumberger M, Brose M, Elisei R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer[J]. Lancet Diabetes Endocrinol, 2014, 2(5): 356−358. DOI: 10.1016/S2213-8587(13)70215-8. [7] Lakshmanan A, Wojcicka A, Kotlarek M, et al. MicroRNA-339-5p modulates Na+/I− symporter-mediated radioiodide uptake[J]. Endocr Relat Cancer, 2015, 22(1): 11−21. DOI: 10.1530/ERC-14-0439. [8] Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319−328. DOI: 10.1016/S0140-6736(14)60421-9. [9] Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 372(7): 621−630. DOI: 10.1056/NEJMoa1406470. [10] 中国临床肿瘤学会(CSCO)甲状腺癌专家委员会. 碘难治性分化型甲状腺癌靶向药物不良反应管理专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(7): 545−553. DOI: 10.19401/j.cnki.1007-3639.2018.07.012.
Thyroid Cancer Expert Committee of the Chinese Society of Clinical Oncology (CSCO). Expert consensus on the management of adverse reactions of targeted drugs in radioactive iodine-refractory differentiated thyroid cancer (2018 ed)[J]. China Oncol, 2018, 28(7): 545−553. DOI: 10.19401/j.cnki.1007-3639.2018.07.012. -





 下载:
下载: