-
鼻咽癌是头颈部常见的上皮来源的恶性肿瘤之一。18F-FDG PET/CT具有可提供全身显像的信息及反映病灶内部的代谢情况等优势,目前已被广泛应用于鼻咽癌的诊断。表皮生长因子受体(epidermal growth factor receptor,EGFR)属于内源性受体型酪氨酸激酶家族,EGFR 蛋白的过表达与头颈部恶性肿瘤的分化程度和增殖密切相关[1],EGFR高表达的恶性肿瘤通常意味着预后不良[2]。头颈部恶性肿瘤中EGFR的高表达会造成肿瘤细胞对放疗的抗性[3]。由于受到鼻咽癌发病部位的限制及其高度的放疗敏感性,放疗已成为治疗鼻咽癌的首选方式。以往有关于EGFR蛋白表达情况的临床检测主要以病理免疫组织化学法为主,但该方法属于有创性检查。Lee等[4]的研究结果表明,EGFR的表达水平与恶性肿瘤对18F-FDG摄取率的高低密切相关。本研究通过综合分析鼻咽癌患者的临床资料及18F-FDG PET/CT检查的相关代谢参数对EGFR表达水平的影响,探讨18F-FDG PET/CT检查是否可以作为评估鼻咽癌患者治疗前EGFR表达水平的影像学手段。
-
回顾性分析2017年1月至2019年11月广西省柳州市工人医院核医学科收治并经组织病理学检查确诊为鼻咽癌的61例患者的临床资料和18F-FDG PET/CT影像资料,其中男性44例、女性17例,年龄21~84(57.8±6.2)岁。纳入标准:经组织病理学检查确诊为鼻咽癌。排除标准:患有其他恶性肿瘤;患有严重的心、肝、肺、肾疾病。收集患者的性别、年龄、肿瘤最大径、病理分型、肿瘤T分期等资料,T分期参考鼻咽癌第8版美国癌症联合委员会/国际抗癌联盟分期系统[5],病理分型参考WHO分类标准[6]。
所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
所有患者均于放化疗前行全身18F-FDG PET/CT显像。显像剂18F-FDG由日本住友公司提供,放射化学纯度>95%,采用德国西门子公司的Biograph mCT PET/CT仪进行显像。检查前常规检测血糖并控制空腹血糖<11.11 mmol/L,所有患者均禁食6 h以上。通过静脉注射18F-FDG,剂量为3.7~5.5 MBq/kg,50 min后开始采集图像。CT扫描方式为螺旋扫描,扫描参数:管电压120 kV、管电流120~150 mA、扫描视野 50 cm、层厚5 mm、层间隔4.25 mm。CT图像采集结束后,在同一范围内再行PET图像采集,采集总床位数根据患者身高及CT扫描范围而定,1.5~3.0 min/床位,重建层厚2 mm。PET图像采集结束后,将二者的图像传送至Xeleris工作站进行后处理。
-
由2名具有副高级以上职称的核医学科医师共同阅片,以CT图像中可见鼻咽部黏膜非对称性增厚或鼻咽部异常软组织影、同层面PET图像病灶处的SUVmax≥2.5作为鼻咽癌的诊断标准[7]。将61例鼻咽癌患者的PET/CT原始图像数据导入图像后处理工作站中,采用德国西门子Syngo TrueD VE13A软件进行代谢参数的测量,以SUVmax=2.5作为固定阈值,SUVmax的40%作为勾画原发灶边界的临界值,通过后处理软件自动勾画ROI,采用软件自适应算法自动计算ROI的SUVmax、平均标准化摄取值(mean standardized uptake value,SUVmean)、肿瘤代谢体积(metabolic tumor volume,MTV),并根据公式计算糖酵解总量(total lesion glycolysis,TLG):TLG=SUVmean×MTV。
-
所有肿瘤标本经10%福尔马林溶液固定及常规组织切片后,采用福州迈新生物技术开发公司生产的鼠抗人EGFR单克隆抗体染色剂,通过链霉菌抗生物素蛋白-过氧化物酶连结(SP)法行EGFR免疫组化染色。EGFR多位于细胞膜,少数位于细胞浆,当二者之一出现棕色颗粒时,视为EGFR阳性。
-
在病理切片肿瘤细胞最密集处采用完全随机法选取5个400倍视野进行评估,根据细胞染色强度及阳性细胞数占总视野中细胞总数的百分比进行半定量分析。染色强度评分标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比评分标准:0分为阴性,1分为阳性细胞百分比≤10%,2分为阳性细胞百分比为11%~50%,3分为阳性细胞百分比为51%~75%,4分为阳性细胞百分比>75%。以阳性细胞百分比×细胞染色强度所得的综合评分对EGFR进行分级:0分为阴性(−),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)[8]。将EGFR表达水平为阴性及弱阳性的患者归为EGFR低表达组,EGFR表达水平为阳性及强阳性的患者归为EGFR高表达组[9]。
-
应用SPSS 25.0软件对所有数据进行统计学分析。采用χ2检验或Fisher确切概率法(当单元格频数<5时,采用Fisher确切概率法)对不同EGFR表达组患者的性别、肿瘤T分期、最大径、病理分型等计数资料进行比较。经S-W小样本正态检验后,结果显示SUVmax、MTV、TLG等计量资料为偏态分布,采用M(P25,P75)表示,两样本的组间比较采用Mann-Whitney U秩和检验;年龄等计量资料符合正态分布,以
$ \bar x$ ±s表示,组间比较采用独立样本t检验(方差齐)。采用单因素Logistic回归方程评估临床病理因素、代谢参数等因素对EGFR表达水平的影响;把单因素分析中差异有统计学意义的因子(P<0.05)纳入多因素Logistic回归分析模型中,评估影响EGFR表达水平的独立影响因素。绘制鼻咽癌患者代谢参数的ROC曲线,并计算AUC,评估其诊断效能,以AUC>0.5作为评估标准,AUC越接近1,表明诊断效能越好。P<0.05为差异有统计学意义。 -
61例鼻咽癌患者EGFR的表达情况:阴性4例、弱阳性23例、阳性18例、强阳性16例;EGFR低表达27例(低表达组)、高表达34例(高表达组);61例鼻咽癌患者EGFR阳性表达率为93%(57/61)。61例鼻咽癌患者肿瘤T分期情况:T1期8例、T2期20例、T3期18例、T4期15例。EGFR高表达组与EGFR低表达组的肿瘤T分期、肿瘤最大径之间的差异均有统计学意义(均P<0.05),而性别、年龄、病理分型之间的差异均无统计学意义(均 P>0.05)(表1)。
组别 男性/女性(例) 年龄( $\bar x $ 

肿瘤T分期(例) 病理分型(例) 肿瘤最大径(例) T1 T2 T3 T4 未分化型癌 鳞癌 分化型癌 <3 cm ≥3 cm EGFR低表达组(n=27) 18/9 51.33±12.01 6 12 7 2 13 12 2 19 8 EGFR高表达组(n=34) 26/8 50.38±13.51 2 8 11 13 21 9 4 14 20 检验值 χ2=0.720 t=−0.087 χ2=11.128 χ2=1.914 χ2=5.165 P值 0.396 0.931 0.010 0.384 0.023 注:EGFR为表皮生长因子受体 表 1 不同EGFR表达组的61例鼻咽癌患者的临床资料比较
Table 1. Comparison of clinical data of 61 nasopharyngeal carcinoma patients between different epidermal growth factor receptor expression groups
-
61例鼻咽癌患者中,EGFR高表达组的SUVmax、MTV、TLG的中位数均明显高于EGFR低表达组,且差异均有统计学意义(均P<0.05)(表2)。
组别 SUVmax MTV(cm3) TLG EGFR低表达组(n=27) 7.80(7.40,13.60) 6.02(4.16,14.67) 50.80(16.35,82.23) EGFR高表达组(n=34) 11.50(12.90,21.21) 8.48(5.75,21.80) 131.89(32.83,241.23) U值 −4.197 −2.273 −2.425 P值 <0.01 0.023 0.015 注:EGFR为表皮生长因子受体;PET/CT为正电子发射断层显像计算机体层摄影技术;SUVmax为最大标准化摄取值;MTV为肿瘤代谢体积;TLG为肿瘤糖酵解总量 表 2 不同EGFR表达组的61例鼻咽癌患者的PET/CT代谢参数比较[ M(P25,P75)]
Table 2. PET/CT metabolism comparison of 61 nasopharyngeal carcinoma patients between different epidermal growth factor receptor expression groups [M(P25, P75)]
-
单因素Logistic回归分析结果表明,肿瘤T分期、肿瘤最大径、SUVmax、MTV、TLG是EGFR表达水平的影响因素;当患者EGFR呈高表达时,肿瘤组织的SUVmax、MTV、TLG越高,其临床分期越晚,肿瘤体积越大(表3)。多因素Logistic分析结果显示,SUVmax(OR=1.340,95%CI:1.019~1.764,P=0.036)是预测 EGFR高表达的独立因素(表4)。
因素 OR值 95%CI P值 性别 1.625 0.527~5.011 0.398 年龄 0.994 0.995~1.035 0.771 肿瘤T分期 0.103 0.018~0.582 0.025 病理分型 未分化型癌 0.887 0.139~5.507 0.875 鳞癌 0.346 0.052~2.310 0.273 分化型癌 1.000 − − 肿瘤最大径 1.612 1.090~2.385 0.017 SUVmax 1.270 1.115~1.446 <0.01 MTV 1.008 1.002~1.014 0.015 TLG 1.085 1.015~1.160 0.016 注:EGFR为表皮生长因子受体;SUVmax为最大标准化摄取值;MTV为肿瘤代谢体积;TLG为肿瘤糖酵解总量;CI为置信区间。−表示无此项数据 表 3 61例鼻咽癌患者EGFR高表达的单因素Logistic回归 分析结果
Table 3. Univariate Logistic regression analysis of high expression of epidermal growth factor receptor in 61 patients with nasopharyngeal carcinoma
因素 OR值 95%CI P值 肿瘤T分期 0.489 0.056~4.298 0.519 肿瘤最大径 0.861 0.482~41.539 0.614 SUVmax 1.340 1.019~1.764 0.036 TLG 0.999 0.980~1.019 0.924 MTV 1.028 0.842~1.255 0.786 注:EGFR为表皮生长因子受体;SUVmax为最大标准化摄取值;TLG为肿瘤糖酵解总量;MTV为肿瘤代谢体积;CI为置信区间 表 4 61例鼻咽癌患者EGFR高表达的多因素Logistic回归 分析结果
Table 4. Multivariate Logistic regression analysis of high expression of epidermal growth factor receptor in 61 patients with nasopharyngeal carcinoma
-
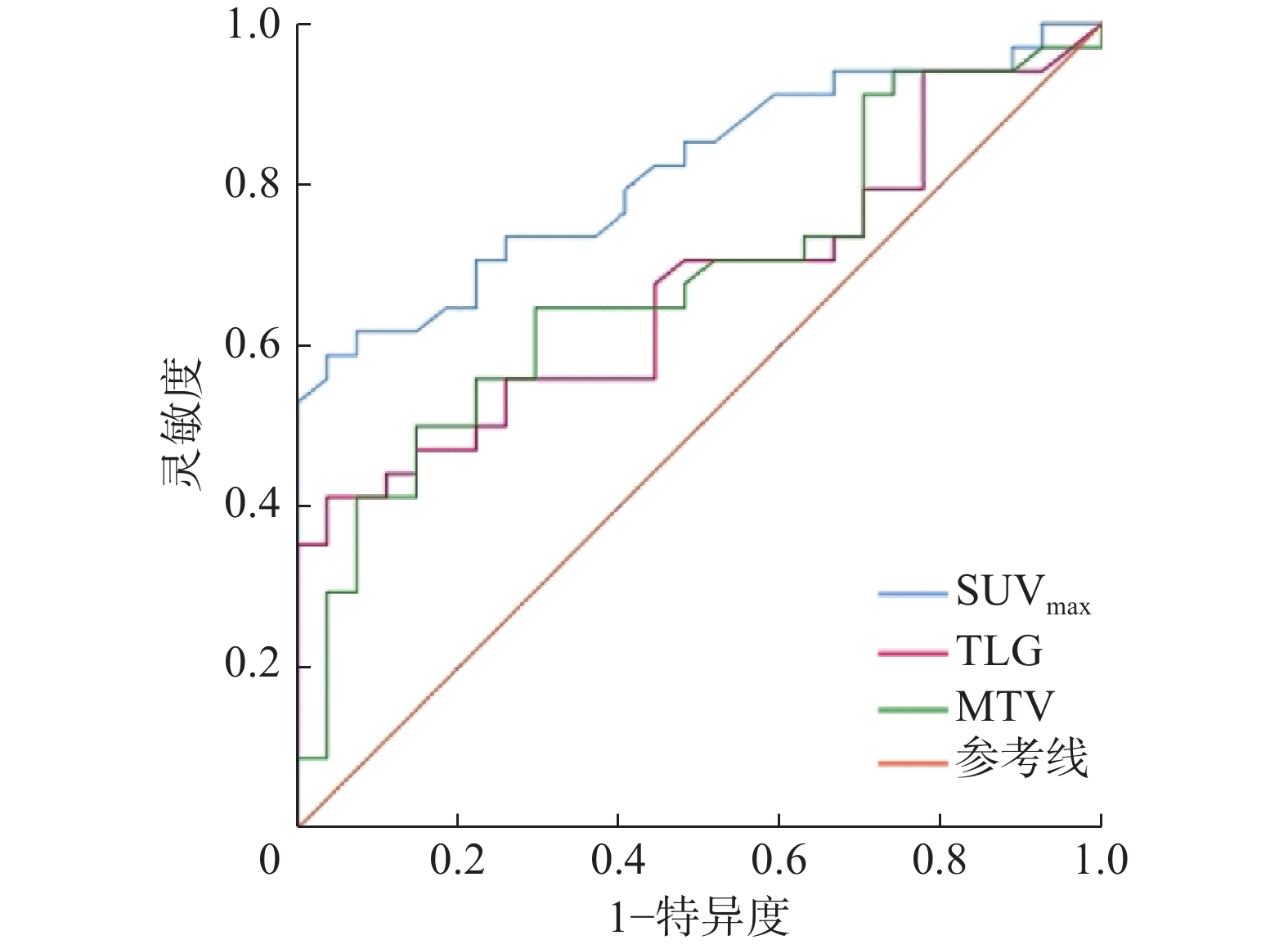
由图1可见,SUVmax预测EGFR高表达的最佳临界值为16.39(AUC=0.815,95%CI:0.709~0.921,P<0.01);MTV的最佳临界值为136.29 cm3(AUC=0.682,95%CI:0.548~0.816,P=0.015);TLG的最佳临界值为19.28(AUC=0.670,95%CI:0.535~0.805,P=0.023);SUVmax的诊断效能优于MTV和TLG。以上述SUVmax、MTV、TLG临界值诊断鼻咽癌的灵敏度分别为58.8%、50.0%、41.2%,特异度分别为96.3%、85.2%、96.3%。
-
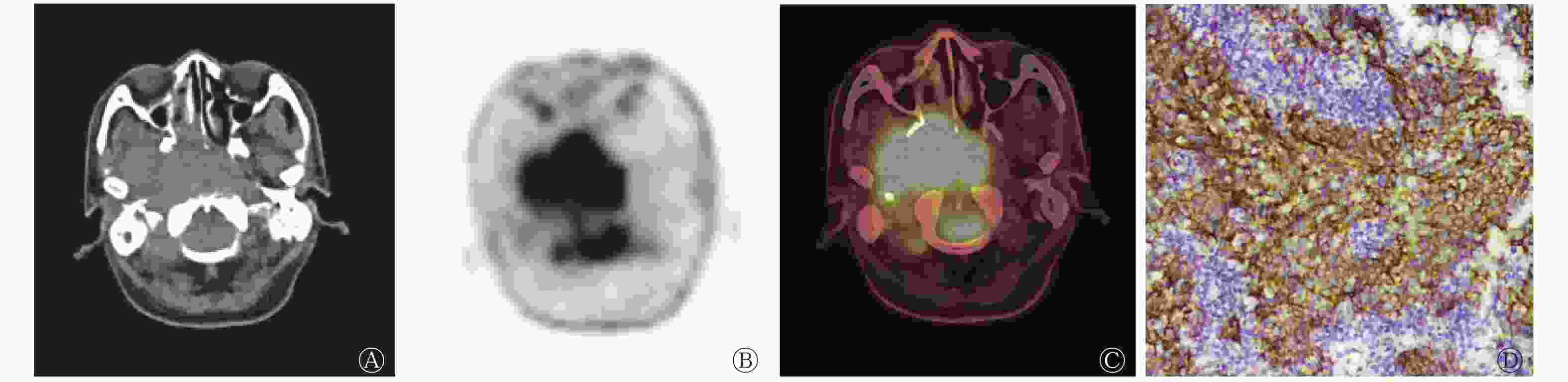
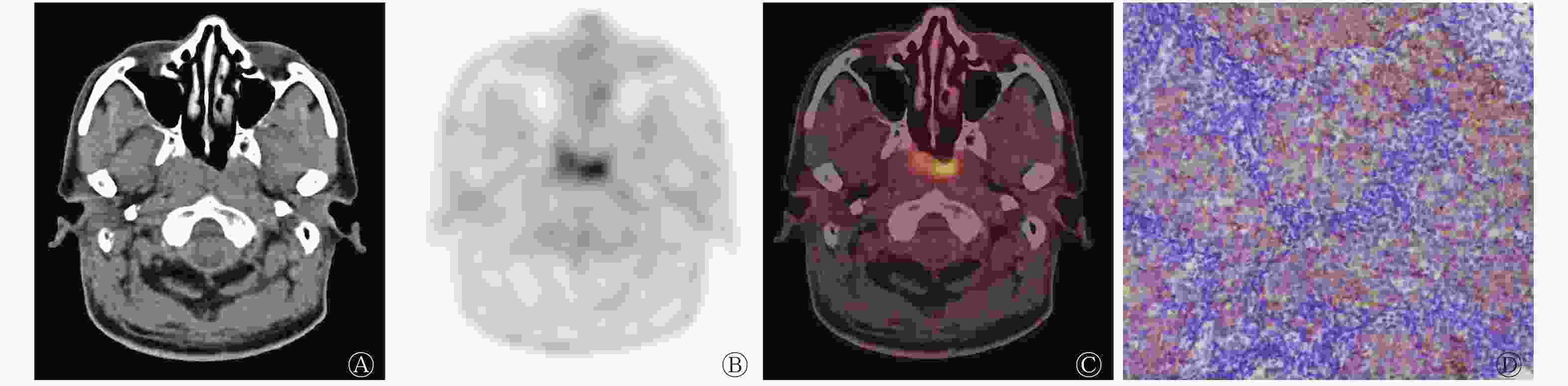
鼻咽癌EGFR高表达患者的SUVmax、MTV、TLG均高于低表达患者(图2、3),EGFR高表达患者肿瘤原发灶的侵犯范围较低表达患者更广。
-
EGFR是ErbB受体家族中的跨膜糖蛋白,EGFR的激活可诱导酪氨酸激酶的磷酸化,提高肿瘤对周围组织的侵袭能力,促进肿瘤细胞的增殖,加速血管生成。EGFR在头颈部、乳腺、肺、消化系统[10-12]等恶性肿瘤中高表达,并与肿瘤的发展和预后相关。相关研究结果表明,EGFR在鼻咽癌中的阳性表达率为30%~95%[9, 13-14]。王勇等[9]对120例鼻咽癌患者的活检标本进行分析,其EGFR总阳性表达率为88.3%。本研究中EGFR的阳性表达率为93.44%,稍高于既往研究结果,其可能原因为入组的T1期鼻咽癌患者较少,多数为T2~T4期的患者,且本研究中EGFR表达阴性的患者多为T1期。Bossi等[3]研究发现,头颈部肿瘤中EGFR的高表达易引起肿瘤组织的放疗抵抗及放疗后复发,EGFR同时也是预测头颈部肿瘤预后不佳的独立危险因素。于剑飞等[13]的研究结果表明,同步放化疗联合应用EGFR靶向药物(尼妥珠单抗)可显著改善晚期鼻咽癌患者的生存质量,降低复发率。因此,近年来以EGFR为靶向药物治疗鼻咽癌的研究越来越得到临床的重视,EGFR靶向药物联合放化疗抑制鼻咽癌细胞的增殖效果明显优于单纯放化疗,可提高肿瘤细胞对放疗的敏感性,远期生存率较单纯放疗更高[14]。
由于受限于活体组织检查技术及标本的质量,部分鼻咽癌患者无法行免疫组化检查以明确EGFR蛋白的表达情况。近年来PET/CT已在肿瘤影像中得到广泛应用,黄鹏等[15]对30例非小细胞肺癌患者的研究结果表明,肺癌病灶中18F-FDG高摄取的区域较18F-FDG低摄取的区域EGFR表达水平更高,EGFR表达水平与肺癌病灶的SUVmax呈正相关,SUVmax可以为放疗剂量的确定提供依据。Lee等[4]的研究结果亦表明,EGFR的表达水平是乳腺癌18F-FDG摄取的主要及独立的决定因素。本研究结果显示,鼻咽癌EGFR高表达组与低表达组间SUVmax的差异有统计学意义,单因素回归分析结果显示,SUVmax与EGFR的表达水平具有一定的相关性。此外,我们还增加了MTV、TLG 2个观察指标,因为SUVmax主要反映的是病灶ROI内肿瘤细胞的最大代谢活性,无法准确反映肿瘤整体的代谢情况。另外,SUVmax易受肿瘤T分期、肿瘤体积、18F-FDG摄取时间等多因素的影响[16-18],不是反映肿瘤组织代谢情况的最佳指标。近年来,18F-FDG PET/CT代谢参数中的MTV受到广泛关注,MTV反映的是当肿瘤组织处于某个特定的SUV时(通常将SUV≥2.5作为观测指标),其内具有异常代谢活性的肿瘤的体积;TLG是在肿瘤组织的SUVmean×MTV的基础上计算而得,其既能反映MTV,又兼顾了肿瘤组织的糖酵解水平;相比SUVmax,MTV和TLG能给临床提供更多的诊断信息[19]。杨易等[20]研究发现,MTV和TLG在鼻咽癌转移组与无转移组中的差异有统计学意义,MTV对于鼻咽癌淋巴结转移的诊断效能优于TLG和SUVmax,此外MTV还可预测肿瘤组织的恶性程度及临床分期。张倩等[21]对乳腺癌的淋巴结转移及远处转移的研究结果显示,转移组的SUVmax、MTV和TLG均高于无转移组,且差异均有统计学意义。
目前国内外关于鼻咽癌EGFR表达水平与SUVmax、MTV和TLG的相关性报道鲜见,国内外对肿瘤组织EGFR的表达水平与代谢参数的相关性的研究主要以非小细胞肺癌为主。姜阳等[22]对105例非小细胞肺癌患者的研究结果显示,EGFR突变组患者的MTV和TLG均显著低于野生组,SUVmax和MTV是预测EGFR突变的独立影响因素,ROC曲线结果表明,MTV预测EGFR突变的AUC的价值大于TLG和SUVmax,其诊断效能最佳。Surov等[23]对宫颈癌患者的研究结果显示,SUVmax、MTV和TLG与EGFR的表达水平呈正相关,MTV和TLG能反映宫颈癌患者EGFR的表达情况。Lin等[24]对头颈部鳞癌患者的研究结果亦表明,SUVmax、MTV和TLG与EGFR的过表达相关。
在本研究中,EGFR低表达组的SUVmax、MTV和TLG均低于EGFR高表达组,这可能与肿瘤组织的生物学活性相关,EGFR低表达组的鼻咽癌患者多为早期患者,其恶性程度、侵袭范围低于高表达组,细胞增殖能力亦弱于高表达组,因此所需葡萄糖能量不及高表达组。鼻咽癌EGFR表达水平与SUVmax、TLG和MTV相关,其原因可能为EGFR的过表达激活内源性酪氨酸激酶,促进酪氨酸激酶及细胞内信号分子磷酸化,通过Ras-丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇−激酶(PI3K)/蛋白激酶B(AKT)等途径促进葡萄糖转运体增加,同时促进组织细胞的快速增殖及新生血管的生成[25],肿瘤组织对葡萄糖的需求加大,18F-FDG作为葡萄糖的衍生物,EGFR高表达的肿瘤组织对18F-FDG的摄取率亦增高。此外,本研究通过采用Syngo软件自动勾画鼻咽癌代谢病灶的边缘,自动计算病灶的MTV、TLG,此操作可重复性高,避免了以往手动勾画所造成的误差。
在本研究中,我们还探讨了性别、年龄、病理分型、肿瘤T分期、肿瘤最大径等因素对鼻咽癌EGFR表达水平的影响,结果显示EGFR的表达水平与肿瘤T分期和肿瘤最大径呈正相关,而与性别、年龄和病理分型等因素无关,与奚少彦等[26]的研究结果基本相符。单因素分析结果显示,肿瘤T分期和肿瘤最大径、SUVmax、MTV和TLG与鼻咽癌EGFR表达水平呈正相关,可以作为预测EGFR表达水平的因素,而性别、年龄、病理分型与EGFR表达水平无关;多因素分析结果显示,SUVmax可以作为预测EGFR表达水平的独立因素,而MTV、TLG、肿瘤T分期和肿瘤最大径与EGFR表达水平无关,其原因可能为TLG是由MTV和SUVmean的乘积而得,受到肿瘤体积、MTV及SUVmean的影响,而肿瘤T分期主要以肿瘤的侵犯范围来划分,肿瘤体积亦会影响T分期。在MTV、TLG、肿瘤T分期与肿瘤最大径的相互影响降低了它们对EGFR表达水平的预测能力。
本研究通过对ROC曲线的分析结果显示,SUVmax对于预测EGFR表达水平的诊断效能优于MTV和TLG,MTV和TLG对于预测EGFR表达水平的诊断效能大致相仿,当SUVmax临界值为16.39时,AUC为0.815,其灵敏度、特异度分别为58.8%、96.3%。综合以上结果,SUVmax、MTV、TLG、肿瘤T分期和肿瘤最大径与鼻咽癌EGFR表达水平具有一定的关联性,特别是SUVmax,可以作为预测EGFR表达水平的独立影响因素,这一特点能为无法取得活体组织检查或无法行免疫组化检查的鼻咽癌患者在放化疗前预测EGFR表达水平提供一定的影像学依据,有助于临床医师选择治疗方法及预测患者的放疗效果。
综上所述,18F-FDG PET/CT代谢参数SUVmax可作为鼻咽癌患者EGFR表达水平的独立预测因素,在活体组织检查技术不足或标本质量不佳的情况下,临床上可根据鼻咽癌患者SUVmax的结果对EGFR表达水平进行无创性评估。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 黄筱晓负责研究命题的提出与设计、数据的收集与分析、论文的撰写;崔慧勤、邓燕云负责论文的写作指导与完善;滕才钧、韦建林负责相关数据的收集与分析;覃丽兰负责患者临床资料和影像资料的收集与处理。
鼻咽癌18F-FDG PET/CT 代谢参数与EGFR表达水平的相关性研究
Correlation study of 18F-FDG PET/CT metabolic parameters and EGFR expression level in nasopharyngeal carcinoma
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG) PET/CT相关代谢参数预测鼻咽癌治疗前表皮生长因子受体(EGFR)表达水平的价值。 方法 回顾性分析2017年1月至2019年11月广西省柳州市工人医院收治的61例[男性44例、女性17例,年龄21~84(57.8±6.2)岁]经组织病理学检查确诊的鼻咽癌患者的临床资料及PET/CT显像资料。分析所有患者的18F-FDG PET/CT图像,计算最大标准化摄取值(SUVmax)、肿瘤代谢体积(MTV)、肿瘤糖酵解总量(TLG)。所有患者的肿瘤标本经链霉菌抗生物素蛋白-过氧化物酶连结(sp)法免疫组织化学染色法染色后,计算标本的EGFR阳性表达情况。采用χ2检验或Fisher确切概率法分析性别、肿瘤T分期、最大径、病理分型等计数资料;SUVmax、MTV、TLG两样本的组间比较采用Mann-Whitney U秩和检验;年龄的组间比较采用独立样本t检验。采用单因素Logistic回归方程分析临床病理因素、代谢参数等因素对EGFR表达水平的影响,把单因素分析中差异有统计学意义的因素纳入多因素Logistic回归分析模型中,评估EGFR表达水平的独立影响因素。绘制鼻咽癌患者代谢参数的受试者工作特征(ROC)曲线,评估其诊断效能。 结果 61例鼻咽癌患者的EGFR阳性表达率为93%(57/61),EGFR高表达34例(高表达组),EGFR低表达27例(低表达组)。EGFR高表达组的SUVmax、MTV、TLG明显高于低表达组(U=−4.197、−2.273、−2.425,均P<0.05)。EGFR高表达组与EGFR低表达组在肿瘤T分期、肿瘤最大径之间的差异均有统计学意义(χ2=11.128、5.165,均P<0.05),而在性别(χ2=0.720)、年龄(t=−0.087)、病理分型(χ2=1.914)之间的差异均无统计学意义(均P>0.05)。单因素回归分析结果显示,肿瘤T分期(OR=0.103,95%CI:0.018~0.582,P=0.025)、肿瘤最大径(OR=1.612,95%CI:1.090~2.385,P=0.017)、SUVmax(OR=1.270,95%CI:1.115~1.446,P<0.01)、MTV(OR=1.008,95%CI:1.002~1.014,P=0.015)、TLG(OR=1.085,95%CI:1.015~1.160,P=0.016)是EGFR表达水平的影响因素。多因素回归分析结果显示,SUVmax(OR=1.340,95%CI:1.019~1.764,P=0.036)是预测EGFR高表达的独立影响因素。ROC曲线结果表明,SUVmax[曲线下面积(AUC)=0.815,95%CI:0.709~0.921,P<0.01]对于预测EGFR高表达的诊断效能优于MTV(AUC=0.682,95%CI:0.548~0.816,P=0.015)、TLG(AUC=0.670,95%CI:0.535~0.805,P=0.023)。SUVmax、MTV、TLG临界值分别为16.39、136.29 cm3、19.28时诊断鼻咽癌的灵敏度分别为58.8%、50.0%、41.2%,特异度分别为96.3%、85.2%、96.3%。 结论 18F-FDG PET/CT代谢参数SUVmax可作为预测鼻咽癌患者EGFR表达水平的独立影响因素。 -
关键词:
- 鼻咽癌 /
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 最大标准化摄取值 /
- 肿瘤代谢体积 /
- 糖酵解总量 /
- 表皮生长因子受体
Abstract:Objective To investigate the value of 18F-fluorodeoxyglucose (FDG) PET/CT related metabolic parameters in predicting epidermal growth factor receptor (EGFR) expression levels before the treatment of nasopharyngeal carcinoma (NPC). Methods The clinical and PET/CT imaging data of 61 patients (44 males and 17 females, aged 21–84 (57.8±6.2) years) with NPC that was diagnosed via hiopathological examination and who were admitted to the Nuclear Medicine Department of Guangxi Liuzhou Worker's Hospital from January 2017 to November 2019 were retrospectively analyzed. The 18F-FDG PET/CT images of all patients were analyzed to calculate the maximum standard uptake value (SUVmax), tumor metabolic volume (MTV), and total lesion glycolysis (TLG). The samples of all patients were subjected to streptavidin-perosidase immunohistochemical staining, and the positive expression of EGFR was calculated. Gender, T stage, pathological classification, maximum tumor diameter, and other enumeration data were analyzed through χ2 test or Fisher's exact probability. Mann–Whitney U test was adopted for the comparison of SUVmax, MTV, and TLG between two samples. Independent samples t test was applied for the comparison of ages between groups. Single factorial Logistic regression equation was used for the analysis of clinicopathological factors and metabolic parameters to evaluate the predictors of EGFR expression levels, and factors (P<0.05) with statistical significance in single factorial analysis were included in the multiple factorial Logistic regression analysis model to evaluate the independent predictors of EGFR expression levels. The receiver operator characteristic (ROC) curves of the three groups of the metabolic parameters of patients with NPC were drawn to evaluate diagnostic efficacy. Results The 61 NPC patients had positive EGFR expression rates of 93% (57/61). Among the patients, 34 had high EGFR expression levels and 27 had low EGFR expression levels. The SUVmax, MTV, and TLG of the high EGFR expression group were evidently higher than those of the low EGFR expression group (U=−4.197, −2.273, −2.425; all P<0.05). T stage and maximum tumor diameter were related to EGFR expression levels (χ2=11.128, 5.165; both P<0.05), whereas the difference in gender (χ2=0.720), age (t=−0.087), and pathological classification (χ2=1.914) between the high and low EGFR expression groups lacked statistical significance (all P>0.05). Single factorial regression analysis showed that patients with high T stage (OR=0.103, 95%CI: 0.018–0.582, P=0.025), maximum tumor diameter (OR=1.612, 95%CI: 1.090–2.385, P=0.017), SUVmax (OR=1.270, 95%CI: 1.115–1.446, P<0.01), MTV (OR=1.008, 95%CI: 1.002–1.014, P=0.015), and TLG (OR=1.085, 95%CI: 1.015–1.160, P=0.016) were likely to have high EGFR expression, and multiple factorial regression analysis indicated that SUVmax (OR=1.340, 95%CI: 1.019–1.764, P=0.036) was the independent predictor of high EGFR expression levels. The ROC curves indicated that the diagnostic efficacy of SUVmax (AUC=0.815, 95%CI: 0.709–0.921, P<0.01) in predicting high EGFR expression levels was obviously superior to that of MTV (AUC=0.682, 95%CI: 0.548–0.816, P=0.015) and TLG (AUC=0.670, 95%CI: 0.535–0.805, P=0.023). When the critital values of SUVmax, MTV and TLG were 16.39, 136.29 cm3, 19.28 respectively, the sensitivities were 58.8%, 50.0%, and 41.2%, respectively, and the specificities were 96.3%, 85.2%, and 96.3%, respectively. Conclusions The metabolic parameter SUVmax of 18F-FDG PET/CT can serve as the independent predictor of EGFR expression levels in patients with NPC. Moreover, 18F-FDG PET/CT examination can enable the noninvasive assessment of EGFR expression levels. -
表 1 不同EGFR表达组的61例鼻咽癌患者的临床资料比较
Table 1. Comparison of clinical data of 61 nasopharyngeal carcinoma patients between different epidermal growth factor receptor expression groups
组别 男性/女性(例) 年龄( $\bar x $ 

肿瘤T分期(例) 病理分型(例) 肿瘤最大径(例) T1 T2 T3 T4 未分化型癌 鳞癌 分化型癌 <3 cm ≥3 cm EGFR低表达组(n=27) 18/9 51.33±12.01 6 12 7 2 13 12 2 19 8 EGFR高表达组(n=34) 26/8 50.38±13.51 2 8 11 13 21 9 4 14 20 检验值 χ2=0.720 t=−0.087 χ2=11.128 χ2=1.914 χ2=5.165 P值 0.396 0.931 0.010 0.384 0.023 注:EGFR为表皮生长因子受体 表 2 不同EGFR表达组的61例鼻咽癌患者的PET/CT代谢参数比较[ M(P25,P75)]
Table 2. PET/CT metabolism comparison of 61 nasopharyngeal carcinoma patients between different epidermal growth factor receptor expression groups [M(P25, P75)]
组别 SUVmax MTV(cm3) TLG EGFR低表达组(n=27) 7.80(7.40,13.60) 6.02(4.16,14.67) 50.80(16.35,82.23) EGFR高表达组(n=34) 11.50(12.90,21.21) 8.48(5.75,21.80) 131.89(32.83,241.23) U值 −4.197 −2.273 −2.425 P值 <0.01 0.023 0.015 注:EGFR为表皮生长因子受体;PET/CT为正电子发射断层显像计算机体层摄影技术;SUVmax为最大标准化摄取值;MTV为肿瘤代谢体积;TLG为肿瘤糖酵解总量 表 3 61例鼻咽癌患者EGFR高表达的单因素Logistic回归 分析结果
Table 3. Univariate Logistic regression analysis of high expression of epidermal growth factor receptor in 61 patients with nasopharyngeal carcinoma
因素 OR值 95%CI P值 性别 1.625 0.527~5.011 0.398 年龄 0.994 0.995~1.035 0.771 肿瘤T分期 0.103 0.018~0.582 0.025 病理分型 未分化型癌 0.887 0.139~5.507 0.875 鳞癌 0.346 0.052~2.310 0.273 分化型癌 1.000 − − 肿瘤最大径 1.612 1.090~2.385 0.017 SUVmax 1.270 1.115~1.446 <0.01 MTV 1.008 1.002~1.014 0.015 TLG 1.085 1.015~1.160 0.016 注:EGFR为表皮生长因子受体;SUVmax为最大标准化摄取值;MTV为肿瘤代谢体积;TLG为肿瘤糖酵解总量;CI为置信区间。−表示无此项数据 表 4 61例鼻咽癌患者EGFR高表达的多因素Logistic回归 分析结果
Table 4. Multivariate Logistic regression analysis of high expression of epidermal growth factor receptor in 61 patients with nasopharyngeal carcinoma
因素 OR值 95%CI P值 肿瘤T分期 0.489 0.056~4.298 0.519 肿瘤最大径 0.861 0.482~41.539 0.614 SUVmax 1.340 1.019~1.764 0.036 TLG 0.999 0.980~1.019 0.924 MTV 1.028 0.842~1.255 0.786 注:EGFR为表皮生长因子受体;SUVmax为最大标准化摄取值;TLG为肿瘤糖酵解总量;MTV为肿瘤代谢体积;CI为置信区间 -
[1] Zhang P, Wu SK, Wang Y, et al. p53, MDM2, eIF4E and EGFR expression in nasopharyngeal carcinoma and their correlation with clinicopathological characteristics and prognosis: a retrospective study[J]. Oncol Lett, 2015, 9(1): 113−118. DOI: 10.3892/ol.2014.2631. [2] Chen SN, Tang YH, Tan YX, et al. EGFR-PKM2 signaling promotes the metastatic potential of nasopharyngeal carcinoma through induction of FOSL1 and ANTXR2[J]. Carcinogenesis, 2020, 41(6): 723−733. DOI: 10.1093/carcin/bgz180. [3] Bossi P, Resteghini C, Paielli N, et al. Prognostic and predictive value of EGFR in head and neck squamous cell carcinoma[J/OL]. Oncotarget, 2016, 7(45): 74362−74379[2020-07-08]. https://pubmed.ncbi.nlm.nih.gov/27556186. DOI: 10.18632/oncotarget.11413. [4] Lee J, Lee EJ, Moon SH, et al. Strong association of epidermal growth factor receptor status with breast cancer FDG uptake[J]. Eur J Nucl Med Mol Imaging, 2017, 44(9): 1438−1447. DOI: 10.1007/s00259-017-3705-5. [5] Pan JJ, Ng WT, Zong JF, et al. Proposal for the 8th edition of the AJCC/UICC staging system for nasopharyngeal cancer in the era of intensity-modulated radiotherapy[J]. Cancer, 2016, 122(4): 546−558. DOI: 10.1002/cncr.29795. [6] Thompson LDR, Franchi A. New tumor entities in the 4th edition of the World Health Organization classification of head and neck tumors: nasal cavity, paranasal sinuses and skull base[J]. Virchows Arch, 2018, 472(3): 315−330. DOI: 10.1007/s00428-017-2116-0. [7] Anderson CM, Chang T, Graham MM, et al. Change of maximum standardized uptake value slope in dynamic triphasic[18F]-fluorodeoxyglucose positron emission tomography/computed tomography distinguishes malignancy from postradiation inflammation in head-and-neck squamous cell carcinoma: a prospective trial[J]. Int J Radiat Oncol Biol Phys, 2015, 91(3): 472−479. DOI: 10.1016/j.ijrobp.2014.11.002. [8] 许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996, 6(4): 229−231. DOI: 10.19401/j.cnki.1007-3639.1996.04.001.
Xu LZ, Yang WT. Criteria of immunohistochemical reaction results[J]. China Oncol, 1996, 6(4): 229−231. DOI: 10.19401/j.cnki.1007-3639.1996.04.001.[9] 王勇, 吴波, 孙华丽, 等. 鼻咽癌EGFR、HLA-F表达水平及调强放疗预后的影响因素分析[J]. 浙江医学, 2019, 41(17): 1826−1830. DOI: 10.12056/j.issn.1006-2785.2019.41.17.2018-2721.
Wang Y, Wu B, Sun HL, et al. Expression of EGFR and HLA-F in nasopharyngeal carcinoma and their prognostic value[J]. Zhejiang Med J, 2019, 41(17): 1826−1830. DOI: 10.12056/j.issn.1006-2785.2019.41.17.2018-2721.[10] Wang X, Niu HT, Fan QX, et al. Predictive value of EGFR overexpression and gene amplification on icotinib efficacy in patients with advanced esophageal squamous cell carcinoma[J/OL]. Oncotarget, 2016, 7(17): 24744−24751[2020-07-08]. https://pubmed.ncbi.nlm.nih.gov/27013591. DOI: 10.18632/oncotarget.8271. [11] 孟谊, 杨杨, 樊祥山, 等. VEGF、EGFR的表达与非小细胞肺癌生物学行为的相关性[J]. 现代肿瘤医学, 2015, 23(5): 633−636. DOI: 10.3969/j.issn.1672-4992.2015.05.16.
Meng Y, Yang Y, Fan XS, et al. The correlation between expressions of VEGF and EGFR and biological behavior in non-small cell lung cancer (NSCLC)[J]. J Mod Oncol, 2015, 23(5): 633−636. DOI: 10.3969/j.issn.1672-4992.2015.05.16.[12] 王华, 王志红. 结直肠癌中EGFR、HER-2及PTEN的表达及临床意义[J]. 中国卫生标准管理, 2017, 8(14): 128−131. DOI: 10.3969/j.issn.1674-9316.2017.14.072.
Wang H, Wang ZH. Expression and clinical significance of EGFR, HER-2 and PTEN in colorectal carcinoma[J]. China Health Stand Manage, 2017, 8(14): 128−131. DOI: 10.3969/j.issn.1674-9316.2017.14.072.[13] 于剑飞, 崔慧林, 王宏卫. 尼妥珠单抗联合调强放疗与吡柔比星化疗对EGFR阳性晚期鼻咽癌的疗效分析[J]. 实用癌症杂志, 2020, 35(4): 566−569. DOI: 10.3969/j.issn.1001-5930.2020.04.012.
Yu JF, Cui HL, Wang HW. Therapeutic effect of nimotuzumab combined with intensity-modulated radiotherapy and pirarubicin chemotherapy on EGFR-positive advanced nasopharyngeal carcinoma[J]. Pract J Cancer, 2020, 35(4): 566−569. DOI: 10.3969/j.issn.1001-5930.2020.04.012.[14] You R, Hua YJ, Liu YP, et al. Concurrent chemoradiotherapy with or without anti-EGFR-targeted treatment for stage Ⅱ-Ⅳb nasopharyngeal carcinoma: retrospective analysis with a large cohort and long follow-up[J/OL]. Theranostics, 2017, 7(8): 2314−2324[2020-07-08]. https://pubmed.ncbi.nlm.nih.gov/28740554. DOI: 10.7150/thno.19710. [15] Huang P, Liu XG, Song H, et al. Correlation between the expression of EGFR and 18F-FDG-PET SUVmax in non-small cell lung cancer[J]. 现代生物医学进展, 2011, 11(8): 1479−1483. DOI: 10.13241/j.cnki.pmb.2011.08.046.
[16] 孙新儒, 胡莹莹, 张旭, 等. 18F-FDG PET/CT SUV在鼻咽癌T分期中的价值[J]. 中山大学学报: 医学科学版, 2010, 31(4): 535−539. DOI: 10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2010.0114.
Sun XR, Hu YY, Zhang X, et al. Value of 18F-FDG PET/CT SUV in T stages of nasopharyngeal carcinoma[J]. J Sun Yat-Sen Univ (Med Sci), 2010, 31(4): 535−539. DOI: 10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2010.0114.[17] Kaneko Y, Murray WK, Link E, et al. Improving patient selection for 18F-FDG PET scanning in the staging of gastric cancer[J]. J Nucl Med, 2015, 56(4): 523−529. DOI: 10.2967/jnumed.114.150946. [18] 吕清湖, 唐明灯, 林端瑜, 等. 原发鼻咽淋巴瘤与鼻咽癌的18F-FDG PET/CT诊断与鉴别[J]. 国际放射医学核医学杂志, 2017, 41(3): 166−172. DOI: 10.3760/cma.j.issn.1673-4114.2017.03.002.
Lyu QH, Tang MD, Lin DY, et al. Value of 18F-FDG PET/CT examination in the differential diagnosis of primary nasopharyngeal lymphoma and nasopharyngeal carcinoma[J]. Int J Radiat Med Nucl Med, 2017, 41(3): 166−172. DOI: 10.3760/cma.j.issn.1673-4114.2017.03.002.[19] Lee JW, Kang CM, Choi HJ, et al. Prognostic value of metabolic tumor volume and total lesion glycolysis on preoperative 18F-FDG PET/CT in patients with pancreatic cancer[J]. J Nucl Med, 2014, 55(6): 898−904. DOI: 10.2967/jnumed.113.131847. [20] 杨易, 张依凡, 展凤麟, 等. 18F-FDG PET/CT代谢参数在诊断鼻咽癌及预测其转移中的应用价值[J/OL]. 临床医药文献电子杂志, 2020, 7(22): 8−10[2020-07-08]. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_lcyydzzz202022005. DOI: 10.16281/j.cnki.jocml.2020.22.005.
Yang Y, Zhang YF, Zhan FL, et al. The application value of 18F-FDG PET/CT metabolic parameters in the diagnosis and prediction of nasopharyngeal carcinoma[J/OL]. Electron J Clin Med Lit, 2020, 7(22): 8−10 [2020-07-08]. http://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_lcyydzzz202022005. DOI: 10.16281/j.cnki.jocml.2020.22.005.[21] 张倩, 辛军, 李红. 18F-FDG PET/CT显像半定量参数MTV、TLG联合SUV在乳腺癌诊断中的应用价值[J]. 中国临床医学影像杂志, 2016, 27(9): 620−624.
Zhang Q, Xin J, Li H. Clinical value of 18F-FDG uptake, described by metabolic tumor volume, total lesion glycolysis and standard uptake values in breast cancer[J]. J China Clin Med Imaging, 2016, 27(9): 620−624.[22] 姜阳, 马晓伟, 董楚宁, 等. 基于18F-FDG PET-CT代谢参数的风险模型对非小细胞肺癌EGFR基因突变的预测价值及效能评价[J]. 中华放射学杂志, 2020, 54(7): 688−693. DOI: 10.3760/cma.j.cn112149-20190731-00652.
Jiang Y, Ma XW, Dong CN, et al. The predictive value and efficacy of the risk model based on the metabolic parameters of 18F-FDG PET-CT for EGFR gene mutations in non-small cell lung cancer[J]. Chin J Radiol, 2020, 54(7): 688−693. DOI: 10.3760/cma.j.cn112149-20190731-00652.[23] Surov A, Meyer HJ, Höhn AK, et al. Metabolo-volumetric parameters of 18F-FDG-PET can predict expression of EGFR and HIF 1alpha in uterine cervical cancer[J]. Cancer Biomark, 2019, 24(1): 135−140. DOI: 10.3233/CBM-182019. [24] Lin YC, Chen RY, Chen SW, et al. Immunohistochemical studies and fluorodeoxyglucose uptake on positron emission tomography in pharyngeal cancer for predicting radiotherapy-based treatment outcomes[J]. Clin Otolaryngol, 2017, 42(3): 608−619. DOI: 10.1111/coa.12783. [25] Ruan L, Li XH, Wan XX, et al. Analysis of EGFR signaling pathway in nasopharyngeal carcinoma cells by quantitative phosphoproteomics[J/OL]. Proteome Sci, 2011, 9(1): 35[2020-07-08]. https://pubmed.ncbi.nlm.nih.gov/21711528. DOI: 10.1186/1477-5956-9-35. [26] 奚少彦, 吴秋良, 宗永生, 等. 环氧化酶-2、表皮生长因子受体与Ki-67在鼻咽癌中表达的临床病理意义[J]. 广东医学, 2012, 33(10): 1422−1425. DOI: 10.13820/j.cnki.gdyx.2012.10.064.
Xi SY, Wu QL, Zong YS, et al. Clinicopathological significance of cox-2 epidermal growth factor receptor and Ki-67 expression in nasopharyngeal carcinoma[J]. Guangdong Med J, 2012, 33(10): 1422−1425. DOI: 10.13820/j.cnki.gdyx.2012.10.064. -





 下载:
下载: