-
电离辐射(ionizing radiation,IR)是指波长短、频率高、能量高的射线或粒子与物质作用引起电离的辐射。其可通过直接或间接作用引起生物辐射性损伤[1]。近年来IR广泛应用于X射线检查、CT检查、肿瘤治疗和介入治疗等工业和医疗领域。众所周知,肿瘤患者在接受局部放疗时,射线会对肿瘤组织远端的正常组织产生影响,诱发疾病,如乳腺癌患者和霍奇金淋巴瘤患者在高剂量放疗后期会出现辐射诱发的心血管疾病[2-3];头颈部肿瘤患者接受放疗后,中风风险增加[4];IR还会促进与老化相关的神经退行性疾病的发展等[5-6]。血管内皮细胞(vascular endothelial cells,VEC)对IR敏感,是位于血液与血管壁之间的单层扁平细胞,它不仅是血液和组织之间的保护屏障,也是内分泌细胞。在控制血管张力和血液流动性、维持凝血和纤溶之间的平衡、调节免疫反应和血管生成等方面发挥着重要的作用[7]。
Bautista-Niño等[8]的研究结果表明,IR可诱导VEC衰老,而VEC衰老会导致心血管功能障碍,诱发心血管疾病[9-10],我们对IR诱导VEC衰老的特征、作用机制以及可能诱发的相关疾病等方面进行简要综述,并简单对非编码RNA在IR诱导VEC衰老方面的研究进行展望。
-
细胞衰老是指细胞经过有限的分裂次数后,进入不可逆、永久性的细胞周期停滞,但仍可保持代谢和转录活性。根据其发生机制可分为复制性细胞衰老和应激性细胞衰老两类[11]。IR可通过氧化应激和DNA损伤诱导细胞发生应激性衰老。不同剂量的IR均可诱导VEC衰老(表1),由表1可知,IR在体内外均可诱导VEC衰老,人脐静脉内皮细胞为常用的实验材料,多数研究集中在单次高剂量照射处理,有少数研究是以低剂量照射或多次累积照射处理。
序号 实验材料 射线类型 总剂量(剂量率) 主要发现 研究者 1 HBMVEC γ射线 4 Gy
(3.81 Gy/min)PGC1α乙酰化是IR诱导VEC衰老的重要
因素Kim等[5] 7周龄雄性C57BL/6
小鼠X射线 8 Gy 2 bEnd.3 X射线 20 Gy IR诱导脑微VEC衰老 McRobb等[6] 3 HUVEC γ射线 0.69、2.07、4.13 Gy
(4.1 mGy/h)慢性低剂量率γ射线可诱导HUVEC衰老 Yentrapalli等[12] 4 大鼠肾小球内皮细胞 X射线 20 Gy
(4.96 Gy/min)IR诱导肾小球VEC衰老,IL-6为主要SASP Aratani等[13] 7~8周龄雄性Dark
Agti大鼠X射线 18 Gy
(1.34 Gy/min)5 HUVEC γ射线 4 Gy
(2.82 Gy/min)IGFBP5参与IR诱导的衰老 Kim等[14] 6 TICAE X射线 0.05、0.1、0.5、2 Gy
(0.5 Gy/min)IR诱导VEC衰老,且IL-6和CCL2的表达水平
增加Baselet等[15] 7 HCAEC X射线 0.5 Gy
(0.5 Gy/min)IR诱导HCAEC衰老,且p16和p21的表达水平
显著增加Azimzadeh等[16] 8 HUVEC X射线 8、15 Gy IR通过TGF-BRI/ALK5抑制血管生成 Imaizumi等[17] 9 HAEC − 4 Gy GDF15通过ROS介导的p16途径参与IR诱导的HAEC衰老 Park等[18] 10 HUVEC X射线 0~8 Gy
(1.3 Gy/min)维生素D通过调节MAPK/SIRT1信号通路抑制HUVEC衰老 Marampon等[19] 11 HUVEC γ射线 0.2 Gy Ku86抑制低剂量IR诱导的HUVEC衰老和凋亡 Wu等[20] 12 HUVEC γ射线 4.032 Gy
(2.4 mGy/h)PI3K/AKT/mTOR通路与IR诱导的细胞衰老
相关Yentrapalli等[21] 13 HPAEC X射线 10 Gy
(2.4 Gy/min)IGF-1R是IR诱导细胞衰老的关键调节因子 Panganiban等[22] 14 HUVEC γ射线 2.066、4.133 Gy
(4.1 mGy/h)4.1 mGy/h照射的HUVEC衰老,且IGFBP5
参与IR诱导的衰老Rombouts等[23] 15 HBMVEC γ射线 4 Gy
(3.5 Gy/min)CXCR4和SDF-1在体内外均可抑制辐射诱导
的内皮细胞衰老Heo等[24] 7周龄雌性C57BL/6
和BALB/c裸鼠X射线 8 Gy
(2 Gy/min)16 HUVEC γ射线 2、4、8 Gy
(2 Gy/min)IR通过DSB/NEMO/NF-кB信号通路诱导VEC
衰老Dong等[25] 17 HMVEC-L X射线 15 Gy p53和O2·−/Cplx Ⅱ参与IR诱导的VEC衰老 Lafargue等[26] 18 HUVEC和HMVEC γ射线 10 Gy 微小RNA-494和微小RNA-99b通过MRN复
合物抑制DNA修复,导致细胞衰老Espinosa-Diez等[27] 19 TICAE X射线 10 Gy CD44启动子在IR诱导的衰老内皮细胞中起着重要的作用 Lowe等[28] 注:HBMVEC为人脑部微血管内皮细胞;bEnd.3为小鼠脑微血管内皮细胞系;HUVEC为人脐静脉内皮细胞;TICAE为端粒酶永生化的人冠状动脉内皮细胞;HCAEC为人冠状动脉内皮细胞;HAEC为人主动脉内皮细胞;HPAEC为人肺动脉内皮细胞;HBMVEC为人脑部微血管内皮细胞;HMVEC-L为人肺微血管内皮细胞;PGC1α为过氧化物酶体增殖物激活受体γ辅激活因子1α;VEC为血管内皮细胞;IL-6为白细胞介素6;SASP为衰老相关的分泌表型;IGFBP5为胰岛素样生长因子结合蛋白5;CCL2为趋化因子2;TGF-BRI为转化生长因子Ⅰ型受体;ALK5为激活素受体样酶5;GDF15为生长分化因子15;ROS为活性氧;MAPK为丝裂原活化蛋白激酶;SIRT1为沉默信息调节因子2相关酶1;Ku86为参与非同源末端连接过程的一个关键分子;PI3K为磷脂酰肌醇-3-激酶;AKT为蛋白激酶 B;mTOR为雷帕霉素靶蛋白;IGF1R为胰岛素样生长因子1受体;CXCR4为CXC趋化因子受体4;SDF-1为基质细胞衍生因子1;DSB为DNA双链断裂;NEMO为NF-κB必须调节蛋白;NF-кB为核因子кB;O2ˑ−为超氧阴离子自由基;MRN为MRE11a-Rad50-Nbs1复合物;Cplx Ⅱ为线粒体呼吸复合物Ⅱ;CD44为一种膜整合蛋白;−为无此项内容 表 1 电离辐射诱导血管内皮细胞衰老的研究
Table 1. Research on the senescence of vascular endothelial cells induced by ionizing radiation
IR诱导的VEC发生的应激性衰老会表现出多种衰老表型(图1)。(1)在细胞形态上与复制性衰老表现一致,均表现为细胞扁平且宽大,细胞核和核仁体积增大[12]。(2)衰老的VEC会分泌许多炎症介质(细胞因子、趋化因子和生长因子等)和细胞外蛋白酶[白细胞介素(interleukin,IL)1、IL-6、IL-8、趋化因子2、TNF-α、转化生长因子β、纤溶酶原激活物抑制剂1、血管细胞黏附分子1和细胞间黏附分子1等][12-13, 14-16],称为衰老相关的分泌表型(senescence-associated secretory phenotype,SASP)。除此以外,常见的表现还有活性氧(reactive oxygen species,ROS)产生增加、衰老相关半乳糖苷酶及与肿瘤抑制作用相关的基因(如p16、p53和p21)表达水平增加;NO生成减少、Ki-67(细胞增殖核抗原)和血栓调节蛋白减少;细胞周期阻滞和血管生成功能受损等[12-13, 16]。
-
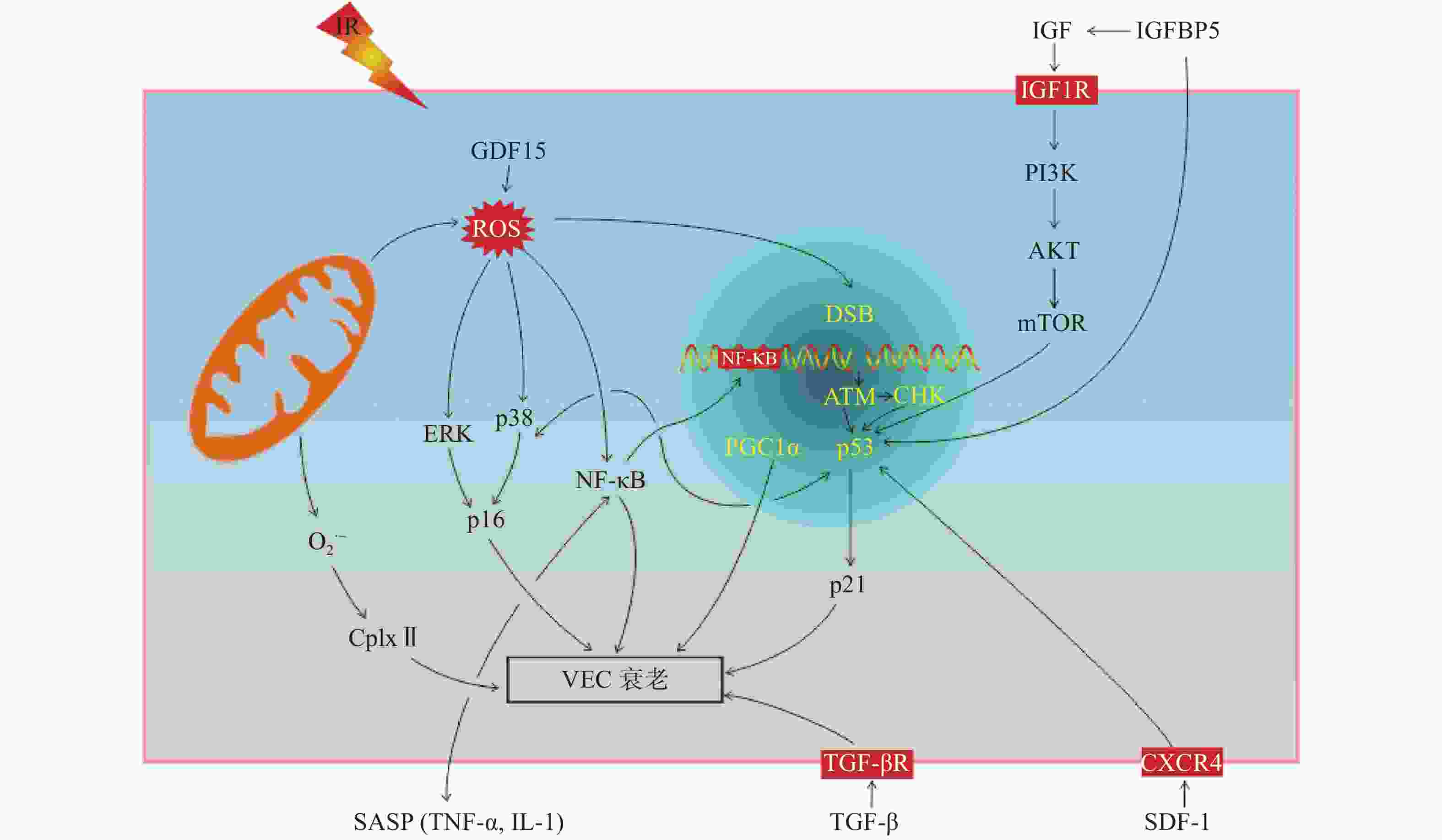
IR可诱导VEC衰老,有研究结果表明,p16/视网膜细胞瘤基因(retinoblastoma gene,Rb)信号通路和p53/p21信号通路在IR诱导的细胞衰老中起着关键作用[17]。我们从以下方面阐述IR诱导VEC衰老的分子机制(图2)。
-
p16和Rb是生物体内重要的抑癌基因,p16对细胞周期主要为负性调控作用,阻滞细胞增殖。p16/Rb信号通路不仅参与细胞增殖、分化和凋亡过程,而且在细胞衰老过程中发挥着重要的调控作用。研究结果表明,人主动脉内皮细胞在受到IR后生长分化因子15表达水平升高,研究者通过上调和下调生长分化因子15的表达水平发现,其主要通过激活ROS相关的细胞外信号调节激酶诱导p16的表达,从而导致人主动脉内皮细胞衰老[18]。研究结果表明,维生素D在IR诱导的人脐静脉内皮细胞中可以抑制丝裂原活化蛋白激酶/p38信号通路的激活,上调沉默调节蛋白1的表达水平,因此,其可以通过正向调节丝裂原活化蛋白激酶/沉默调节蛋白1信号通路,减少IR诱导的细胞衰老[19]。
-
p53是一种抑癌基因,它既能介导由端粒缩短导致的复制性细胞衰老,也能介导应激性细胞衰老。p21是位于p53下游的靶分子,是细胞周期依赖的蛋白激酶抑制剂,能抑制细胞周期,产生周期阻滞,p53通过p21调控细胞的衰老。胰岛素样生长因子1是雷帕霉素靶蛋白的上游调节因子,照射后其表达水平升高,并使得胰岛素样生长因子1受体过度磷酸化,参与胰岛素样生长因子结合蛋白5/磷脂酰肌醇-3-激酶/蛋白激酶B和雷帕霉素靶蛋白信号通路的激活,使得p53和p21表达水平升高,从而加速衰老[21-22]。IR诱导胰岛素样生长因子结合蛋白5表达水平升高,并以依赖p53的方式参与调控VEC衰老[23]。最近有研究者发现,CXC趋化因子受体4和基质细胞衍生因子1在脑部VEC损伤中起着重要的作用,并且随着照射时间和剂量的增加,二者的表达水平降低,p53和p21的表达水平升高,从而导致脑部VEC衰老;进一步通过CXC趋化因子受体4激活剂AT12341处理后发现,AT12341可以抑制IR诱导的VEC衰老,减轻IR诱导的脑损伤[24]。
-
NF-кB是细胞内重要的核转录因子,通常以p50-p65异二聚体的形式与其抑制性蛋白κB结合呈非活化状态。当受到刺激因子诱导时迅速转化为活化状态。在人脐静脉内皮细胞中发现,IR可通过DNA双链断链(DSB)/NF-кB必须调节蛋白(NEMO)信号通路使NF-кB活化,活化后的NF-кB会促进VEC形成衰老样表型,如血管生成功能受损和SASP因子分泌增加,从而导致VEC衰老[25];另外,通过IR诱导肾小球VEC衰老的研究结果表明,DNA损伤响应(DDR)/NF-кB信号通路不仅会促进SASP相关因子[IL-6、IL-8、IL-1、TNF-α、单核细胞趋化蛋白1、纤溶酶原激活物抑制剂1、血管内皮细胞生长因子、细胞间黏附分子1和血管细胞黏附分子1)分泌导致VEC衰老,而且分泌的SASP因子(如IL-1和TNF-α)还能激活NF-кB信号通路,加速VEC衰老[13]。
-
除以上所述的信号通路参与VEC衰老的调控外,还有研究结果表明,脑部VEC受到IR后,通过蛋白质免疫印迹(Western blot)实验分析发现,过氧化物酶体增殖物激活受体γ辅激活因子1α乙酰化水平升高,导致线粒体功能障碍而加速IR诱导的VEC衰老。因组蛋白去乙酰化酶1作为一种脱乙酰酶在细胞衰老过程中起着重要的作用,经IR后,组蛋白去乙酰化酶1和沉默调节蛋白1表达水平降低,增加了过氧化物酶体增殖物激活受体γ辅激活因子1α乙酰化,促进VEC衰老[5];IR还可以通过降低线粒体呼吸复合物Ⅱ(CplxⅡ)的活性,增加线粒体超氧阴离子自由基的产生来诱导VEC衰老[26];激活素受体样酶5激活也与IR诱导的VEC衰老有关[18]。研究结果表明,VEC 微小RNA-494和微小RNA-99b可能通过MRN基因修复复合体[包括MRE11(减数分裂重组11同源物a)、Rad50(DNA 修复蛋白)和Nbs1(DNA 修复蛋白)3种蛋白质]/血管内皮细胞生长因子受体2信号通路,靶向MRN(MRE11a-Rad50-Nbs1)复合物,抑制DNA修复,从而加剧DNA损伤,导致VEC衰老[27]。
-
细胞衰老是一把双刃剑,既能阻止受损细胞的增殖,又是慢性疾病的致病因素。当衰老细胞产生的速度超过免疫系统的清除能力时,就会促进各种与年龄相关的疾病发生。研究者发现,IR会对VEC造成损伤,使VEC功能障碍,从而使与年龄相关的血管疾病的发生风险增加[15]。而IR诱导的衰老VEC产生的多种衰老样表型,也可以导致VEC功能障碍,促进血管疾病的发生。阐明IR(尤其是低剂量IR)诱导的VEC衰老在血管疾病中的作用,有助于防治IR诱导的血管疾病,从而改善患者的生活质量。
-
VEC是心脏微血管和大血管系统的主要成分,IR诱导的VEC衰老在心血管疾病的发病机制中起着重要的作用,如IR诱导的衰老VEC的ROS产生增加,NO的产生减少,使血管舒张功能受损,导致高血压的发生;衰老的VEC分泌的SASP因子会促进动脉粥样硬化和血栓的发生[15, 28];衰老的VEC血管生成功能受损,使心脏毛细血管和小冠状动脉的密度降低,加速大血管动脉粥样硬化等[29]。因此,IR诱导的VEC衰老会促进心血管疾病的发生。
-
脑部微血管VEC对IR特别敏感,且在脑内稳态中发挥着重要作用。研究者发现,γ射线诱导的衰老微血管VEC分泌的SASP因子,如IL-6、IL-1和单核细胞趋化蛋白1可以改变脑部微血管VEC的微环境,促进神经炎症的发生并使神经元功能受损[30];IR可通过诱导脑部微血管VEC衰老使血管生成功能受损[30];IR诱导的衰老脑部微血管VEC中去整合素金属蛋白酶10的表达水平降低,这增加了阿尔兹海默病和大脑淀粉样血管病的发生风险[6]。脑部微血管VEC表面的蛋白质在血脑屏障中的信号传递和运输中起着关键的作用,通过进一步识别更多与衰老相关的蛋白质,对发现早期神经病变有着重要的意义。
-
有研究结果表明,IR诱导的VEC衰老在肾小球损伤和慢性肾功能衰竭中也起着重要的作用[13]。衰老的肾小球VEC的血管生成功能受损,毛细血管数量减少,肾小球滤过率降低,会促进慢性肾功能衰竭的发生;其次,衰老的肾小球VEC分泌的SASP因子在肾小球疾病中也起着重要的作用,其中IL-6被认为是主要的衰老相关分泌因子。这也是首次阐明IR诱导的衰老肾小球VEC在肾小球损伤的发生发展中起着重要的作用。因此,研究者应该进一步关注细胞衰老与慢性肾脏疾病之间的相关性,预防和改善IR引起的与细胞衰老相关的慢性肾脏疾病。
-
IR诱导的VEC衰老会诱发动脉粥样硬化或阿尔茨海默症等心脑血管疾病的发生,阐明其特点及相关作用机制对于有效预防可能接触IR的人员(放疗患者、放射事故幸存者和宇航员等)的健康和生存质量具有重要意义。IR诱导衰老的VEC分泌SASP因子,ROS水平升高,NO水平降低,血管生成功能受损等,这与细胞周期阻滞、p53/p21信号通路和p16/Rb信号通路激活等关系密切。但对于非编码RNA[微小RNA(miRNAs)、长链非编码RNA(lncRNAs)和内源竞争RNA(ceRNA)等]在VEC衰老过程中的调控作用的研究有限,可以通过单细胞测序分析和类器官培养系统等新技术或新方法开展研究。此外,将微血管(毛细血管和窦血管)、小动脉、小静脉或动脉作为VEC来源的研究对象对于阐明IR对VEC衰老的机制具有重要意义。因此,从细胞、动物、临床等不同层次开展对VEC衰老机制的探索和实验验证,丰富放射生物学的理论基础,为临床相关疾病的防治提供新的思路和策略具有重要的意义。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 赵红玲负责文献的收集、综述的撰写;宋曼负责文献的收集、图片的制作;关华负责命题的提出、综述的内容设计、综述的修订;周平坤负责综述的审阅与修订。
电离辐射诱导血管内皮细胞衰老的研究进展
Research progress on vascular endothelial cell senescence induced by ionizing radiation
-
摘要: 血管内皮细胞(VEC)是位于动脉、静脉和毛细血管内层的单层扁平细胞,对电离辐射(IR)非常敏感。IR不仅可以诱导VEC凋亡还可以诱导其衰老。衰老的VEC表现出多种表型,导致内皮功能障碍。笔者对IR诱导VEC衰老的特征及其相关作用机制和IR诱导衰老VEC在血管疾病中的作用进行综述。Abstract: Vascular endothelial cells (VEC), a single layer of flat cells lines the arteries, veins and capillaries, are sensitive to ionizing radiation (IR). IR is able to induce apoptosis and senescence in VEC. Senescent VEC shows a variety of senescent phenotypes, which further result in endothelial dysfunction. This paper reviews the characteristic of IR-induced VEC senescence, as well as its related functional mechanisms by which IR-induced senescent VEC plays a role in vascular diseases.
-
Key words:
- Radiation, ionizing /
- Endothelial cells /
- Cellular senescence /
- Vascular diseases
-
表 1 电离辐射诱导血管内皮细胞衰老的研究
Table 1. Research on the senescence of vascular endothelial cells induced by ionizing radiation
序号 实验材料 射线类型 总剂量(剂量率) 主要发现 研究者 1 HBMVEC γ射线 4 Gy
(3.81 Gy/min)PGC1α乙酰化是IR诱导VEC衰老的重要
因素Kim等[5] 7周龄雄性C57BL/6
小鼠X射线 8 Gy 2 bEnd.3 X射线 20 Gy IR诱导脑微VEC衰老 McRobb等[6] 3 HUVEC γ射线 0.69、2.07、4.13 Gy
(4.1 mGy/h)慢性低剂量率γ射线可诱导HUVEC衰老 Yentrapalli等[12] 4 大鼠肾小球内皮细胞 X射线 20 Gy
(4.96 Gy/min)IR诱导肾小球VEC衰老,IL-6为主要SASP Aratani等[13] 7~8周龄雄性Dark
Agti大鼠X射线 18 Gy
(1.34 Gy/min)5 HUVEC γ射线 4 Gy
(2.82 Gy/min)IGFBP5参与IR诱导的衰老 Kim等[14] 6 TICAE X射线 0.05、0.1、0.5、2 Gy
(0.5 Gy/min)IR诱导VEC衰老,且IL-6和CCL2的表达水平
增加Baselet等[15] 7 HCAEC X射线 0.5 Gy
(0.5 Gy/min)IR诱导HCAEC衰老,且p16和p21的表达水平
显著增加Azimzadeh等[16] 8 HUVEC X射线 8、15 Gy IR通过TGF-BRI/ALK5抑制血管生成 Imaizumi等[17] 9 HAEC − 4 Gy GDF15通过ROS介导的p16途径参与IR诱导的HAEC衰老 Park等[18] 10 HUVEC X射线 0~8 Gy
(1.3 Gy/min)维生素D通过调节MAPK/SIRT1信号通路抑制HUVEC衰老 Marampon等[19] 11 HUVEC γ射线 0.2 Gy Ku86抑制低剂量IR诱导的HUVEC衰老和凋亡 Wu等[20] 12 HUVEC γ射线 4.032 Gy
(2.4 mGy/h)PI3K/AKT/mTOR通路与IR诱导的细胞衰老
相关Yentrapalli等[21] 13 HPAEC X射线 10 Gy
(2.4 Gy/min)IGF-1R是IR诱导细胞衰老的关键调节因子 Panganiban等[22] 14 HUVEC γ射线 2.066、4.133 Gy
(4.1 mGy/h)4.1 mGy/h照射的HUVEC衰老,且IGFBP5
参与IR诱导的衰老Rombouts等[23] 15 HBMVEC γ射线 4 Gy
(3.5 Gy/min)CXCR4和SDF-1在体内外均可抑制辐射诱导
的内皮细胞衰老Heo等[24] 7周龄雌性C57BL/6
和BALB/c裸鼠X射线 8 Gy
(2 Gy/min)16 HUVEC γ射线 2、4、8 Gy
(2 Gy/min)IR通过DSB/NEMO/NF-кB信号通路诱导VEC
衰老Dong等[25] 17 HMVEC-L X射线 15 Gy p53和O2·−/Cplx Ⅱ参与IR诱导的VEC衰老 Lafargue等[26] 18 HUVEC和HMVEC γ射线 10 Gy 微小RNA-494和微小RNA-99b通过MRN复
合物抑制DNA修复,导致细胞衰老Espinosa-Diez等[27] 19 TICAE X射线 10 Gy CD44启动子在IR诱导的衰老内皮细胞中起着重要的作用 Lowe等[28] 注:HBMVEC为人脑部微血管内皮细胞;bEnd.3为小鼠脑微血管内皮细胞系;HUVEC为人脐静脉内皮细胞;TICAE为端粒酶永生化的人冠状动脉内皮细胞;HCAEC为人冠状动脉内皮细胞;HAEC为人主动脉内皮细胞;HPAEC为人肺动脉内皮细胞;HBMVEC为人脑部微血管内皮细胞;HMVEC-L为人肺微血管内皮细胞;PGC1α为过氧化物酶体增殖物激活受体γ辅激活因子1α;VEC为血管内皮细胞;IL-6为白细胞介素6;SASP为衰老相关的分泌表型;IGFBP5为胰岛素样生长因子结合蛋白5;CCL2为趋化因子2;TGF-BRI为转化生长因子Ⅰ型受体;ALK5为激活素受体样酶5;GDF15为生长分化因子15;ROS为活性氧;MAPK为丝裂原活化蛋白激酶;SIRT1为沉默信息调节因子2相关酶1;Ku86为参与非同源末端连接过程的一个关键分子;PI3K为磷脂酰肌醇-3-激酶;AKT为蛋白激酶 B;mTOR为雷帕霉素靶蛋白;IGF1R为胰岛素样生长因子1受体;CXCR4为CXC趋化因子受体4;SDF-1为基质细胞衍生因子1;DSB为DNA双链断裂;NEMO为NF-κB必须调节蛋白;NF-кB为核因子кB;O2ˑ−为超氧阴离子自由基;MRN为MRE11a-Rad50-Nbs1复合物;Cplx Ⅱ为线粒体呼吸复合物Ⅱ;CD44为一种膜整合蛋白;−为无此项内容 -
[1] Soloviev AI, Kizub IV. Mechanisms of vascular dysfunction evoked by ionizing radiation and possible targets for its pharmacological correction[J]. Biochem Pharmacol, 2019, 159: 121−139. DOI: 10.1016/j.bcp.2018.11.019. [2] Adams MJ, Lipsitz SR, Colan SD, et al. Cardiovascular status in long-term survivors of Hodgkin's disease treated with chest radiotherapy[J]. J Clin Oncol, 2004, 22(15): 3139−3148. DOI: 10.1200/JCO.2004.09.109. [3] Darby SC, McGale P, Taylor CW, et al. Long-term mortality from heart disease and lung cancer after radiotherapy for early breast cancer: prospective cohort study of about 300 000 women in US SEER cancer registries[J]. Lancet Oncol, 2005, 6(8): 557−565. DOI: 10.1016/S1470-2045(05)70251-5. [4] Wethal T, Nedregaard B, Andersen R, et al. Atherosclerotic lesions in lymphoma survivors treated with radiotherapy[J]. Radiother Oncol, 2014, 110(3): 448−454. DOI: 10.1016/j.radonc.2013.10.029. [5] Kim SB, Heo JI, Kim H, et al. Acetylation of PGC1α by histone deacetylase 1 downregulation is implicated in radiation-induced senescence of brain endothelial cells[J]. J Gerontol A Biol Sci Med Sci, 2019, 74(6): 787−793. DOI: 10.1093/gerona/gly167. [6] McRobb LS, McKay MJ, Gamble JR, et al. Ionizing radiation reduces ADAM10 expression in brain microvascular endothelial cells undergoing stress-induced senescence[J/OL]. Aging, 2017, 9(4): 1248−1268[2020-06-29]. https://www.aging-us.com/article/101225/text. DOI: 10.18632/aging.101225. [7] Krüger-Genge A, Blocki A, Franke RP, et al. Vascular endothelial cell biology: an update[J/OL]. Int J Mol Sci, 2019, 20(18): 4411[2020-06-29]. https://www.mdpi.com/1422-0067/20/18/4411. DOI: 10.3390/ijms20184411. [8] Bautista-Niño PK, Portilla-Fernandez E, Vaughan DE, et al. DNA damage: a main determinant of vascular aging[J/OL]. Int J Mol Sci, 2016, 17(5): 748[2020-06-29]. https://www.mdpi.com/1422-0067/17/5/748. DOI: 10.3390/ijms17050748. [9] Minamino T, Miyauchi H, Yoshida T, et al. Endothelial cell senescence in human atherosclerosis: role of telomeres in endothelial dysfunction[J]. J Cardiol, 2003, 41(1): 39−40. [10] Kurz DJ, Decary S, Hong Y, et al. Chronic oxidative stress compromises telomere integrity and accelerates the onset of senescence in human endothelial cells[J]. J Cell Sci, 2004, 117(11): 2417−2426. DOI: 10.1242/jcs.01097. [11] Gorgoulis V, Adams PD, Alimonti A, et al. Cellular senescence: defining a path forward[J]. Cell, 2019, 179(4): 813−827. DOI: 10.1016/j.cell.2019.10.005. [12] Yentrapalli R, Azimzadeh O, Barjaktarovic Z, et al. Quantitative proteomic analysis reveals induction of premature senescence in human umbilical vein endothelial cells exposed to chronic low-dose rate gamma radiation[J]. Proteomics, 2013, 13(7): 1096−1107. DOI: 10.1002/pmic.201200463. [13] Aratani S, Tagawa M, Nagasaka S, et al. Radiation-induced premature cellular senescence involved in glomerular diseases in rats[J/OL]. Sci Rep, 2018, 8(1): 16812[2020-06-29]. https://www.nature.com/articles/s41598-018-34893-8. DOI: 10.1038/s41598-018-34893-8. [14] Kim KS, Kim JE, Choi KJ, et al. Characterization of DNA damage-induced cellular senescence by ionizing radiation in endothelial cells[J]. Int J Radiat Biol, 2014, 90(1): 71−80. DOI: 10.3109/09553002.2014.859763. [15] Baselet B, Belmans N, Coninx E, et al. Functional gene analysis reveals cell cycle changes and inflammation in endothelial cells irradiated with a single X-ray dose[J/OL]. Front Pharmacol, 2017, 8: 213[2020-06-29]. https://www.frontiersin.org/articles/10.3389/fphar.2017.00213/full. DOI: 10.3389/fphar.2017.00213. [16] Azimzadeh O, Subramanian V, Ständer S, et al. Proteome analysis of irradiated endothelial cells reveals persistent alteration in protein degradation and the RhoGDI and NO signalling pathways[J]. Int J Radiat Biol, 2017, 93(9): 920−928. DOI: 10.1080/09553002.2017.1339332. [17] Imaizumi N, Monnier Y, Hegi M, et al. Radiotherapy suppresses angiogenesis in mice through TGF-βRI/ALK5-dependent inhibition of endothelial cell sprouting[J/OL]. PLoS One, 2010, 5(6): e11084[2020-06-29]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0011084. DOI: 10.1371/journal.pone.0011084. [18] Park H, Kim CH, Jeong JH, et al. GDF15 contributes to radiation-induced senescence through the ROS-mediated p16 pathway in human endothelial cells[J/OL]. Oncotarget, 2016, 7(9): 9634−9644[2020-06-29]. https://www.oncotarget.com/article/7457/text. DOI: 10.18632/oncotarget.7457. [19] Marampon F, Gravina GL, Festuccia C, et al. Vitamin D protects endothelial cells from irradiation-induced senescence and apoptosis by modulating MAPK/SirT1 axis[J]. J Endocrinol Invest, 2016, 39(4): 411−422. DOI: 10.1007/s40618-015-0381-9. [20] Wu K, Chen ZJ, Peng Q, et al. Ku86 alleviates human umbilical vein endothelial cellular apoptosis and senescence induced by a low dose of ionizing radiation[J]. J Int Med Res, 2019, 47(2): 893−904. DOI: 10.1177/0300060518805302. [21] Yentrapalli R, Azimzadeh O, Sriharshan A, et al. The PI3K/Akt/mTOR pathway is implicated in the premature senescence of primary human endothelial cells exposed to chronic radiation[J/OL]. PLoS One, 2013, 8(8): e70024[2020-06-29]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0070024. DOI: 10.1371/journal.pone.0070024. [22] Panganiban RAM, Day RM. Inhibition of IGF-1R prevents ionizing radiation-induced primary endothelial cell senescence[J/OL]. PLoS One, 2013, 8(10): e78589[2020-06-29]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0078589. DOI: 10.1371/journal.pone.0078589. [23] Rombouts C, Aerts A, Quintens R, et al. Transcriptomic profiling suggests a role for IGFBP5 in premature senescence of endothelial cells after chronic low dose rate irradiation[J]. Int J Radiat Biol, 2014, 90(7): 560−574. DOI: 10.3109/09553002.2014.905724. [24] Heo JI, Kim KI, Woo SK, et al. Stromal cell-derived factor 1 protects brain vascular endothelial cells from radiation-induced brain damage[J/OL]. Cells, 2019, 8(10): 1230[2020-06-29]. https://www.mdpi.com/2073-4409/8/10/1230. DOI: 10.3390/cells8101230. [25] Dong XR, Tong F, Qian C, et al. NEMO modulates radiation-induced endothelial senescence of human umbilical veins through NF-κB signal pathway[J]. Radiat Res, 2015, 183(1): 82−93. DOI: 10.1667/RR13682.1. [26] Lafargue A, Degorre C, Corre I, et al. Ionizing radiation induces long-term senescence in endothelial cells through mitochondrial respiratory complex Ⅱ dysfunction and superoxide generation[J]. Free Radic Biol Med, 2017, 108: 750−759. DOI: 10.1016/j.freeradbiomed.2017.04.019. [27] Espinosa-Diez C, Wilson R, Chatterjee N, et al. MicroRNA regulation of the MRN complex impacts DNA damage, cellular senescence, and angiogenic signaling[J/OL]. Cell Death Dis, 2018, 9(6): 632[2020-06-29]. https://www.nature.com/articles/s41419-018-0690-y. DOI: 10.1038/s41419-018-0690-y. [28] Lowe D, Raj K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression[J]. Aging Cell, 2014, 13(5): 900−910. DOI: 10.1111/acel.12253. [29] Taunk NK, Haffty BG, Kostis JB, et al. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms[J/OL]. Front Oncol, 2015, 5: 39[2020-06-29]. https://www.frontiersin.org/articles/10.3389/fonc.2015.00039/full. DOI: 10.3389/fonc.2015.00039. [30] Ungvari Z, Podlutsky A, Sosnowska D, et al. Ionizing radiation promotes the acquisition of a senescence-associated secretory phenotype and impairs angiogenic capacity in cerebromicrovascular endothelial cells: role of increased DNA damage and decreased DNA repair capacity in microvascular raDIOsensitivity[J]. J Gerontol A Biol Sci Med Sci, 2013, 68(12): 1443−1457. DOI: 10.1093/gerona/glt057. -






 下载:
下载: