-
肺神经内分泌肿瘤(pulmonary neuroendocrine tumors,PNETs)约占原发性肺癌的25%,其在神经内分泌肿瘤中的发病率仅次于胃肠道内分泌肿瘤[1]。PNETs起源于支气管黏膜的神经内分泌细胞,能够产生并分泌胺类和多肽激素[2]。2015年,WHO在肺肿瘤的新分类中,将PNETs分为4种亚型:典型类癌(typical carcinoid,TC)、不典型类癌(atypical carcinoid,AC)、大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)和小细胞肺癌(small cell lung carcinoma,SCLC)[3]。PNETs亚型的治疗方法和预后各有不同,因此早期准确诊断尤为重要。相较于其他影像学检查方法,18F-FDG PET/CT检测肿瘤及转移灶具有显著的优势,可以根据SUVmax对肿瘤的良恶性作出初步诊断,增强CT与高分辨率CT(high resolution CT,HRCT)对肿瘤的内部细节、血液供应及周围组织侵犯等情况显示良好。以往的研究一般以单纯CT或PET/CT为主[4-5],将PET/CT和CT(包括增强CT和HRCT)同时纳入的研究较少,故本研究回顾性分析44例经组织病理学检查证实的PNETs患者的临床资料和CT、PET/CT影像学资料,探讨PNETs的CT与PET/CT影像学特征,比较单纯PET/CT与基于PET/CT联合增强CT及HRCT的多模态显像的诊断准确率,旨在进一步提高临床医师对PNETs的认知和诊断水平。
-
回顾性分析2010年1月至2019年5月于西南医科大学附属医院就诊并经组织病理学检查确诊为PNETs的44例患者的临床资料和CT、PET/CT影像学资料。纳入标准:(1)经组织病理学检查确诊为PNETs;(2)初始诊断时未进行任何治疗,包括放化疗和手术;(3)CT和PET/CT影像学资料完整、图像清晰。排除标准:(1)有肺部手术史;(2)有其他恶性肿瘤病史。44例PNETs患者中,男性34例、女性10例,年龄14~78(57.3±10.0)岁,其中吸烟者30例,均为男性。患者就诊时临床表现主要为咳嗽、咯血、呼吸困难、胸闷和胸痛等,其中5例无症状,因体检或行其他系统疾病检查时偶然发现。根据组织病理学分型将PNETs患者分组如下:TC组(5例)、AC组(3例)、LCNEC组(15例)、SCLC组(21例),由于TC、AC组病例数较少,因此将2组归为类癌组进行分析。
所有患者在检查前均签署了知情同意书。本研究已获得西南医科大学附属医院伦理学委员会的批准(批准号:KY2021004)。
-
增强CT使用荷兰Philips公司的Brilliance 256层iCT,HRCT使用美国GE公司的64排128层螺旋CT,PET/CT使用荷兰Philips公司的GEMINI TF/16 PET/CT显像仪。18F-FDG由德国Siemens公司 cclipsc HP/RD型回旋加速器及自动合成模块合成(北京派特公司FDG-N型),放射化学纯度>95%。PET/CT扫描参数:管电压120 kV、管电流150 mA、矩阵512×512,患者检查前空腹6~8 h,血糖控制在7.0 mmol/L以下,静脉注射18F-FDG,剂量为3.7~5.5 MBq/kg,注射后患者取仰卧位,扫描范围从肺尖至肺底。增强CT和HRCT的扫描参数:管电压120 kV、管电流150 mA、层厚1.0 mm、间隔1.0 mm,增强CT扫描的对比剂采用碘伏醇,使用高压注射器经肘静脉注射,对比剂浓度300 mg/mL,剂量1.5 mL/kg,注射速度3~4 mL/s,患者分别于注入对比剂30、60 s后行动脉期、静脉期CT扫描,扫描时嘱其屏气。扫描结束后将1.0 mm层厚图像传至工作站进行多平面重建,对病变及邻近结构的CT征象进行分析。44例患者均行PET/CT及HRCT检查;除3例患者(类癌1例、LCNEC 1例、SCLC 1例)外,余41例患者均行增强CT扫描。
-
所有患者的图像均由2名具有5年以上工作经验的影像诊断医师共同阅片,意见有分歧时,由二人协商决定。测量、统计并分析CT与PET/CT表现,包括SUVmax、肿瘤部位、肿瘤最大径、密度、强化程度以及有无毛刺征、分叶征、支气管和(或)周围血管受侵、阻塞性肺炎和(或)肺不张、胸膜增厚、肺门和(或)纵隔淋巴结转移、远处转移等。以组织病理学检查结果为“金标准”,比较单纯PET/CT与基于PET/CT联合增强CT及HRCT的多模态显像诊断的准确率。
-
应用SPSS 25.0软件对数据进行统计学分析。符合正态分布的计量资料以
$ \overline x $ ±s表示,多组间比较采用单因素方差分析,两组间比较采用最小显著差异(LSD)法。计数资料用频数表示,组间比较采用χ2检验和Fisher确切概率法。采用ROC曲线分析SUVmax的诊断效能,计算AUC,确定诊断临界值。P<0.05为差异有统计学意义。 -
由表1可知,类癌组患者的发病年龄低于LCNEC组与SCLC组患者,且差异有统计学意义(P=0.004);在性别、吸烟史等方面与LCNEC组和SCLC组患者的差异均无统计学意义(均P>0.05)。
组别 年龄( $ \bar {x} $ 

男性/女性(例) 吸烟史[例(%)] 类癌组(n=8) 46.62±8.09 5/3 3(37.5) LCNEC组(n=15) 61.47±8.03 12/3 12(80.0) SCLC组(n=21) 58.52±9.39 17/4 15(71.4) 检验值 F=6.186 χ2=1.220 χ2=4.539 P值 P=0.004 P=0.570 P=0.137 注:类癌组包括典型类癌患者5例、不典型类癌患者3例;LCNEC为大细胞神经内分泌癌;SCLC为小细胞肺癌 表 1 44例肺神经内分泌肿瘤患者临床资料的比较
Table 1. Comparison of clinical data of 44 patients with pulmonary neuroendocrine tumor
-
LCNEC组患者中有12例为周围型,而类癌组患者和SCLC组患者以中央型多见,分别为6例和14例,组间差异有统计学意义(χ2=9.662,P=0.010)。
-
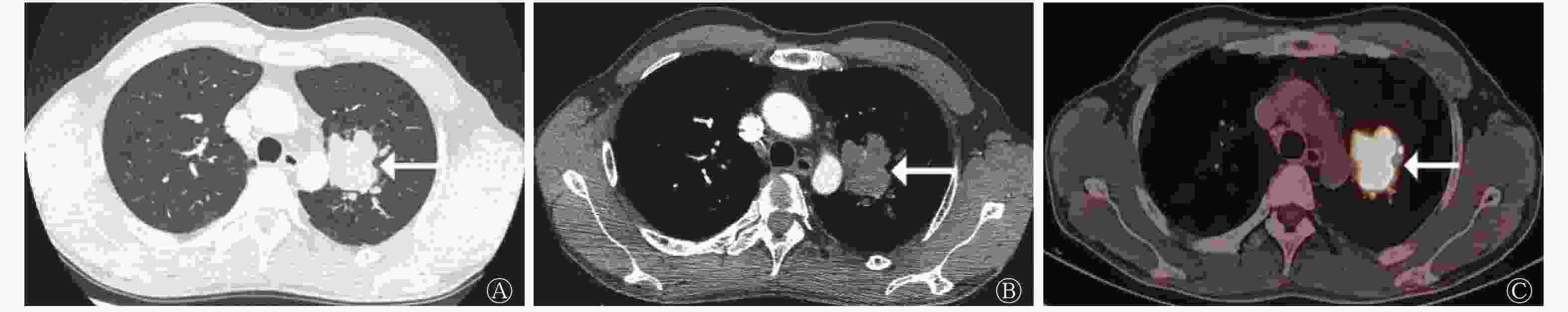
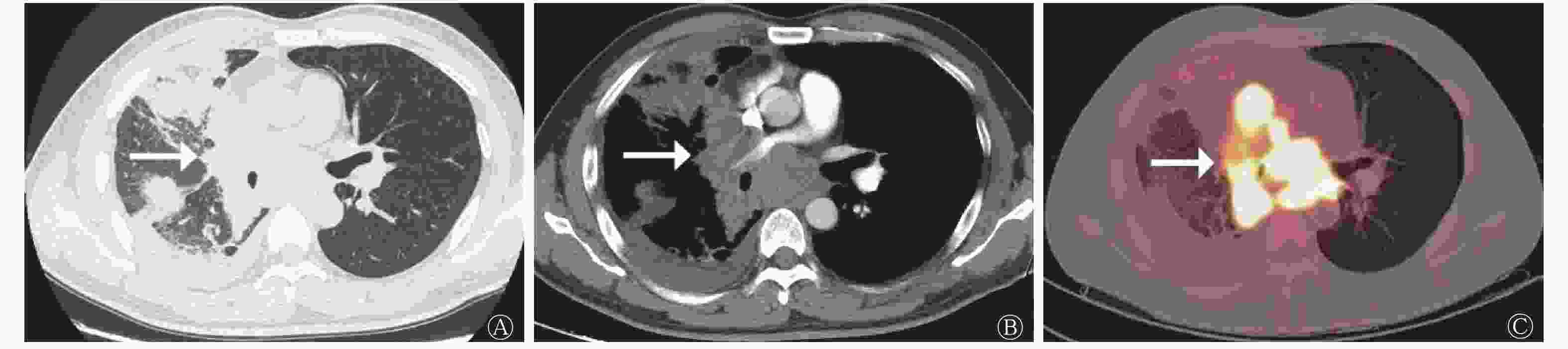
类癌组患者的病灶形态规则,多数(5/8)呈圆形和类圆形(图1);LCNEC组和SCLC组患者的病灶形态多不规则。LCNEC组中11例患者的病灶可见分叶征(图2),与类癌组和SCLC组比较,差异有统计学意义(χ2=9.457,P=0.011)(表2)。
-
由表2可知,类癌组患者的病灶密度较均匀,3例患者的病灶伴有坏死、囊变,1例患者的病灶内出现少许点状钙化灶。LCNEC组与SCLC组患者的病灶密度多不均匀,6例患者的病灶内出现斑点状钙化灶(LCNEC组2例、SCLC组4例),LCNEC组和SCLC组有26例患者的病灶内出现坏死、囊变区。3组间患者病灶内的钙化和坏死率的差异均无统计学意义(均P>0.05)。41例行增强CT扫描的患者中,4例类癌患者明显强化、3例类癌患者中度强化,11例LCNEC患者轻-中度强化、3例LCNEC患者明显强化,13例SCLC患者明显强化、7例SCLC患者轻-中度强化,3组间强化程度的差异无统计学意义(P=0.065)(表2)。
-
类癌组和SCLC组中合并阻塞性肺炎和(或)肺不张的患者分别为7例和11例,而LCNEC组中仅3例,3组间的差异有统计学意义(χ2=9.877,P=0.006)(表2)。
-
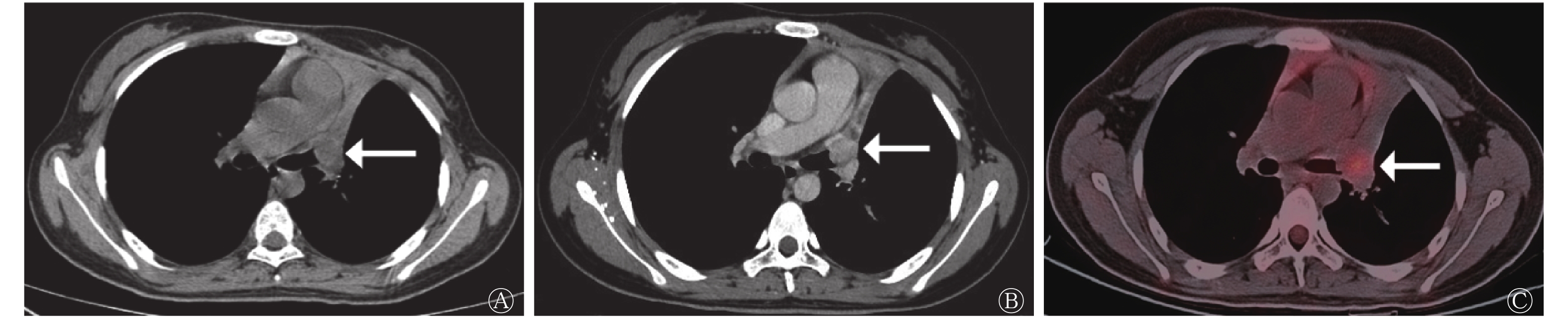
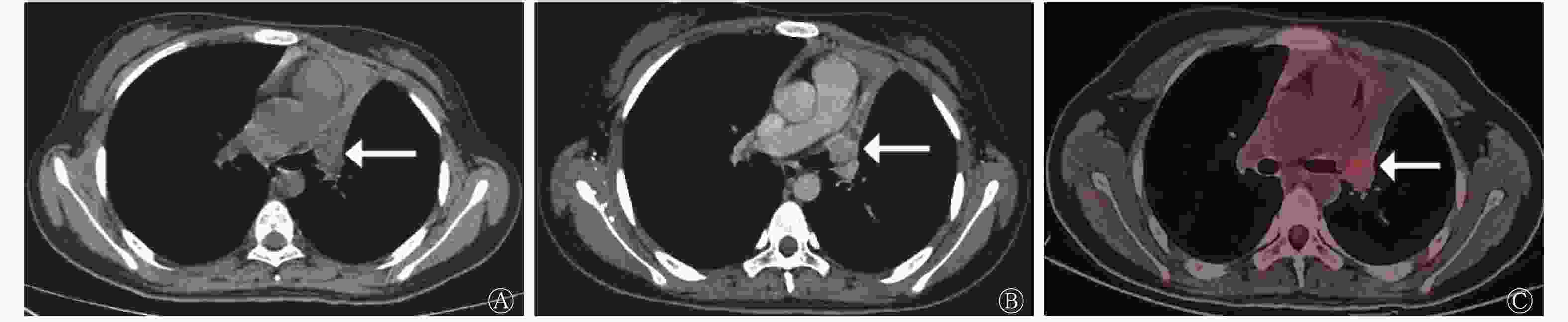
行增强CT扫描的41例患者中,CT图像显示周围血管侵犯19例,其中SCLC组13例(图3)、LCNEC组6例,类癌组患者无周围血管侵犯,3组间差异有统计学意义(χ2=8.913,P=0.009)(表2)。
-
由表2可知,出现肺门淋巴结转移、纵隔淋巴结转移、肺门及纵隔淋巴结同时转移的患者分别为24例、25例和19例,且类癌组、LCNEC组和SCLC组3组间的差异均有统计学意义(均 P<0.05)。对类癌组、LCNEC组和SCLC组患者分别在肺门淋巴结转移、纵隔淋巴结转移、肺门及纵隔淋巴结同时转移方面进行两两比较,结果显示,仅SCLC组与类癌组的差异有统计学意义(χ2=6.807、6.448、5.663,均P<0.05),而LCNEC组与SCLC、类癌组的差异均无统计学意义(χ2=0.167~3.306,均P>0.05)。远处转移患者共16例,3组间的差异有统计学意义(P=0.025)(表2)。对远处转移情况进行两两比较,结果显示,SCLC组与类癌组、LCNEC组的差异均有统计学意义(χ2=4.668、4.967,均P<0.05)(表2)。
-
由表2可知,3组患者在肿瘤最大径、密度、强化程度、有无毛刺征、支气管侵犯、胸膜增厚和胸腔积液等方面的差异均无统计学意义(均P>0.05)。
组别 形态 密度 钙化 分叶征 类圆形 不规则 均匀 不均匀 有 无 有 无 类癌组(n=8) 5 3 4 4 1 7 5 3 LCNEC组(n=15) 4 11 4 11 2 13 11 4 SCLC组(n=21) 5 16 6 15 4 17 5 16 检验值 χ2=3.726 χ2=1.504 χ2=0.298 χ2=9.457 P值 0.189 0.574 1.000 0.011 组别 毛刺征 阻塞性肺炎或肺不张 强化程度 坏死、囊变 有 无 有 无 轻 中 明显 有 无 类癌组(n=8) 2 6 7 1 0 3 4 3 5 LCNEC组(n=15) 7 8 3 12 5 6 3 11 4 SCLC组(n=21) 5 16 11 10 3 4 13 15 6 检验值 χ2=2.316 χ2=9.877 χ2=8.472 χ2=3.526 P值 0.300 0.006 0.065 0.211 组别 肺门淋巴结转移 纵隔淋巴结转移 肺门及纵隔淋巴结同时转移 有 无 有 无 有 无 类癌组(n=8) 1 7 2 6 1 7 LCNEC组(n=15) 9 6 7 8 5 10 SCLC组(n=21) 14 7 16 5 13 8 检验值 χ2=7.128 χ2=7.143 χ2=6.662 P值 0.036 0.028 0.041 组别 胸腔积液 胸膜增厚 支气管侵犯 周围血管侵犯 有 无 有 无 有 无 有 无 类癌组(n=8) 1 7 4 4 5 3 0 7 LCNEC组(n=15) 3 12 7 8 8 7 6 8 SCLC组(n=21) 7 14 12 9 13 8 13 7 检验值 χ2=1.644 χ2=0.405 χ2=0.312 χ2=8.913 P值 0.474 0.921 0.920 0.009 组别 远处转移 肿瘤部位 肿瘤最大径( $ \bar {x}\pm s$ 

SUVmax( $ \bar {x}\pm s $ 

有 无 中央型 周围型 类癌组(n=8) 1 7 6 2 4.40±2.84 4.52±1.77 LCNEC组(n=15) 3 12 3 12 4.13±2.27 13.79±3.06 SCLC组(n=21) 12 9 14 7 4.90±2.55 9.51±2.49 检验值 χ2=7.622 χ2=9.662 F=0.370 F=32.43 P值 0.025 0.010 0.693 P<0.01 注:类癌组包括典型类癌患者5例和不典型类癌患者3例。CT为计算机体层摄影术;FDG为氟脱氧葡萄糖;PET正电子发射断层显像术;LCNEC为大细胞神经内分泌癌;SCLC为小细胞肺癌;SUVmax为最大标准化摄取值 表 2 44例肺神经内分泌肿瘤患者CT与18F-FDG PET/CT的显像特征(例)
Table 2. Imaging features of CT and 18F-FDG PET/CT in 44 patients with pulmonary neuroendocrine tumor (case)
-
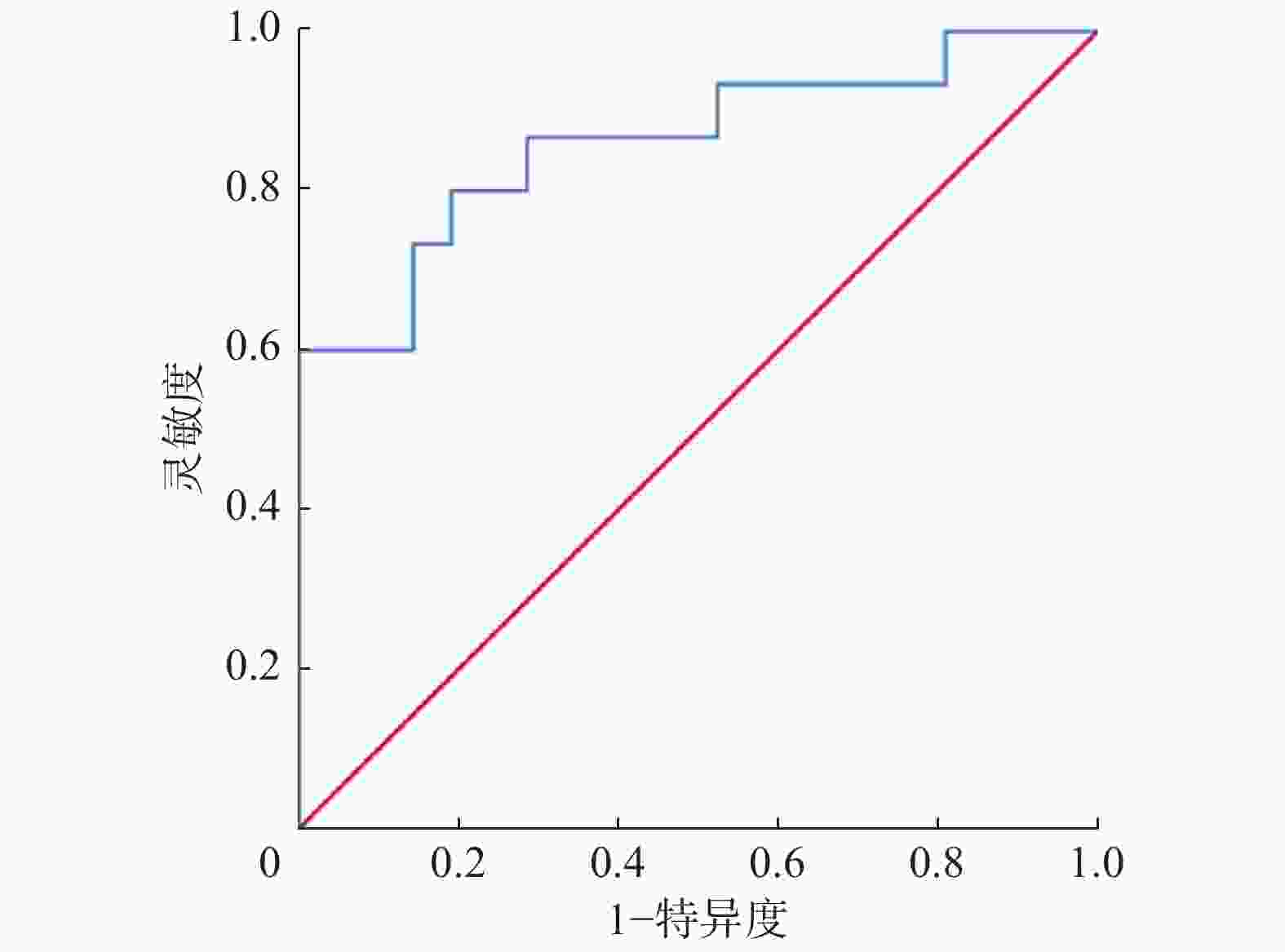
PET/CT图像分析结果显示,LCNEC组的SUVmax(13.79±3.06)和SCLC组的SUVmax(9.51±2.49)明显高于类癌组的SUVmax(4.52±1.77),且差异有统计学意义(F=32.43,P<0.01)。采用ROC曲线分析SUVmax鉴别LCNEC与SCLC的临界值为12.25,AUC为0.860(95%CI:0.729~0.991,P<0.01),灵敏度为80.00%,特异度为81.00%(图4)。
-
单纯PET/CT与基于PET/CT联合增强CT及HRCT的多模态显像诊断PNETs的准确率分别为65.91%(29/44)和87.80%(36/41),且差异有统计学意义(χ2=5.655,P=0.017)。
-
肺类癌占所有类癌的25%以上,占原发性肺癌的2%~3%,其中TC约占80%[6]。类癌属于较低级别的PNETs,恶性程度低,发病年龄较年轻,与吸烟无明确相关性,尤其是TC。Fink等[7]对纳入的142例类癌患者进行研究发现,患者的发病年龄为(52±16)岁。本研究中的类癌患者与LCNEC、SCLC患者相比,发病年龄小,与文献报道[7]相符。类癌患者的临床表现为咳嗽、咳痰、咯血等,很少伴有类癌综合征,也可无任何阳性症状[6-7]。超半数类癌患者通过纤维支气管镜检查确诊,临床治疗以手术切除为主,5年生存率>87%[2, 7]。类癌多生长于支气管腔且多呈形态规则、边缘光滑的圆形或类圆形,密度均匀;也可同时向腔内、腔外生长,表现为“冰山征”,此征象多见于AC[8-9]。类癌好发于较大的支气管,常伴有阻塞性肺炎或肺不张,转移征象少见,但AC具有潜在的侵袭性。曾亮等[8]研究结果发现,在13例类癌患者中有6例伴有阻塞征象,7例TC患者均无转移征象,6例AC患者中有2例出现肺门及纵隔淋巴结转移,1例合并远处转移。本研究中的8例类癌患者合并阻塞性肺炎或肺不张的有7例,有1例AC发生转移,与上述文献报道相符。类癌由支气管动脉供血,血供丰富,增强CT扫描多呈明显强化[8-10]。
LCNEC占原发性肺癌的3%,好发于中老年男性,且多有长期吸烟史[6]。Baine和Rekhtman[11]的研究结果表明,60%以上的LCNEC患者均为长期大量吸烟的老年男性,中位年龄65岁。本研究共纳入LCNEC患者15例,年龄(61.47±8.03)岁,其中男性患者12例,均有长期吸烟史,与上述文献报道[11]一致。LCNEC患者以咳嗽、咳痰、胸闷、气促等临床症状常见,内分泌紊乱症状少见[12]。本研究结果显示,LCNEC多表现为周围型、形态不规则的软组织肿块,分叶征常见(11/15),LCNEC的毛刺征(7/15)较其他类型的周围型肺癌少见,这可能与LCNEC引起周围结缔组织反应性增生较少有关;增强CT扫描多呈轻-中度强化。LCNEC分化程度低、恶性程度高,预后常比其他类型的非小细胞肺癌差,即使在早期,患者5年总生存率也仅为21%[13]。本研究中的15例LCNEC患者转移征象并不少见,其中纵隔淋巴结转移占46.7%(7/15)、肺门淋巴结转移占60.0%(9/15)、远处转移占20.0%(3/15),提示其预后较差,与文献报道[14]相符。
SCLC是PNETs中最常见的亚型,约占原发性肺癌的20%,也与吸烟密切相关[2, 6]。SCLC分化程度低,恶性程度极高,其侵袭性强、预后很差,患者多在临床确诊时已失去根治性手术的机会,5年生存率<5%,且对放化疗敏感[2, 15]。SCLC常见的临床症状包括咳嗽、咳痰、痰中带血、呼吸困难、异位激素产生和副肿瘤综合征等。SCLC以中央型多见,CT多表现为形态不规则的肺门区肿块,病灶压迫或侵犯邻近气管、支气管,导致阻塞性肺炎和(或)肺不张。SCLC侵袭能力强,易压迫、包绕和侵犯周围血管,肺动静脉、上下腔静脉甚至左心房均可受累,侵犯或压迫上腔静脉时可出现上腔静脉综合征[16]。贺锋等[17]的研究纳入了40例SCLC患者,其中20例肺动脉侵犯、7例上腔静脉侵犯、1例主动脉侵犯。本研究21例SCLC患者中13例出现周围血管侵犯,与以上文献报道相符。本研究中,周围型SCLC多表现为边缘光滑(4/7,57.1%)、浅分叶状(5/7,71.4%)的肿块或结节,边缘有毛刺征(3/7,42.9%)、胸膜凹陷(2/7,28.6%)、血管集束征(2/7,28.6%)较少见。以上研究结果的原因可能为周围型SCLC边缘光滑,可能是由于肿瘤的快速生长推挤邻近肺组织,使得肿块边缘清晰锐利。SCLC早期即可出现肺门、纵隔淋巴结转移及远处转移,中央型SCLC可与肿大淋巴结相互融合,导致“冰冻纵隔”征象[17]。本研究21例SCLC患者中14例(66.7%)出现肺门淋巴结转移,16例(76.2%)出现纵隔淋巴结转移,12例(57.1%)出现远处转移。Saber等[2]认为SCLC的脑转移倾向是其特征之一,有50%~80%的患者发生脑转移。在本研究中SCLC脑转移患者仅4例(4/21),这可能与样本量较少有关。
本研究中的LCNEC和SCLC患者肿瘤病灶对18F-FDG呈现明显的高摄取,显著高于类癌患者,这提示肿瘤细胞恶性程度高、分化程度低、增殖指数高、代谢水平高。Kaira等[18]发现,PNETs细胞过度表达葡萄糖转运体1与肿瘤对18F-FDG的摄取密切相关。该研究通过对34例PNETs患者的PET/CT图像和免疫组化进行分析,结果发现,葡萄糖转运体1在SCLC和LCNEC患者中的阳性表达率分别为91.6%和87.5%,而在类癌患者中的阳性表达率仅为16.6%。赵承勇等[19]通过对16例肺类癌患者的18F-FDG PET/CT图像分析发现,肺类癌病灶对18F-FDG的摄取轻度增高,SUVmax为4.00±1.64。何巍和穆晓东[20]发现,当SUVmax=7.1作为鉴别类癌与LCNEC的临界值时,其灵敏度和特异度均较高。柳卫等[21]发现,当SUVmax=11.9作为鉴别LCNEC有无淋巴结转移的临界值时,AUC为0.858。本研究结果显示,LCNEC和SCLC病灶的18F-FDG摄取明显高于类癌,鉴别LCNEC与SCLC的SUVmax临界值为12.25,这既证实了SUVmax能有效鉴别PNETs亚型,也对现有研究的不足作出了一定补充。
本研究中的TC、AC病例数较少,故将二者合并为类癌组进行分析,但二者的发病年龄、恶性程度、影像学特点及侵袭能力等均存在不同程度的差异,这可能使研究结果产生一定偏倚。本研究中患者的CT或PET/CT检查与组织病理学检查间隔一定时间,这可能对其CT与PET/CT影像学特征的分析造成一定影响。
总之,类癌患者发病年龄较小,多为支气管腔内形态规则的类圆形结节,增强CT扫描可见明显强化,尤其是TC;LCNEC多为周围型、分叶状肿块,毛刺等征象较少见,增强CT扫描呈轻-中度强化;SCLC以中央型多见,易侵犯周围血管,早期易发生淋巴结、远处转移。LCNEC和SCLC的SUVmax明显高于类癌,SUVmax=12.25作为鉴别LCNEC与SCLC的临界值,其灵敏度、特异度均较高。PNETs的CT与PET/CT表现有一定特征,PET/CT联合增强CT及HRCT多模态显像可提高对该病的诊断准确率。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 樊建坤负责数据的统计分析、论文的撰写;王腾、杨瀚负责图像的分析;唐光才负责研究命题的提出与设计、论文的修订与审阅;江国豪负责图像的采集与处理。
肺神经内分泌肿瘤的CT与18F-FDG PET/CT显像特征的分析
Analysis of CT and 18F-FDG PET/CT imaging features of pulmonary neuroendocrine tumors
-
摘要:
目的 探讨肺神经内分泌肿瘤(PNETs)的CT与18F-氟脱氧葡萄糖(FDG)PET/CT显像特征,比较单纯PET/CT与基于PET/CT联合增强CT及高分辨率CT多模态显像的诊断准确率。 方法 回顾性分析2010年1月至2019年5月于西南医科大学附属医院经组织病理学检查确诊的44例PNETs患者的临床资料和CT、PET/CT影像学资料,其中男性34例、女性10例,年龄14~78(57.3±10.0)岁。将PNETs患者分为类癌组(8例)、大细胞神经内分泌癌(LCNEC)组(15例)和小细胞肺癌(SCLC)组(21例)。分析所有患者的CT与PET/CT表现,观察PNETs各亚型的CT与PET/CT显像特征。采用受试者工作特征(ROC)曲线分析计算最大标准化摄取值(SUVmax)的诊断效能及临界值。以组织病理学检查结果为“金标准”,比较单纯PET/CT与基于PET/CT联合增强CT及高分辨率CT多模态显像的诊断准确率。计量资料的多组间比较采用单因素方差分析,两组间比较采用最小显著差异法;计数资料的比较采用χ2检验和Fisher确切概率法。 结果 类癌组患者的发病年龄低于LCNEC组与SCLC组患者[(46.62±8.09)岁对(61.47±8.03)岁对(58.52±9.39)岁],且差异有统计学意义(F=6.186,P=0.004);在性别、吸烟史等方面与LCNEC组和SCLC组患者的差异均无统计学意义(χ2=1.220、4.539;均P>0.05)。类癌组、LCNEC组、SCLC组患者在肿瘤部位、有无分叶征、阻塞性肺炎或肺不张、纵隔淋巴结转移、肺门淋巴结转移、纵隔及肺门淋巴结同时转移、远处转移、周围血管侵犯等方面的差异均有统计学意义(χ2=6.662~9.877,均P<0.05);而在肿瘤最大径、肿瘤形态、密度、强化程度、有无钙化、毛刺征、有无坏死和囊变、胸腔积液、支气管侵犯和胸膜增厚等方面的差异均无统计学意义(F=0.370,χ2=0.298~8.472;均P>0.05)。LCNEC组和SCLC组的SUVmax显著高于类癌组(13.79±3.06对9.51±2.49对4.52±1.77),且差异有统计学意义(F=32.43,P<0.01);鉴别LCNEC和SCLC的SUVmax临界值为12.25,曲线下面积为0.860(95%CI:0.729~0.991,P<0.01),灵敏度为80.00%,特异度为81.00%。单纯PET/CT与基于PET/CT联合增强CT及高分辨率CT多模态显像诊断PNETs的准确率分别为65.91%(29/44)和87.80%(36/41),且差异有统计学意义(χ2=5.655,P=0.017)。 结论 PNETs的CT与PET/CT显像具有一定特征性,PET/CT联合增强CT及高分辨率CT多模态显像可提高PNETs的诊断准确率。 -
关键词:
- 神经内分泌瘤 /
- 肺肿瘤 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 显像特征
Abstract:Objective To investigate the CT and 18FDG-fluorodeoxyglucose (FDG) PET/CT imaging features of pulmonary neuroendocrine tumors (PNETs) and to compare the accuracies of PNETs diagnosis based on PET/CT and the multimodal diagnostics of PET/CT combined with enhanced CT and high-resolution CT. Methods The clinical, CT, and PET/CT data of 44 patients with PNETs diagnosed via histopathological examination in the Affiliated Hospital of Southwest Medical University from January 2010 to May 2019 were analyzed retrospectively. The patients comprised 34 males and 10 females aged 14–78 (57.3±10.0) years. All patients were divided into the carcinoid group (8 cases), the large-cell neuroendocrine carcinoma group (LCNEC, 15 cases), and the small-cell lung cancer group (SCLC, 21 cases). The CT and PET/CT features of the PNETs were investigated and analyzed. The diagnostic efficacy and critical value of maximum standardized uptake value (SUVmax) were analyzed and calculated by receiver operating characteristic (ROC) curve. By taking the results of histopathological examination as the gold standard, the accuracies of PNET diagnosis based on PET/CT and the multimodal diagnostics of PET/CT combined with enhanced CT and high-resolution CT were compared. Measurement data were compared by using one-way analysis of variance, and the least significant difference method was used to compare the two groups. The qualitative data were compared by applying χ2 test or Fisher's exact probability method. Results The age of the carcinoid group was lower than that of the LCNEC and SCLC groups (46.62±8.09 vs. 61.47±8.03 vs. 58.52±9.39), and the difference was statistically significant (F=6.186, P=0.004). However, no significant difference in sex and smoking history (χ2=1.220, 4.539; both P>0.05) was found. Significant differences were discovered in the location, lobulation, obstructive pneumonia or atelectasis, mediastinal lymph node metastasis, hilar lymph node metastasis, simultaneous mediastinal and hilar lymph node metastasis, distant metastasis, and vascular invasion in patients in the carcinoid, LCNEC, and SCLC groups (χ2=6.662–9.877, all P<0.05). However, no significant difference was found in maximum diameter, shape, density, enhancement degree, calcification, spiculation, necrosis and cystic degeneration, pleural effusion, bronchial invasion, pleural thickening (F=0.370, χ2=0.298–8.472, all P>0.05). The SUVmax of the LCNEC and SCLC groups was significantly higher than that of the carcinoid group (13.79±3.06 vs. 9.51±2.49 vs. 4.52±1.77), and the difference was statistically significant (F=32.43, P<0.01). For differentiating LCNEC from SCLC, the cutoff value of SUVmax was 12.25, the area under curve was 0.860 (95%CI: 0.729−0.991, P<0.01), the sensitivity was 80.00%, and the specificity was 81.00%. The accuracy of PNETs diagnosis based on PET/CT was 65.91%(29/44) and that of the multimodal diagnostics of PET/CT combined with enhanced CT and high-resolution CT was 87.80%(36/41). The difference was statistically significant (χ2=5.655, P=0.017). Conclusions The CT and PET/CT manifestations of PNETs have certain characteristics, and the multimodal diagnostics of PET/CT combined with enhanced CT and high-resolution CT can improve the accuracy of diagnosing PNETs. -
表 1 44例肺神经内分泌肿瘤患者临床资料的比较
Table 1. Comparison of clinical data of 44 patients with pulmonary neuroendocrine tumor
组别 年龄( $ \bar {x} $ 

男性/女性(例) 吸烟史[例(%)] 类癌组(n=8) 46.62±8.09 5/3 3(37.5) LCNEC组(n=15) 61.47±8.03 12/3 12(80.0) SCLC组(n=21) 58.52±9.39 17/4 15(71.4) 检验值 F=6.186 χ2=1.220 χ2=4.539 P值 P=0.004 P=0.570 P=0.137 注:类癌组包括典型类癌患者5例、不典型类癌患者3例;LCNEC为大细胞神经内分泌癌;SCLC为小细胞肺癌 表 2 44例肺神经内分泌肿瘤患者CT与18F-FDG PET/CT的显像特征(例)
Table 2. Imaging features of CT and 18F-FDG PET/CT in 44 patients with pulmonary neuroendocrine tumor (case)
组别 形态 密度 钙化 分叶征 类圆形 不规则 均匀 不均匀 有 无 有 无 类癌组(n=8) 5 3 4 4 1 7 5 3 LCNEC组(n=15) 4 11 4 11 2 13 11 4 SCLC组(n=21) 5 16 6 15 4 17 5 16 检验值 χ2=3.726 χ2=1.504 χ2=0.298 χ2=9.457 P值 0.189 0.574 1.000 0.011 组别 毛刺征 阻塞性肺炎或肺不张 强化程度 坏死、囊变 有 无 有 无 轻 中 明显 有 无 类癌组(n=8) 2 6 7 1 0 3 4 3 5 LCNEC组(n=15) 7 8 3 12 5 6 3 11 4 SCLC组(n=21) 5 16 11 10 3 4 13 15 6 检验值 χ2=2.316 χ2=9.877 χ2=8.472 χ2=3.526 P值 0.300 0.006 0.065 0.211 组别 肺门淋巴结转移 纵隔淋巴结转移 肺门及纵隔淋巴结同时转移 有 无 有 无 有 无 类癌组(n=8) 1 7 2 6 1 7 LCNEC组(n=15) 9 6 7 8 5 10 SCLC组(n=21) 14 7 16 5 13 8 检验值 χ2=7.128 χ2=7.143 χ2=6.662 P值 0.036 0.028 0.041 组别 胸腔积液 胸膜增厚 支气管侵犯 周围血管侵犯 有 无 有 无 有 无 有 无 类癌组(n=8) 1 7 4 4 5 3 0 7 LCNEC组(n=15) 3 12 7 8 8 7 6 8 SCLC组(n=21) 7 14 12 9 13 8 13 7 检验值 χ2=1.644 χ2=0.405 χ2=0.312 χ2=8.913 P值 0.474 0.921 0.920 0.009 组别 远处转移 肿瘤部位 肿瘤最大径( $ \bar {x}\pm s$ 

SUVmax( $ \bar {x}\pm s $ 

有 无 中央型 周围型 类癌组(n=8) 1 7 6 2 4.40±2.84 4.52±1.77 LCNEC组(n=15) 3 12 3 12 4.13±2.27 13.79±3.06 SCLC组(n=21) 12 9 14 7 4.90±2.55 9.51±2.49 检验值 χ2=7.622 χ2=9.662 F=0.370 F=32.43 P值 0.025 0.010 0.693 P<0.01 注:类癌组包括典型类癌患者5例和不典型类癌患者3例。CT为计算机体层摄影术;FDG为氟脱氧葡萄糖;PET正电子发射断层显像术;LCNEC为大细胞神经内分泌癌;SCLC为小细胞肺癌;SUVmax为最大标准化摄取值 -
[1] Gustafsson BI, Kidd M, Chan A, et al. Bronchopulmonary neuroendocrine tumors[J]. Cancer, 2008, 113(1): 5−21. DOI: 10.1002/cncr.23542. [2] Saber M, Ismail Y, Alieldin N, et al. Neuroendocrine tumors of the lung: a five-year retrospective experience of Egyptian NCI (2010−2014)[J]. J Egypt Natl Canc Inst, 2018, 30(4): 151−158. DOI: 10.1016/j.jnci.2018.10.005. [3] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243−1260. DOI: 10.1097/JTO.0000000000000630. [4] 刘昕, 汪世存, 倪明, 等. 18F-FDG PET/CT在肺神经内分泌肿瘤中的应用[J]. 中国医学影像学杂志, 2019, 27(5): 355−359. DOI: 10.3969/j.issn.1005-5185.2019.05.009.
Liu X, Wang SC, Ni M, et al. Application of 18F-FDG PET/CT in pulmonary neuroendocrine tumors[J]. Chin J Med Imaging, 2019, 27(5): 355−359. DOI: 10.3969/j.issn.1005-5185.2019.05.009.[5] 郭丽娟, 向颖, 王红, 等. 肺神经内分泌肿瘤不同亚型CT特征差异研究[J]. 实用放射学杂志, 2018, 34(4): 518−521. DOI: 10.3969/j.issn.1002-1671.2018.04.008.
Guo LJ, Xiang Y, Wang H, et al. Differences of CT features for different subtypes of pulmonary neuroendocrine tumors[J]. J Pract Radiol, 2018, 34(4): 518−521. DOI: 10.3969/j.issn.1002-1671.2018.04.008.[6] Dincer HE, Podgaetz E, Andrade RS. Pulmonary neuroendocrine tumors: part I. Spectrum and characteristics of tumors[J]. J Bronchol Interv Pulmonol, 2015, 22(3): 267−273. DOI: 10.1097/LBR.0000000000000157. [7] Fink G, Krelbaum T, Yellin A, et al. Pulmonary carcinoid: presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature[J]. Chest, 2001, 119(6): 1647−1651. DOI: 10.1378/chest.119.6.1647. [8] 曾亮, 崔文静, 崔灿, 等. 肺少见神经内分泌癌的CT表现[J]. 医学研究生学报, 2017, 30(11): 1204−1207. DOI: 10.16571/j.cnki.1008-8199.2017.11.016.
Zeng L, Cui WJ, Cui C, et al. CT findings of rare pulmonary neuroendocrine carcinoma[J]. J Med Postgrad, 2017, 30(11): 1204−1207. DOI: 10.16571/j.cnki.1008-8199.2017.11.016.[9] 李小雪, 蒲红. CT诊断及鉴别诊断原发性肺类癌(附10例分析)[J]. 中国医学影像技术, 2020, 36(1): 142−143.
Li XX, Pu H. CT diagnosis and differential diagnosis of primary pulmonary carcinoid (analysis of 10 cases)[J]. Chin J Med Imaging Technol, 2020, 36(1): 142−143.[10] Yi CA, Lee KS, Kim EA, et al. Solitary pulmonary nodules: dynamic enhanced multi-detector row CT study and comparison with vascular endothelial growth factor and microvessel density[J]. Radiology, 2004, 233(1): 191−199. DOI: 10.1148/radiol.2331031535. [11] Baine MK, Rekhtman N. Multiple faces of pulmonary large cell neuroendocrine carcinoma: update with a focus on practical approach to diagnosis[J]. Transl Lung Cancer Res, 2020, 9(3): 860−878. DOI: 10.21037/tlcr.2020.02.13. [12] 刘莉, 吴宁. 原发性肺腺样囊性癌的CT表现[J]. 中国医学影像技术, 2009, 25(9): 1588−1590.
Liu L, Wu N. CT manifestations of primary pulmonary adenoid cystic carcinoma[J]. Chinese J Med Imaging Technol, 2009, 25(9): 1588−1590.[13] Paci M, Cavazza A, Annessi V, et al. Large cell neuroendocrine carcinoma of the lung: a 10-year clinicopathologic retrospective study[J]. Ann Thorac Surg, 2004, 77(4): 1163−1167. DOI: 10.1016/j.athoracsur.2003.09.070. [14] Li XC, Zhang WD, Wu XM, et al. Mucoepidermoid carcinoma of the lung: common findings and unusual appearances on CT[J]. Clin Imaging, 2012, 36(1): 8−13. DOI: 10.1016/j.clinimag.2011.03.003. [15] 英天舒, 张伟, 崔国元, 等. 小细胞肺癌的CT影像特征及相关临床研究[J]. 医学与哲学, 2016, 37(8): 37−39. DOI: 10.12014/j.issn.1002-0772.2016.04b.13.
Ying TS, Zhang W, Cui GY, et al. CT imaging characteristics and related studies of small cell lung cancer[J]. Med Philos, 2016, 37(8): 37−39. DOI: 10.12014/j.issn.1002-0772.2016.04b.13.[16] Carter BW, Glisson BS, Truong MT, et al. Small cell lung carcinoma: staging, imaging, and treatment considerations[J]. Radiographics, 2014, 34(6): 1707−1721. DOI: 10.1148/rg.346140178. [17] 贺锋, 陈林, 葛雨曦, 等. 小细胞肺癌的临床CT病理特点及其征象分析[J]. 中国CT和MRI杂志, 2016, 14(12): 64−67. DOI: 10.3969/j.issn.1672-5131.2016.12.022.
He F, Chen L, Ge YX, et al. Clinical CT pathological characteristics and signs of small cell lung cancer[J]. Chin J CT MRI, 2016, 14(12): 64−67. DOI: 10.3969/j.issn.1672-5131.2016.12.022.[18] Kaira K, Murakami H, Endo M, et al. Biological correlation of 18F-FDG uptake on PET in pulmonary neuroendocrine tumors[J]. Anticancer Res, 2013, 33(10): 4219−4228. [19] 赵承勇, 邓小毅, 王洪松, 等. 单发肺类癌的18F-FDG PET/CT表现[J]. 国际放射医学核医学杂志, 2020, 44(1): 32−36. DOI: 10.3760/cma.j.issn.1673-4114.2020.01.008.
Zhao CY, Deng XY, Wang HS, et al. 18F-FDG PET/CT image manifestations of solitary lung carcinoid tumor[J]. Int J Radiat Med Nucl Med, 2020, 44(1): 32−36. DOI: 10.3760/cma.j.issn.1673-4114.2020.01.008.[20] 何巍, 穆晓东. 18F-FDG PET/CT在非小细胞肺癌肺神经内分泌肿瘤诊断中的价值[J]. 中国临床医学影像杂志, 2019, 30(10): 690−693, 707. DOI: 10.12117/jccmi.2019.10.002.
He W, Mu XD. Diagnostic value of 18F-FDG PET/CT in non-small cell lung cancer pulmonary neuroendocrine tumors[J]. J China Clin Med Imaging, 2019, 30(10): 690−693, 707. DOI: 10.12117/jccmi.2019.10.002.[21] 柳卫, 李天女, 范磊, 等. 肺大细胞神经内分泌癌的18F-FDG PET/CT表现[J]. 国际放射医学核医学杂志, 2018, 42(6): 486−490. DOI: 10.3760/cma.j.issn.1673-4114.2018.06.002.
Liu W, Li TN, Fan L, et al. 18F-FDG PET/CT manifestations of pulmonary large cell neuroendocrine carcinoma[J]. Int J Radiat Med Nucl Med, 2018, 42(6): 486−490. DOI: 10.3760/cma.j.issn.1673-4114.2018.06.002. -





 下载:
下载: