-
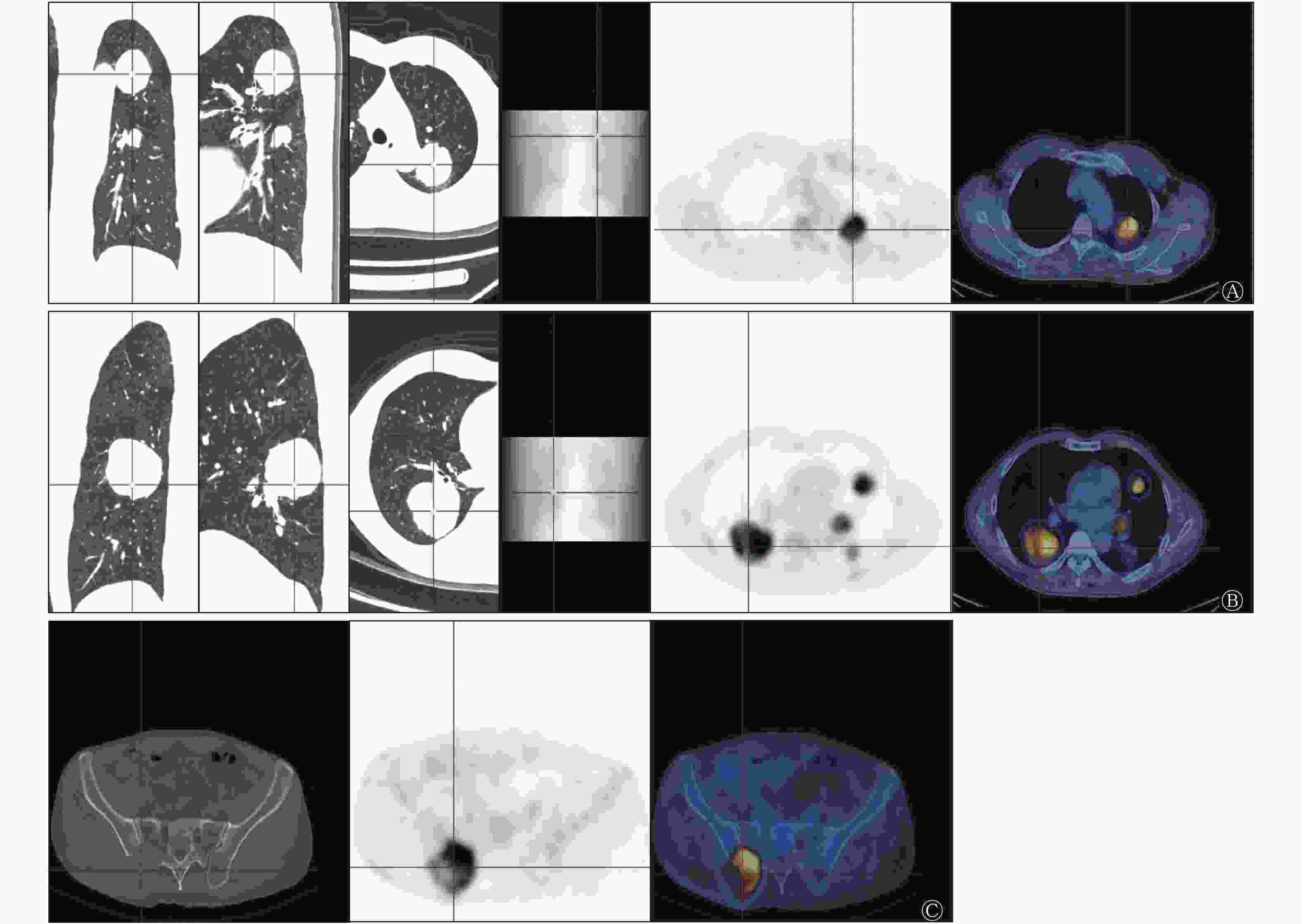
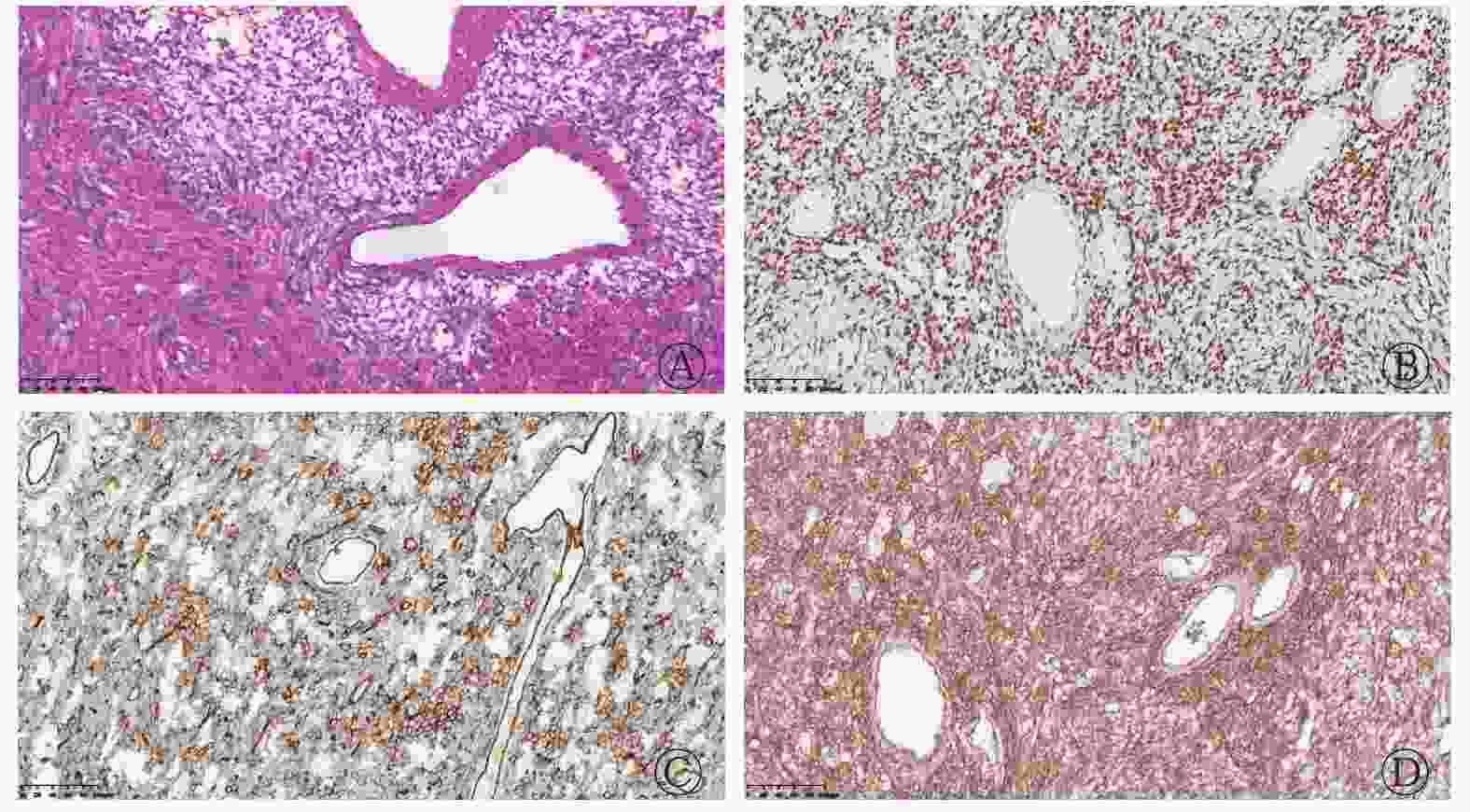
患者男性,48岁,因咳嗽和咳痰入院就诊,无发热、咳血和胸痛等症状。胸部增强CT检查结果显示,双肺多发边界清晰的结节及肿块,动脉期呈明显不均匀强化,内见强化血管影,延迟期病变持续强化(图1)。随后行全身18F-FDG PET/CT检查,结果显示,双肺多发糖代谢异常增高、大小不等的结节及肿块,密度均匀,边界清晰,SUVmax=10.2;右侧骶髂关节处见溶骨性骨质破坏伴糖代谢异常增高,SUVmax=13.1(图2)。右肺下叶肿块穿刺活体组织病理学检查结果显示,右肺下叶肿块中梭形细胞呈束状分布,可见细胞稀疏及密集区,同时可见丰富的血管;免疫组织化学检查结果为CD34(+),B淋巴细胞瘤2蛋白(Bcl-2)(灶+),平滑肌肌动蛋白(SMA)(−),细胞角蛋白(CK)(−),结蛋白(desmin)(−),CD99(+),信号传导及转录激活蛋白6(STAT6)(+),DOG-1(灶+)、波形蛋白(Vimentin)(+),增殖细胞核抗原Ki-67(+)(10%~20%)(图3),综合以上结果,诊断为孤立性纤维瘤(solitary fibrous tumor,SFT)。2个月后,电话随访患者得知其未行任何治疗,一般状态较差。
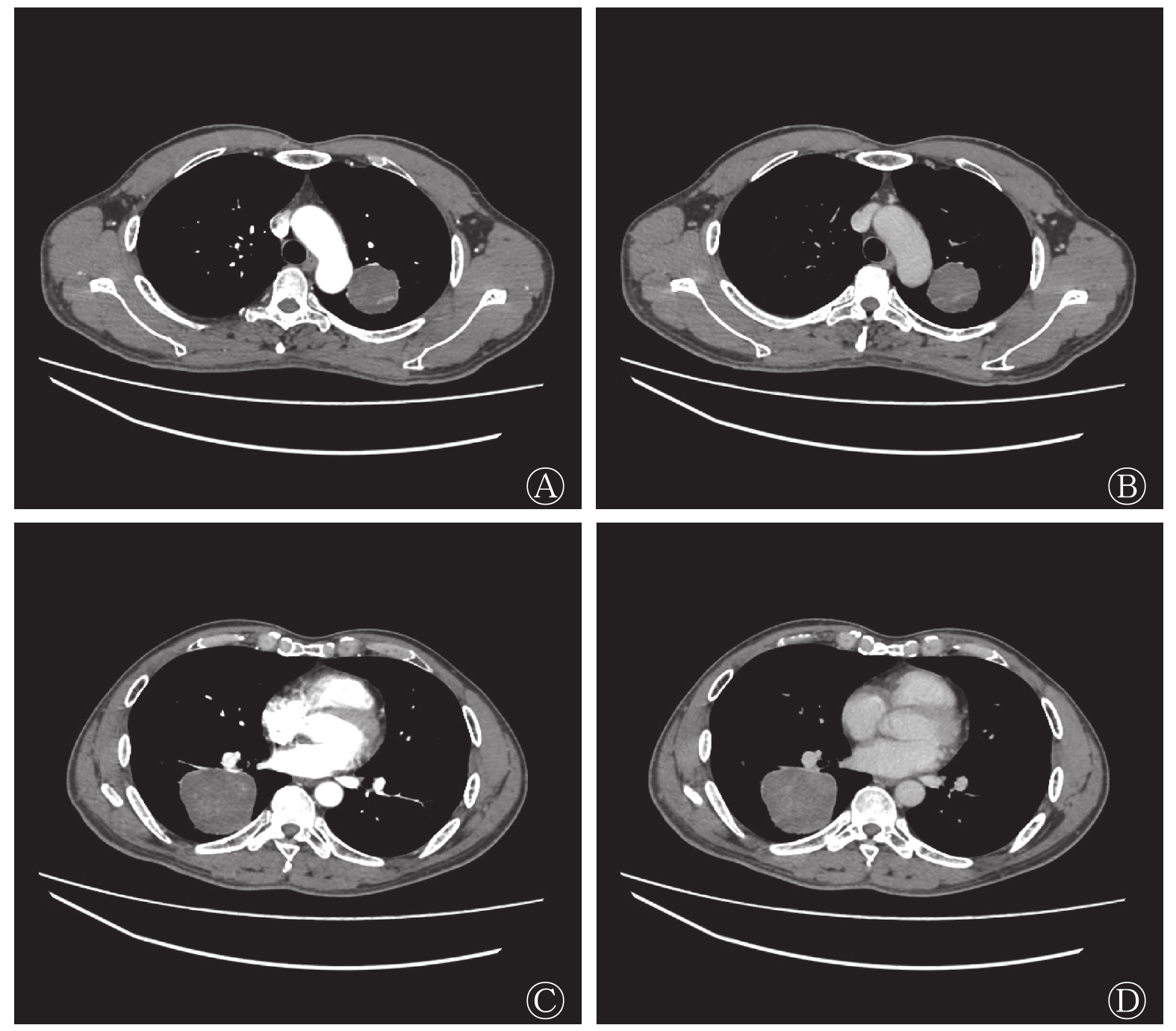
图 1 多发肺孤立性纤维瘤患者(男性,48岁)的增强CT图
Figure 1. Contrast-enhanced CT images of the patient with multiple intrapulmonary solitary fibrous tumor (male, 48 years old)
-
SFT是一种较为少见的肿瘤,起源于间叶组织,由细胞和胶原成分组成。大多数SFT起源于脏层胸膜,部分起源于壁层胸膜,肺SFT非常少见[1]。SFT多数为良性、单发,极少数为恶性,甚至可能发生远处转移,最常见的转移部位包括肺、胸膜、腹部脏器、腹膜后、皮下组织和骨骼[2]。肺SFT多见于成年人,多为良性、生长缓慢,一般无临床症状,多为偶然发现,肿瘤压迫邻近器官可能会引起胸痛、咳嗽、呼吸困难和杵状指等症状[3]。有时因肿瘤分泌胰岛素样生长因子Ⅱ,患者会出现低血糖和癫痫症状[4]。虽然SFT的影像学表现有一定的特征性,但是其确诊仍依赖于组织病理学检查。目前,SFT的诊断依赖于免疫组织化学检查,S-100表达通常呈阴性,90%~95%的SFT患者CD34表达呈阳性,70%的SFT患者CD99表达呈阳性[5]。然而,CD34对SFT的诊断是非特异性的。目前,细胞核表达信号传导及转录激活蛋白6(STAT6)已成为诊断SFT的“金标准”[6]。手术切除是治疗该病的首选方案,也是唯一有望治愈该病的手段。SFT的病死率和复发率较高,需要对肿瘤进行完整的手术切除,并对患者进行密切的术后随访。
在增强CT图像中,肺SFT多表现为边界清晰的圆形或卵圆形结节或肿块,常表现为早期明显强化。本例患者的增强CT结果显示,动脉期呈明显不均匀强化,延迟期持续强化,这种渐进性的强化方式对于肺SFT的诊断和鉴别具有重要价值[7]。目前,对SFT患者行18F-FDG PET/CT检查的报道很少。PET/CT是评估肿瘤大小、侵犯范围及远处转移的重要方法,可预测肿瘤的生物学行为,18F-FDG的代谢程度与肿瘤的侵袭性行为有关[8]。良性SFT一般表现为低代谢,恶性SFT常表现为均匀的高代谢[9]。Shinya等[1]报道了1例肺单发良性SFT患者,其SUVmax=1.56。Ozeki等[2]对1例并发脑转移的肺SFT患者进行了报道,其SUVmax=19.5。除了高代谢提示SFT为恶性之外,病变多发也是恶性SFT的征象[9]。本例患者病变多发且表现为高代谢,SUVmax=10.2,高度提示病变为恶性。有研究结果显示,适宜手术切除的SFT转移灶可选择手术治疗,不适宜手术的SFT患者可考虑放疗,放疗的局部控制率为30%~60%[10]。本例患者的18F-FDG PET/CT图像显示右侧骶髂关节溶骨性骨转移,可对治疗方案的选择提供指导。
肺SFT与肺内其他表现为边界清晰肿块和结节的肿瘤的鉴别诊断如下。(1)错构瘤:结节多呈圆形或类圆形,可为分叶状肿块,爆米花样钙化和具有脂肪成分为其典型表现,而SFT少见钙化,增强CT图像显示无强化或轻度强化;(2)硬化性肺泡细胞瘤:多见于青年女性,“空气新月征”、“贴边血管征”、“晕征”和“血管强化征”等影像学征象有助于鉴别其与SFT;(3)转移瘤:常多发,患者有原发肿瘤病史;(4)类癌:患者出现“冰山征”,常毗邻支气管或使邻近支气管狭窄和阻塞。
总之,肺SFT的CT表现有一定的特征性,即单发或多发结节或肿块,呈圆形、类圆形或分叶状,边界清晰,增强CT图像显示明显不均匀强化和渐进性强化。18F-FDG PET/CT检查结果可提示病变的良恶性,并帮助临床医师明确病变的侵犯范围和远处转移情况。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李慧敏负责病例的收集与随访、文献的查阅、论文的撰写;刘举珍负责论文的修订。
多发肺孤立性纤维瘤增强CT和18F-FDG PET/CT显像一例
Contrast-enhanced CT and 18F-FDG PET/CT imaging of multiple intrapulmonary solitary fibrous tumor: a case report
-
摘要: 大多数孤立性纤维瘤(SFT)起源于脏层胸膜,部分起源于壁层胸膜,肺SFT非常少见。增强CT检查对肺SFT的诊断和鉴别具有重要价值。PET/CT是评估肿瘤大小、侵犯范围及远处转移的重要方法。虽然SFT的影像学表现有一定的特征性,但其确诊仍依赖于组织病理学检查。笔者报道了1例多发肺SFT病例,从临床症状、增强CT和18F-FDG PET/CT影像学表现、病理诊断及鉴别诊断等方面分析了该病的特点,并通过文献复习加深了对该病的认识。Abstract: Most solitary fibrous tumors (SFT) originate from the visceral pleura, and some from the parietal pleura, and intrapulmonary SFT is very rare. Contrast-enhanced CT examination is of great value in the diagnosis and differentiation of intrapulmonary SFT. PET/CT is an important examination method to evaluate the tumor size, invasion range and distant metastasis. Although the imaging features of intrapulmonary SFT have certain characteristics, its diagnosis depends on histopathological examination. The authors reported a case of intrapulmonary SFT. The characteristics of the disease were analyzed on the basis of clinical symptoms, contrast-enhanced CT and 18F-FDG PET/CT imaging findings as well as pathological diagnosis and differential diagnosis, and through literature review, the understanding of the disease was improved.
-
Key words:
-
-
[1] Shinya T, Masaoka Y, Sando M, et al. Imaging an intrapulmonary solitary fibrous tumor with CT and F-18 FDG PET/CT[J/OL]. Radiol Case Rep, 2019, 14(6): 755−758[2020-05-05]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6449767. DOI: 10.1016/j.radcr.2019.03.023. [2] Ozeki N, Kawaguchi K, Taniguchi T, et al. Primary pulmonary solitary fibrous tumour with brain metastases[J]. Eur J Cardiothorac Surg, 2014, 45(2): 386−388. DOI: 10.1093/ejcts/ezt289. [3] Baliga M, Flowers R, Heard K, et al. Solitary fibrous tumor of the lung: a case report with a study of the aspiration biopsy, histopathology, immunohistochemistry, and autopsy findings[J]. Diagn Cytopathol, 2007, 35(4): 239−244. DOI: 10.1002/dc.20611. [4] Adhami N, Ahmed R, Lento PA, et al. Fibrous pleural tumor with hypoglycemia: case study[J]. Mt Sinai J Med, 2004, 71(5): 344−346. [5] Guillou L, Fletcher JA, Fletcher CDM, et al. Extrapleural solitary fibrous tumor and hemangiopericytoma. WHO classification of tumors: pathology and genetics of tumours of soft tissue and bone[M]. Lyon: IARC Press, 2002: 86–90. [6] Yoshida A, Tsuta K, Ohno M, et al. STAT6 immunohistochemistry is helpful in the diagnosis of solitary fibrous tumors[J]. Am J Surg Pathol, 2014, 38(4): 552−559. DOI: 10.1097/PAS.0000000000000137. [7] 唐慧, 任成龙, 贺太平. 右肺孤立性纤维瘤1例[J]. 实用放射学杂志, 2017, 33(3): 489. DOI: 10.3969/j.issn.1002-1671.2017.03.047.
Tang H, Ren CL, He TP. One case: solitary fibroma of the right lung[J]. J Pract Radiol, 2017, 33(3): 489. DOI: 10.3969/j.issn.1002-1671.2017.03.047.[8] Dong AS, Zuo CJ, Wang Y, et al. Enhanced CT and FDG PET/CT in malignant solitary fibrous tumor of the lung[J]. Clin Nucl Med, 2014, 39(5): 488−491. DOI: 10.1097/RLU.0000000000000281. [9] Ginat DT, Bokhari A, Bhatt S, et al. Imaging features of solitary fibrous tumors[J]. AJR Am J Roentgenol, 2011, 196(3): 487−495. DOI: 10.2214/AJR.10.4948. [10] 张秀萍, 罗荣奎, 纪元, 等. 复发或转移性孤立性纤维瘤的临床诊治策略[J]. 中国临床医学, 2019, 26(3): 374−377. DOI: 10.12025/j.issn.1008-6358.2019.20190046.
Zhang XP, Luo RK, Ji Y, et al. Clinical strategy for treatment of patients with recurrent or metastatic solitary fibrous tumor[J]. Chin J Clin Med, 2019, 26(3): 374−377. DOI: 10.12025/j.issn.1008-6358.2019.20190046. -





 下载:
下载: