-
宫颈癌是最常见的妇科恶性肿瘤之一,其发病率和病死率逐年升高,已成为威胁女性健康的主要问题。目前,对宫颈癌患者的治疗主要包括手术、放疗和化疗[1]。然而,放疗和化疗在某些情况下并不有效,患者的5年生存率只有40%~50%[2]。并且由于一些肿瘤细胞对X射线的敏感性降低,导致对宫颈癌患者的治疗远远达不到预期的效果[3]。因此,探讨宫颈癌细胞的耐辐射机制,探索新的治疗策略以改善患者的预后已成为当务之急。
异紫堇碱(isocorydine,ICD)是一种阿朴啡类生物碱,广泛存在于秃疮花[Dicranostigma leptopodum(Maxim.)Fedde]、紫金龙[Dactylicapnos scandens(D.Don)Hutchins]等多种罂粟科植物中,临床用于治疗痉挛和血管舒张,以及抗疟原虫和抗心律失常等治疗[4]。既往研究结果表明,ICD可以通过诱导宫颈癌SiHa细胞的细胞周期阻滞,抑制细胞增殖、侵袭和转移,调控上皮间充质转化来抑制宫颈癌细胞的生长,发挥抗癌活性的作用[5]。
最近的研究结果显示,微小RNA(microRNA,miRNA)参与调节不同癌细胞的辐射敏感性,并在癌症的发生和发展中起着至关重要的作用[6];miR-129-5p在宫颈癌组织中低表达,其表达的上调可以抑制宫颈癌细胞的侵袭、迁移以及荷瘤裸鼠体内肿瘤的生长和血管生成能力[7];知母皂苷A-Ⅲ抑制肾癌细胞转移的特性,有助于抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路,提高miR-129-5p的表达,以及下调组织蛋白酶C的表达[8]。然而ICD在宫颈癌辐射敏感性中的作用及其是否通过上调miR-129-5p和抑制PI3K/Akt信号通路来发挥作用尚未可知。
本研究探讨ICD对宫颈癌SiHa细胞增殖、辐射敏感性的影响及其潜在的分子机制,为宫颈癌治疗药物的研发提供新思路。
-
宫颈癌SiHa细胞购自中国科学院上海生命科学研究院细胞资源中心,DMEM培养基、胎牛血清购自美国Hyclone公司,ICD购自深圳爱拓公司,MTT购自美国Sigma公司,RIPA裂解液购自上海碧云天公司,Lipofectamine 2000试剂、Trizol试剂购自美国Invitrogen公司,cDNA合成试剂盒购自日本TaKaRa公司,聚偏二氟乙烯(PVDF)膜购自美国EMD Millipore公司,二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自美国Pierce公司,磷酸化组蛋白H2AX(phosphorylated histone H2AX,γ-H2AX)抗体购自上海Abcam公司,磷酸化PI3K(p-PI3K)、磷酸化Akt(p-Akt)、β肌动蛋白(β-actin)、细胞周期蛋白D1(cyclinD1)抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记山羊抗兔免疫球蛋白G(IgG)购自武汉博士德生物有限公司,miR-NC、miR-129-5p、anti-miR-NC、anti-miR-129-5p均购自上海GenePharma公司。Multiscan MK3酶标仪购自美国Thermo Scientific公司,7500 PCR仪购自美国ABI公司,Neulife医用电子直线加速器购自沈阳东软医疗系统有限公司。
-
在宫颈癌SiHa细胞中加入含10%胎牛血清的DMEM培养基,于37℃、5% CO2、95%湿度的培养箱中培养,每周换液2~3次。选取处于对数生长期的SiHa细胞,分别采用25、50、100、200 μmol/L的ICD处理72 h(简称ICD处理组,后续实验中均采用100 μmol/L的ICD处理72 h),同时将正常培养未经ICD处理的SiHa细胞设为对照(normal control,NC)组。
-
将密度为5×104个/mL的SiHa细胞接种于96孔板,培养72 h后加入20 μL 5 mg/mL的MTT溶液,37℃培养4 h,加入150 μL二甲基亚砜,摇床震荡10 min,于酶标仪490 nm波长处测定吸光度(A490值),计算细胞的增殖抑制率。增殖抑制率(%)=(1−ICD处理组吸光度/NC组吸光度)×100%。
-
收集ICD处理的SiHa细胞500个,分别使用0、2、4、6、8 Gy X射线照射,剂量率为300 cGy/min。待观察到明显的细胞克隆时,吸弃原有的培养液,分别使用甲醇固定和结晶紫染色,在显微镜下观察,以细胞数>50个作为1个克隆,计算细胞的克隆形成率。其中,细胞克隆形成率(%)=细胞克隆数/接种细胞数×100%,细胞存活分数(%)=受照射细胞克隆形成率/未照射细胞克隆形成率×100%。通过应用GraphPad Prism7软件(美国GraphPad Software公司)进行单击多靶模型拟合细胞存活曲线,分析放射生物学参数,包括平均致死剂量(D0)、准闭剂量(Dq)、外推值(N),计算SER,SER=NC组D0/ICD处理组D0。
-
采用RIPA裂解液提取ICD处理+6 Gy X射线照射后12 h的SiHa细胞蛋白(检测γ-H2AX蛋白的表达)和ICD处理的SiHa细胞蛋白(检测p-PI3K和p-Akt蛋白的表达),经二喹啉甲酸(BCA)法定量后,吸取30 μg蛋白样品进行10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电泳结束后转PVDF膜,将PVDF膜置于5%脱脂奶粉中室温封闭1 h,依次加入γ-H2AX、p-PI3K和p-Akt一抗(稀释比例为1∶1000),用TBST(tris buffered saline with tween)缓冲溶液充分漂洗膜,加入辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(稀释比例为1∶5000),置于化学发光液中曝光显影。以β-actin作为对照,分析γ-H2AX、p-PI3K和p-Akt蛋白的表达。
-
采用Trizol试剂提取ICD处理的SiHa细胞总RNA,按照cDNA合成试剂盒说明书进行操作,通过反转录获得cDNA,进行qRT-PCR。miR-129-5p的上游引物序列为5′-GATCCGCAAGCCCAGACCGCAAAAAGTTTTTA-3′,下游引物序列为5′-AGCTTAAAAACTTTTTGCGGTCTGGGCTTGCG-3′。内参蛋白β-actin的上游引物序列为5′-CTACAATGAGCTGCGTGTGG-3′,下游引物序列为5′-TAGCTCTTCTCTCCAGGGAGGA-3′。根据2−ΔΔCt法计算miR-129-5p的相对表达量。
-
将密度为1×105个/mL的SiHa细胞接种于6孔板中,待细胞生长至70%汇合度时,严格按照Lipofectamine 2000试剂说明书上的操作,分别转染miR-NC、miR-129-5p、anti-miR-NC、anti-miR-129-5p到SiHa细胞中。转染48 h后,在转染anti-miR-NC、anti-miR-129-5p的细胞中分别加入100 μmol/L的ICD。参照1.3~1.6节中所述方法进行SiHa细胞的增殖和辐射敏感性、γ-H2AX蛋白的表达、PI3K/Akt信号通路相关蛋白的表达、miR-129-5p的相对表达量的测定;参照1.5 节中所述方法检测cyclinD1蛋白的表达,其一抗稀释比例为1∶1000。
-
应用SPSS 22.0软件进行统计学分析。计量资料符合正态分布以
$\bar x $ ±s表示,2组间数据的比较采用独立样本t检验(方差齐)。P<0.05为差异有统计学意义。 -
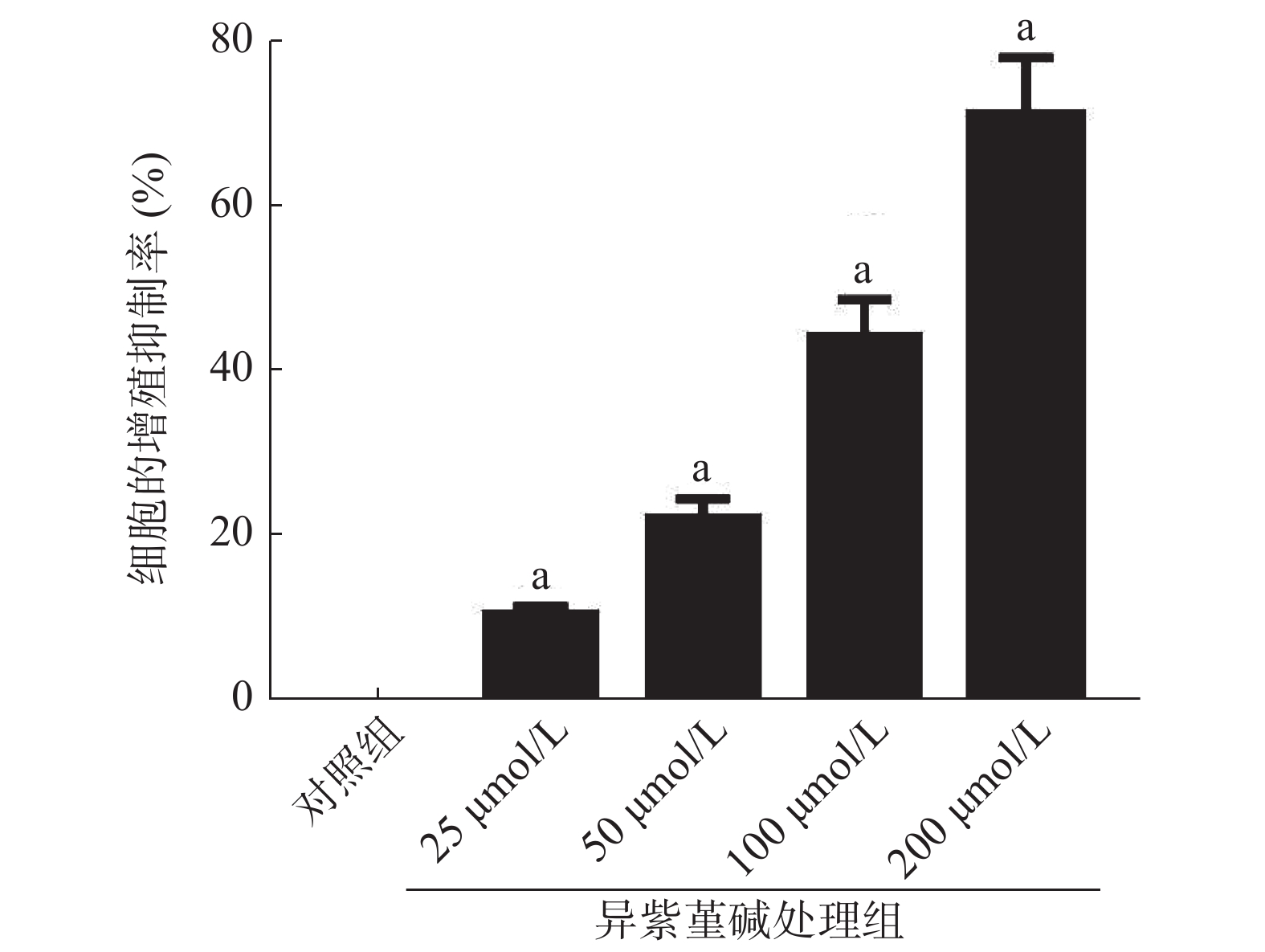
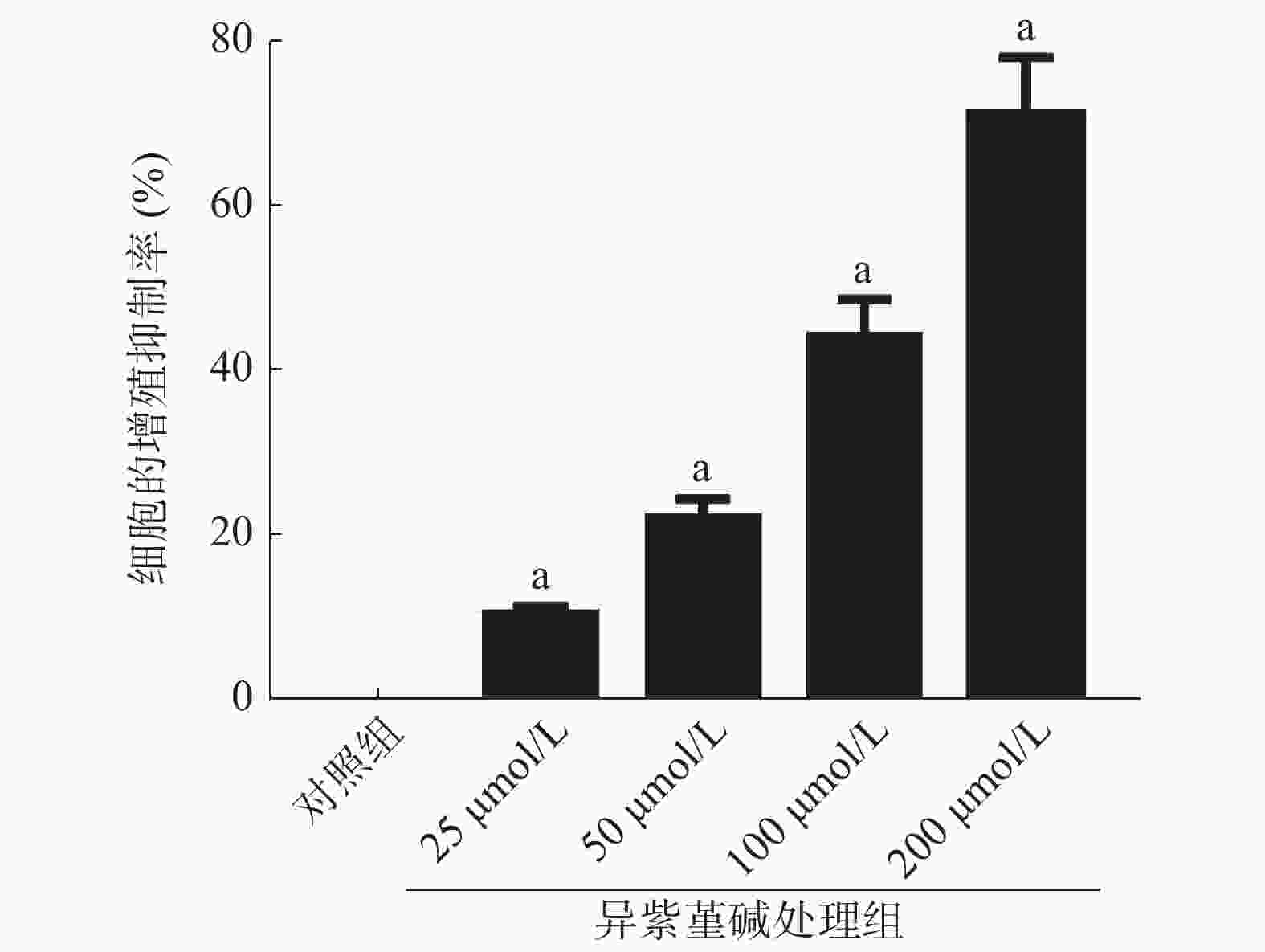
MTT实验结果显示,与NC组SiHa细胞的增殖抑制率[(0.05±0.01)%]相比,25、50、100、200 μmol/L ICD处理组能够明显提高SiHa细胞的增殖抑制率[(10.26±1.03)%、(22.16±2.21)%、(44.09±4.41)%、(70.88±7.09)%],且差异均有统计学意义(均P<0.05)(图1)。
-
与NC组比较,100 μmol/L ICD处理组能够明显降低2、4、6、8 Gy X射线照射的SiHa细胞的存活分数(均P<0.05,图2A),且提高γ-H2AX蛋白的相对表达量(P<0.05,图2B),细胞的SER为1.12(表1)。
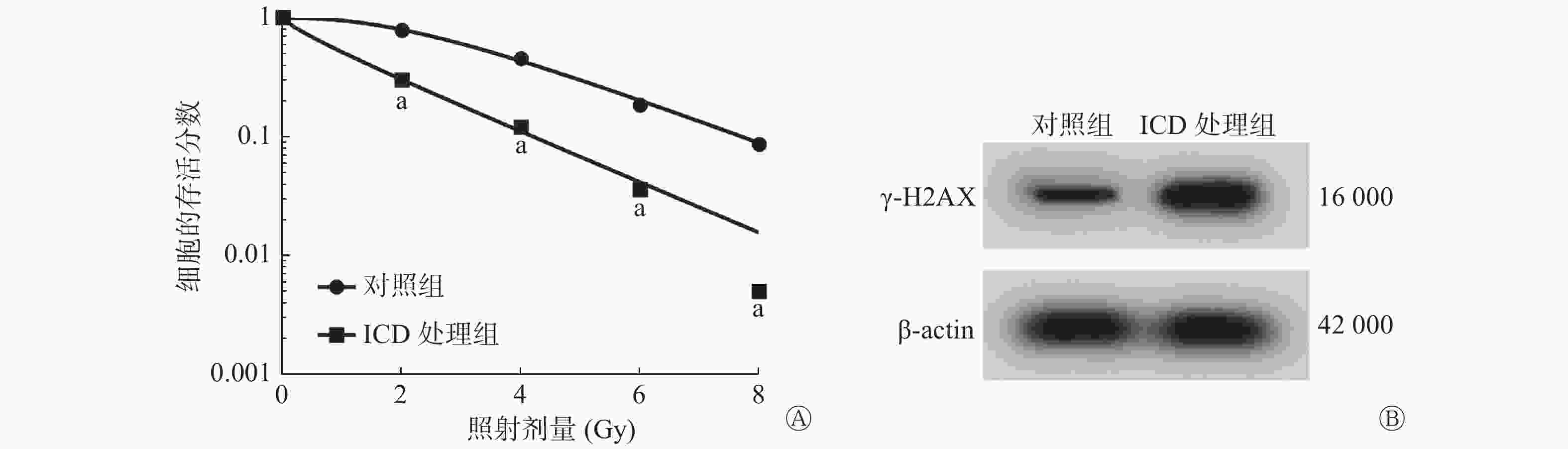
图 2 ICD对宫颈癌SiHa细胞辐射敏感性的影响
Figure 2. Effect of isocorydine on the radiosensitivity of cervical cancer SiHa cells
组别 D0(Gy) Dq(Gy) N SF2 k SER(D0比值) 对照组 2.305 2.488 2.943 0.799 0.434 - ICD处理组 2.058 0.562 0.761 0.304 0.486 1.12 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;ICD为异紫堇碱;-表示无此项数据 表 1 ICD联合X射线照射对宫颈癌SiHa细胞作用的单击 多靶模型的参数值
Table 1. Statistical results of single-click multi-target model of the effect of isocorydine combined with X-ray irradiation on cervical cancer SiHa cells
-
qRT-PCR检测结果显示,与NC组比较,ICD处理组能够明显提高SiHa细胞中miR-129-5p的相对表达量(3.22±0.32对1.00±0.11,t=19.682,P<0.05)。
-
由图3可见,与转染miR-NC组比较,转染miR-129-5p组能够明显提高SiHa细胞中miR-129-5p的相对表达量(P<0.05,图3A),这表明高表达miR-129-5p的细胞已构建成功;与转染miR-NC组比较,转染(高表达)miR-129-5p组能够明显提高SiHa细胞的增殖抑制率[(75.06±7.51)%对(1.04±0.10)%,P<0.05,图3B],降低2、4、6、8 Gy X射线照射后细胞的存活分数(均P<0.05,图3C),降低cyclinD1蛋白的相对表达量(P<0.05,图3D),并提高γ-H2AX蛋白的相对表达量(P<0.05,图3E),细胞的SER为1.68(表2)。
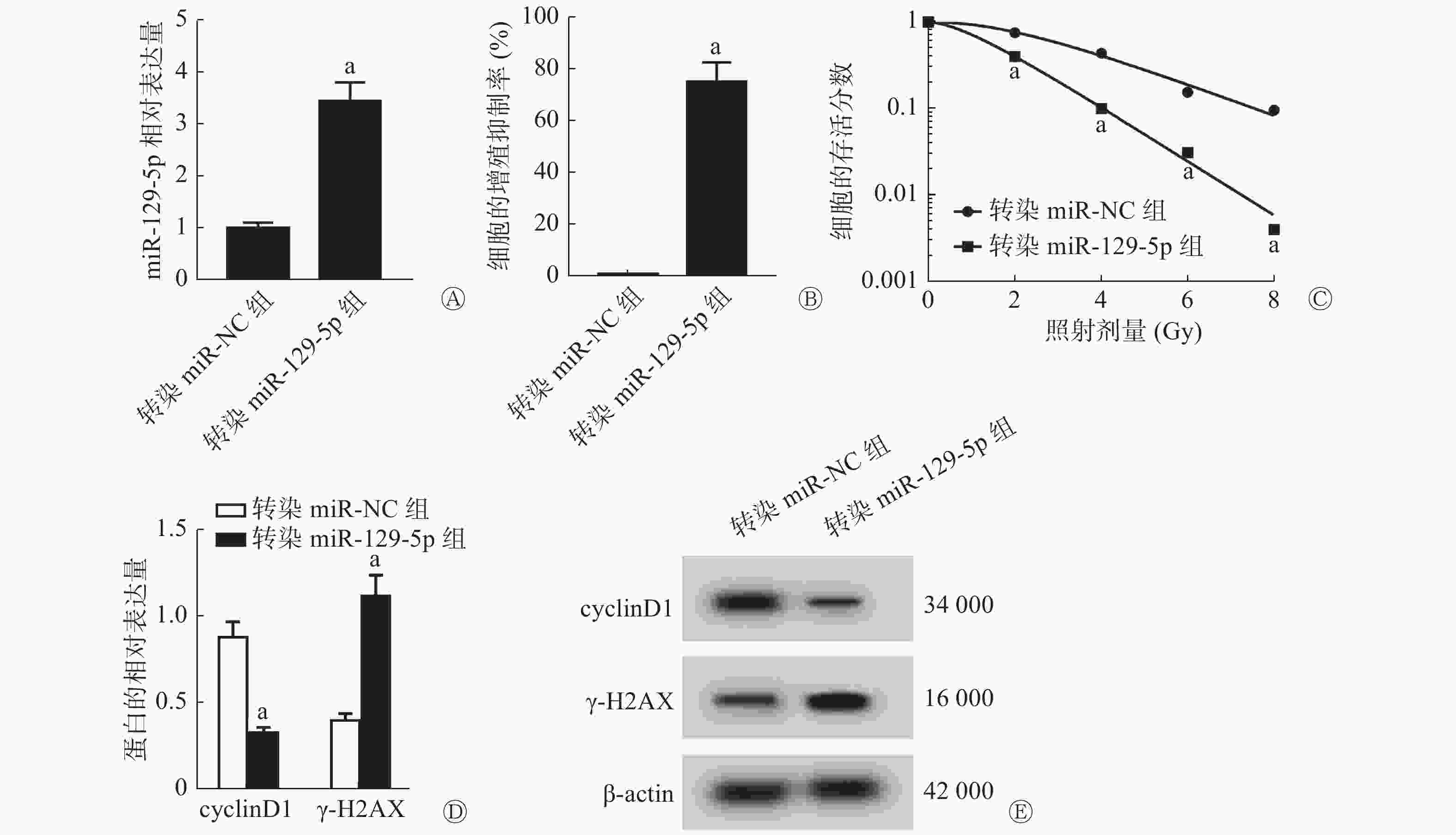
图 3 高表达miR-129-5p对宫颈癌SiHa细胞的增殖和辐射敏感性的影响
Figure 3. Effect of high expression of miR-129-5p on the proliferation and radiosensitivity of cervical cancer SiHa cells
组别 D0
(Gy)Dq
(Gy)N SF2 k SER
(D0比值)转染miR-NC组 2.329 2.275 2.655 0.769 0.429 - 转染miR-129-5p组 1.383 0.893 1.907 0.401 0.723 1.68 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;NC为对照;-表示无此项数据 表 2 高表达miR-129-5p联合X射线照射对宫颈癌SiHa细 胞作用的单击多靶模型的参数值
Table 2. Statistical results of single-click multi-target model of the effects of miR-129-5p overexpression combined with X-ray irradiation on cervical cancer SiHa cells
-
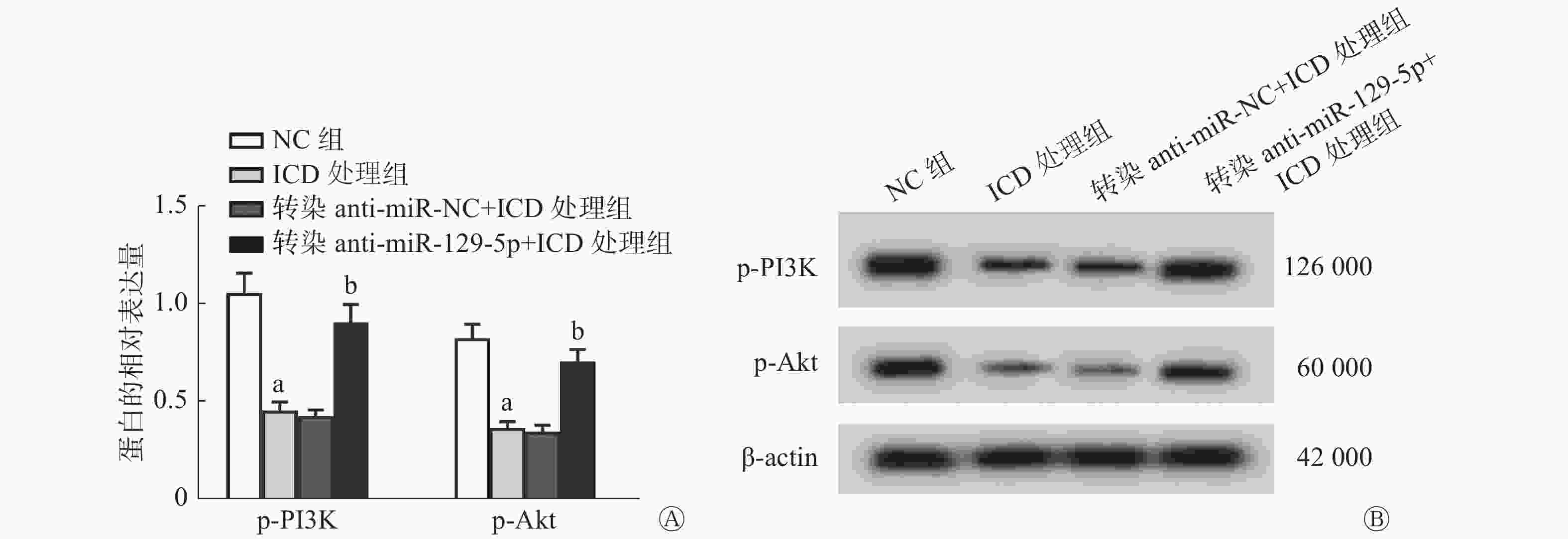
由图4可见,与转染anti-miR-NC+ICD处理组比较,转染anti-miR-129-5p(低表达miR-129-5p)+ICD处理组能够明显降低SiHa细胞中miR-129-5p的相对表达量(P<0.05,图4A)、细胞的增殖抑制率[(21.09±2.11)%对(71.49±7.15)%,P<0.05,图4B],能够提高2、4、6、8 Gy X射线照射后细胞的存活分数(均P<0.05,图4C)、cyclinD1蛋白的相对表达量(P<0.05,图4D),并降低γ-H2AX蛋白的相对表达量(P<0.05,图4E),细胞的SER为0.83(表3)。
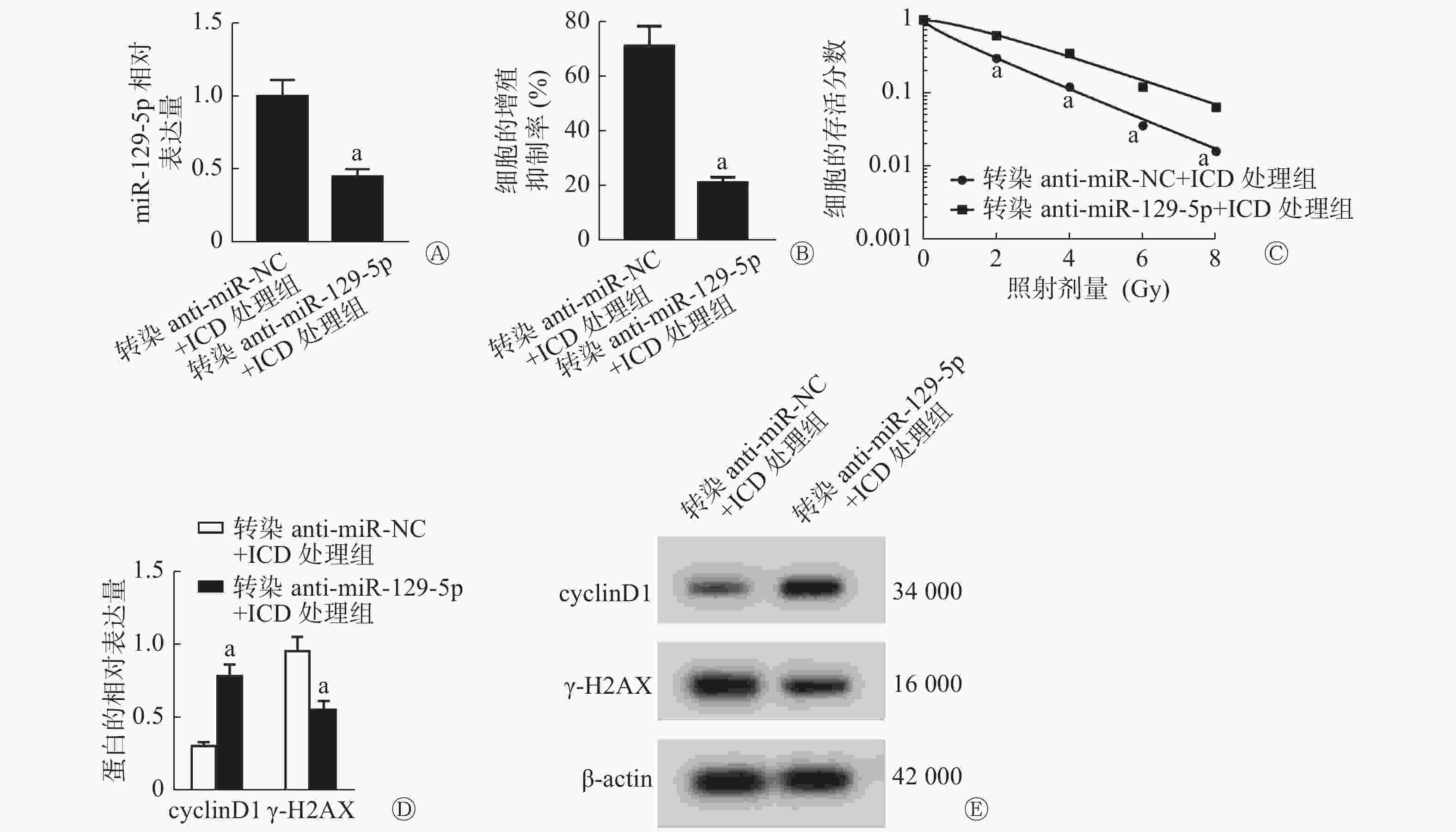
图 4 低表达miR-129-5p对ICD处理的SiHa细胞的增殖和辐射敏感性的影响
Figure 4. Effect of low expression of miR-129-5p on the proliferation and radiosensitivity of cervical cancer SiHa cells treated with isocorydine
组别 D0(Gy) Dq(Gy) N SF2 k SER(D0比值) 转染anti-miR-NC+ICD处理组 2.144 0.709 0.718 0.302 0.467 - 转染anti-miR-129-5p+ICD处理组 2.569 1.199 1.595 0.625 0.389 0.83 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;NC为对照;ICD为异紫堇碱;-表示无此项数据 表 3 低表达miR-129-5p联合X射线照射对ICD处理的宫颈癌SiHa细胞作用的单击多靶模型的参数值
Table 3. Statistical results of single-click multi-target model of the effect of miR-129-5p underexpression combined with X-ray irradiation on cervical cancer SiHa cells treated with isocorydine
-
由图5可见,与NC组比较,ICD处理组能够明显降低SiHa细胞的p-PI3K、p-Akt蛋白的相对表达量(均P<0.05);与转染anti-miR-NC+ICD处理组比较,转染anti-miR-129-5p(低表达miR-129-5p)+ICD处理组能够显著提高SiHa细胞中p-PI3K、p-Akt蛋白的相对表达量(均P<0.05)。
-
宫颈癌的发病率和病死率在女性恶性肿瘤中排名第四位,2018年全球新发宫颈癌约570 000例,死亡311 000例[9]。在发达国家,由于妇科疾病筛查率的提高和人乳头瘤病毒(HPV)疫苗使用的增加,宫颈癌的发病率有所下降[9],大多数新发病例和死亡病例发生在发展中国家[10],宫颈癌的治疗仍然是这些国家面临的一个重大的临床问题。手术、化疗联合放疗是目前宫颈癌的主要治疗方法。近年来,随着放疗技术的进步和发展,其在临床中的作用日益突出。放疗不仅在局部进展期宫颈癌中起着关键作用,而且在术后治疗中也可作为辅助治疗方法用于防止局部复发[11]。尽管随着宫颈癌筛查率的逐渐提高和治疗策略的进步,宫颈癌患者的生存率有所提高,但仍有一些患者因肿瘤转移或耐药而死亡[12],宫颈癌细胞对辐射敏感性的降低是部分患者复发转移的重要原因[13]。目前仍需要新的针对宫颈癌患者的有效治疗方法。因此,有必要研究宫颈癌细胞的辐射耐受机制,开发宫颈癌辐射增敏的药物,寻找宫颈癌放疗耐受患者潜在的新的治疗靶点。
ICD是一种很有潜力的抗癌药物,既往研究结果表明,ICD参与细胞的增殖、凋亡和迁移等过程,具有良好的抗癌活性[5]。ICD通过抑制肝癌细胞外信号调节激酶(ERK)信号通路,抑制阿霉素诱导的上皮-间质转化[14],并可能通过抑制核因子κB(NF-κB)通路活性抑制人子宫内膜腺癌细胞的增殖和迁移,以及诱导细胞凋亡[15]。ICD对子宫内膜癌HEC-1B细胞的增殖、迁移具有抑制作用,对细胞凋亡具有促进作用,具体机制与抑制PI3K/Akt/NF-κB信号通路活性紧密相关[16]。然而,有关ICD对宫颈癌辐射敏感性的影响仍不清楚。本研究结果显示,ICD能够明显抑制SiHa细胞的增殖,降低2、4、6、8 Gy X射线照射后SiHa细胞的存活分数,提高γ-H2AX蛋白的相对表达量,细胞的SER为1.12。这些结果表明,ICD对宫颈癌细胞表现出一定的抗增殖和辐射增敏的作用,与之前的研究结果[5]相符。
miRNA是一类小的非编码RNA,包含18~24个核苷酸,可与靶基因的3′非编码区特异性结合。有研究者报道,一些miRNA参与调节不同癌细胞的辐射反应,以增加其辐射敏感性[17]。例如:miR-15a-3p通过靶向肿瘤蛋白D52增加了宫颈癌细胞的辐射敏感性[18];miR-122-5p通过靶向细胞分裂周期蛋白25A提高了宫颈癌细胞的辐射敏感性[19]。MiR-129-5p已被证明是一种肿瘤抑制因子,具有抗癌活性[20-21]。研究结果显示,miR-129-5p通过抑制乳腺癌细胞的自噬和高迁移率族蛋白B1的表达来促进细胞凋亡,增强乳腺癌MCF-7细胞对紫杉醇的敏感性[22]。MiR-129-5p在宫颈癌中表达下调,可以抑制宫颈癌的发生发展,然而其在宫颈癌细胞耐辐射中的功能和具体分子机制尚不清楚。本研究结果显示,ICD明显提高了SiHa细胞中miR-129-5p的表达,这提示ICD增强宫颈癌细胞辐射敏感性的机制可能与miR-129-5p的表达有关。本研究结果还显示,高表达miR-129-5p能够明显提高SiHa细胞的增殖抑制率,降低2、4、6、8 Gy X射线照射的细胞的存活分数,降低cyclinD1蛋白的相对表达量,并提高γ-H2AX蛋白的相对表达量,细胞的SER为1.68,这表明miR-129-5p表达上调可以抑制宫颈癌细胞的增殖,这与之前的研究结果[7]一致。
PI3K/Akt信号通路在宫颈癌的辐射敏感性中发挥着关键作用[23]。黄涛[16]指出,ICD对子宫内膜癌细胞增殖和迁移的抑制作用,以及对细胞凋亡的促进作用是通过抑制PI3K/Akt信号通路的激活来实现的。Liu等[20]发现,miR-129-5p通过PI3K/Akt信号通路直接靶向同源异形盒转录因子6(PAX6),抑制视网膜母细胞瘤的细胞增殖、迁移、侵袭和肿瘤的生长,从而抑制视网膜母细胞瘤的进展。本研究结果显示,ICD能够明显降低p-PI3K、p-Akt蛋白的表达,低表达miR-129-5p可以反转ICD对SiHa细胞的增殖抑制作用、抑制PI3K/Akt信号通路活性的作用和增强细胞辐射敏感性的作用。以上结果表明,上调miR-129-5p表达并抑制PI3K/Akt信号通路活性可能是ICD抑制宫颈癌细胞增殖、增强其辐射敏感性的重要途径。
综上,本研究结果表明,ICD可以抑制宫颈癌SiHa细胞的增殖,并增强其辐射敏感性,具有一定的抗癌活性,其作用机制与上调miR-129-5p表达及抑制PI3K/Akt信号通路活性有关。本研究为临床提高宫颈癌患者放疗敏感性提供了有价值的靶点和治疗策略。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李俊菲负责方法的建立、论文的撰写;唐梅艳、陈欢负责现场的实验;徐丹负责论文的审阅。
异紫堇碱对宫颈癌SiHa细胞增殖和辐射敏感性的影响
Effects of isocorydine on the proliferation and radiosensitivity of cervical cancer SiHa cells
-
摘要:
目的 探讨异紫堇碱(ICD)对宫颈癌SiHa细胞增殖和辐射敏感性的影响及其作用机制。 方法 采用不同浓度(25、50、100、200 μmol/L)ICD处理宫颈癌SiHa细胞(简称ICD处理组),同时将正常培养未经ICD处理的SiHa细胞设为对照(NC)组。采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)实验检测细胞的增殖抑制率,细胞克隆形成实验检测ICD对细胞辐射敏感性的影响,Western blot检测磷酸化组蛋白H2AX(γ-H2AX)、磷酸化磷脂酰肌醇3-激酶(p-PI3K)和磷酸化蛋白激酶B(p-Akt)的相对表达量,实时荧光定量PCR(qRT-PCR)检测微小RNA-129-5p(miR-129-5p)的表达。在SiHa细胞中分别转染miR-NC和miR-129-5p,观察转染miR-129-5p对细胞增殖、辐射敏感性、细胞周期蛋白D1(cyclinD1)、γ-H2AX蛋白表达的影响。在SiHa细胞中分别转染anti-miR-NC和anti-miR-129-5p并使用ICD处理,分析其对ICD诱导的细胞增殖、辐射敏感性、PI3K/Akt信号通路的影响。2组间数据的比较采用独立样本t检验。 结果 MTT实验结果显示,与NC组SiHa细胞的增殖抑制率[(0.05±0.01)%]相比,25、50、100、200 μmol/L ICD处理组能够明显提高SiHa细胞的增殖抑制率[(10.26±1.03)%、(22.16±2.21)%、(44.09±4.41)%、(70.88±7.09)%],且差异均有统计学意义(t=29.736~30.013,均P<0.05)。细胞克隆形成实验、Western blot和qRT-PCR结果显示,与NC组相比,100 μmol/L ICD处理组能够明显提高SiHa细胞对不同剂量X射线的辐射敏感性(t=19.135~44.478,均P<0.05),提高γ-H2AX蛋白和miR-129-5p的相对表达量(t=15.041、19.682,均P<0.05),降低p-PI3K和p-Akt蛋白的相对表达量(t=14.897、15.429,均P<0.05)。与转染miR-NC组相比,转染(高表达)miR-129-5p组能够明显提高SiHa细胞的增殖抑制率[(75.06±7.51)%对(1.04±0.10)%,t=29.566,P<0.05]、对不同剂量X射线的辐射敏感性(t=13.239~37.015,均P<0.05)和γ-H2AX蛋白的相对表达量(t=17.076,P<0.05),能够降低cyclinD1蛋白的相对表达量(t=17.393,P<0.05)。与转染anti-miR-NC+ICD处理组相比,转染anti-miR-129-5p(低表达miR-129-5p)+ICD处理组可以反转ICD抑制SiHa细胞增殖、抑制PI3K/Akt信号通路的活性和增强细胞辐射敏感性的作用,且差异均有统计学意义(t=13.370~28.252,均P<0.05)。 结论 ICD能够通过上调miR-129-5p表达及抑制PI3K/Akt信号通路的活性来抑制宫颈癌SiHa细胞的增殖以及增强其辐射敏感性。 Abstract:Objective To investigate the effects of isocorydine (ICD) on the proliferation and radiosensitivity of cervical cancer SiHa cells and determine the underlying mechanism. Methods Different concentrations (25, 50, 100, and 200 μmol/L) of ICD were used to treat cervical cancer SiHa cells (ICD treatment group). Normal cultured SiHa cells without ICD treatment were set as the normal control (NC) group. The 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay was used to detect cell proliferation. Cell clone formation experiment was conducted to determine the radiation sensitization effect of ICD on cells. Western blot analysis was employed to detect phosphorylated histone H2AX (γ-H2AX), phosphorylated phosphatidylinositol 3-kinase (p-PI3K), and phosphorylated protein kinase B (p-Akt) expression. Real-time quantitative PCR (qRT-PCR) was used to detect the expression of microRNA-129-5p (miR-129-5p). SiHa cells were transfected with miR-NC and miR-129-5p, and the roles of transfection of miR-129-5p on cell proliferation, radiosensitivity, cyclinD1, and γ-H2AX protein expression were observed. Anti-miR-NC and anti-miR-129-5p were transfected into SiHa cells, which were then treated with ICD to evaluate the effects on ICD-induced cell proliferation, radiosensitivity, and PI3K/Akt signaling pathway. Data between two groups were compared by independent sample t test. Results The MTT assay showed that the 25, 50, 100, and 200 μmol/L ICD treatment groups exhibited significant increase in the proliferation inhibition rate ((10.26±1.03)%, (22.16±2.21)%, (44.09±4.41)%, (70.88±7.09)%) of SiHa cells compared with the NC group ((0.05±0.01)%), and the differences were statistically significant (t=29.736−30.013, all P<0.05). The cell clone formation, Western blot, and qRT-PCR analyses showed that the 100 μmol/L ICD treatment group had increased radiosensitivity to different doses of X-rays (t=19.135−44.478, all P<0.05), increased γ-H2AX protein expression (t=15.041, P<0.05) and miR-129-5p expression (t=19.682, P<0.05), and decreased expression of p-PI3K and p-Akt protein compared with the NC group (t=14.897, 15.429; both P<0.05). Transfected (highly expressed) miR-129-5p considerably increased the proliferation inhibition rate ((75.06±7.51)% vs. (1.04±0.10)%; t=29.566, P<0.05), radiosensitivity to different doses of X-rays (t=13.239−37.015, all P<0.05), and γ-H2AX protein expression (t=17.076, P<0.05) of SiHa cells and evidently decreased the expression of the cyclinD1 protein (t=17.393, P<0.05) compared with transfected miR-NC. The transfection of anti-miR-129-5p (low expression of miR-129-5p) reversed the inhibitory effect of ICD on SiHa cell proliferation and PI3K/Akt signaling pathway and reversed its ability to enhance cell radiosensitivity compared with the transfection of anti-miR-NC, and the differences were statistically significant (t=13.370−28.252, all P<0.05). Conclusion ICD inhibits the proliferation of cervical cancer SiHa cells and enhances radiosensitivity by up-regulating the expression of miR-129-5p and the PI3K/Akt signaling pathway. -
表 1 ICD联合X射线照射对宫颈癌SiHa细胞作用的单击 多靶模型的参数值
Table 1. Statistical results of single-click multi-target model of the effect of isocorydine combined with X-ray irradiation on cervical cancer SiHa cells
组别 D0(Gy) Dq(Gy) N SF2 k SER(D0比值) 对照组 2.305 2.488 2.943 0.799 0.434 - ICD处理组 2.058 0.562 0.761 0.304 0.486 1.12 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;ICD为异紫堇碱;-表示无此项数据 表 2 高表达miR-129-5p联合X射线照射对宫颈癌SiHa细 胞作用的单击多靶模型的参数值
Table 2. Statistical results of single-click multi-target model of the effects of miR-129-5p overexpression combined with X-ray irradiation on cervical cancer SiHa cells
组别 D0
(Gy)Dq
(Gy)N SF2 k SER
(D0比值)转染miR-NC组 2.329 2.275 2.655 0.769 0.429 - 转染miR-129-5p组 1.383 0.893 1.907 0.401 0.723 1.68 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;NC为对照;-表示无此项数据 表 3 低表达miR-129-5p联合X射线照射对ICD处理的宫颈癌SiHa细胞作用的单击多靶模型的参数值
Table 3. Statistical results of single-click multi-target model of the effect of miR-129-5p underexpression combined with X-ray irradiation on cervical cancer SiHa cells treated with isocorydine
组别 D0(Gy) Dq(Gy) N SF2 k SER(D0比值) 转染anti-miR-NC+ICD处理组 2.144 0.709 0.718 0.302 0.467 - 转染anti-miR-129-5p+ICD处理组 2.569 1.199 1.595 0.625 0.389 0.83 注:D0为平均致死剂量;Dq为准闭剂量;N为外推值;SF2为照射剂量为2 Gy时的细胞存活分数;k为细胞存活曲线的钝化常数;SER为放射增敏比;NC为对照;ICD为异紫堇碱;-表示无此项数据 -
[1] Bedell SL, Goldstein LS, Goldstein AR, et al. Cervical cancer screening: past, present, and future[J]. Sex Med Rev, 2020, 8(1): 28−37. DOI: 10.1016/j.sxmr.2019.09.005. [2] Wright JD, Chen L, Tergas AI, et al. Population-level trends in relative survival for cervical cancer[J]. Am J Obstet Gynecol, 2015, 213(5): 670. e1−670. e7. DOI: 10.1016/j.ajog.2015.07.012. [3] Zhang Y, Li P, Hu J, et al. Role and mechanism of miR-4778-3p and its targets NR2C2 and Med19 in cervical cancer radioresistance[J]. Biochem Biophys Res Commun, 2019, 508(1): 210−216. DOI: 10.1016/j.bbrc.2018.11.110. [4] Liu XQ, Tian H, Li H, et al. Derivate isocorydine (d-ICD) suppresses migration and invasion of hepatocellular carcinoma cell by downregulating ITGA1 expression[J/OL]. Int J Mol Sci, 2017, 18(3): 514[2020-04-19]. https://www.mdpi.com/1422-0067/18/3/514. DOI: 10.3390/ijms18030514. [5] 梁雪霏. 异紫堇碱在宫颈癌SiHa细胞中通过逆上皮间充质转化途径实现抗癌作用[D]. 兰州: 兰州大学, 2016.
Liang XF. Isocorydine controls cell differentiation through mesenchvmal-to-epithelial transition in SiHa cervical cancer cell[D]. Lanzhou: Lanzhou University, 2016.[6] Podralska M, Ciesielska S, Kluiver J, et al. Non-coding RNAs in cancer radiosensitivity: microRNAs and lncRNAs as regulators of radiation-induced signaling pathways[J]. Cancers (Basel), 2020, 12(6): 1662. DOI: 10.3390/cancers12061662. [7] Wang YF, Yang HY, Shi XQ, et al. Upregulation of microRNA-129-5p inhibits cell invasion, migration and tumor angiogenesis by inhibiting ZIC2 via downregulation of the Hedgehog signaling pathway in cervical cancer[J]. Cancer Biol Ther, 2018, 19(12): 1162−1173. DOI: 10.1080/15384047.2018.1491497. [8] Chiang KC, Lai CY, Chiou HL, et al. Timosaponin AⅢ inhibits metastasis of renal carcinoma cells through suppressing cathepsin C expression by AKT/miR-129-5p axis[J]. J Cell Physiol, 2019, 234(8): 13332−13341. DOI: 10.1002/jcp.28010. [9] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394−424. DOI: 10.3322/caac.21492. [10] Wu NYY, Zhang XY, Chu TY, et al. High methylation of ZNF582 in cervical adenocarcinoma affects radiosensitivity and prognosis[J]. Ann Transl Med, 2019, 7(14): 328. DOI: 10.21037/atm.2019.06.15. [11] Tornero-López AM, Guirado D. Radiobiological considerations in combining doses from external beam radiotherapy and brachytherapy for cervical cancer[J]. Rep Pract Oncol Radiother, 2018, 23(6): 562−573. DOI: 10.1016/j.rpor.2018.05.007. [12] Lin M, Ye MM, Zhou JH, et al. Recent advances on the molecular mechanism of cervical carcinogenesis based on systems biology technologies[J/OL]. Comput Struct Biotechnol J, 2019, 17: 241−250[2020-04-19]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC6389684. DOI: 10.1016/j.csbj.2019.02.001. [13] Fan L, Huang CX, Li J, et al. Long non-coding RNA urothelial cancer associated 1 regulates radioresistance via the hexokinase 2/glycolytic pathway in cervical cancer[J]. Int J Mol Med, 2018, 42(4): 2247−2259. DOI: 10.3892/ijmm.2018.3778. [14] Pan JX, Chen G, Li JJ, et al. Isocorydine suppresses doxorubicin-induced epithelial-mesenchymal transition via inhibition of ERK signaling pathways in hepatocellular carcinoma[J/OL]. Am J Cancer Res, 2018, 8(1): 154−164[2020-04-19]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5794729. [15] 黄涛, 关德凤, 杨永秀. 异紫堇碱对人子宫内膜腺癌细胞系-1B细胞增殖、凋亡及迁移的影响[J]. 兰州大学学报: 医学版, 2019, 45(2): 26−32. DOI: 10.13885/j.issn.1000-2812.2019.02.004.
Huang T, Guan DF, Yang YX. Effects of isocorydine on proliferation, apoptosis and migration of human endometrial adenocarcinoma cell-1B[J]. J Lanzhou Univ (Med Sci), 2019, 45(2): 26−32. DOI: 10.13885/j.issn.1000-2812.2019.02.004.[16] 黄涛. 异紫堇碱通过PI3K/AKT/NF-κB通路抑制子宫内膜癌细胞系HEC-1B细胞增殖、凋亡、迁移的分子机制[D]. 兰州: 兰州大学, 2019.
Huang T. Molecular mechanism of isocorydine inhibiting proliferation, apoptosis and migration of endometrial cancer cell line HEC-1B by PI3K/AKT/NF-κB pathway[D]. Lanzhou: Lanzhou University, 2019.[17] Wei YQ, Jiao XL, Zhang SY, et al. MiR-9-5p could promote angiogenesis and radiosensitivity in cervical cancer by targeting SOCS5[J]. Eur Rev Med Pharmacol Sci, 2019, 23(17): 7314−7326. DOI: 10.26355/eurrev_201909_18837. [18] Wu YQ, Huang J, Xu HZ, et al. Over-expression of miR-15a-3p enhances the radiosensitivity of cervical cancer by targeting tumor protein D52[J]. Biomed Pharmacother, 2018, 105: 1325−1334. DOI: 10.1016/j.biopha.2018.06.033. [19] Ding FN, Gao BH, Wu X, et al. miR-122-5p modulates the radiosensitivity of cervical cancer cells by regulating cell division cycle 25A (CDC25A)[J/OL]. FEBS Open Bio, 2019, 9(11): 1869−1879[2020-04-19]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC6823283. DOI: 10.1002/2211-5463.12730. [20] Liu Y, Liang GD, Wang H, et al. MicroRNA-129-5p suppresses proliferation, migration and invasion of retinoblastoma cells through PI3K/AKT signaling pathway by targeting PAX6[J]. Pathol Res Pract, 2019, 215(12): 152641. DOI: 10.1016/j.prp.2019.152641. [21] Wang Q, Yu JH. MiR-129-5p suppresses gastric cancer cell invasion and proliferation by inhibiting COL1A1[J]. Biochem Cell Biol, 2018, 96(1): 19−25. DOI: 10.1139/bcb-2016-0254. [22] Shi Y, Gong WH, Lu L, et al. Upregulation of miR-129-5p increases the sensitivity to Taxol through inhibiting HMGB1-mediated cell autophagy in breast cancer MCF-7 cells[J]. Braz J Med Biol Res, 2019, 52(11): e8657. DOI: 10.1590/1414-431X20198657. [23] Che YL, Li YZ, Zheng FF, et al. TRIP4 promotes tumor growth and metastasis and regulates radiosensitivity of cervical cancer by activating MAPK, PI3K/AKT, and hTERT signaling[J]. Cancer Lett, 2019, 452: 1−13. DOI: 10.1016/j.canlet.2019.03.017. -





 下载:
下载: