-
近年来,免疫检查点抑制性抗体在恶性肿瘤临床治疗试验中的作用已经得到认同[1]。但此类药物会引发一些不良反应,其中免疫相关不良反应以甲状腺功能(简称甲功)障碍比较多见,尤其是既往有甲状腺病史的患者更容易发生甲功紊乱。我们通过对2例恶性肿瘤患者经免疫治疗后甲状腺损伤机制、处理方式及患者预后等不同的情况展开分析,以期指导临床医师重视甲状腺显像,避免误诊及影响预后。
-
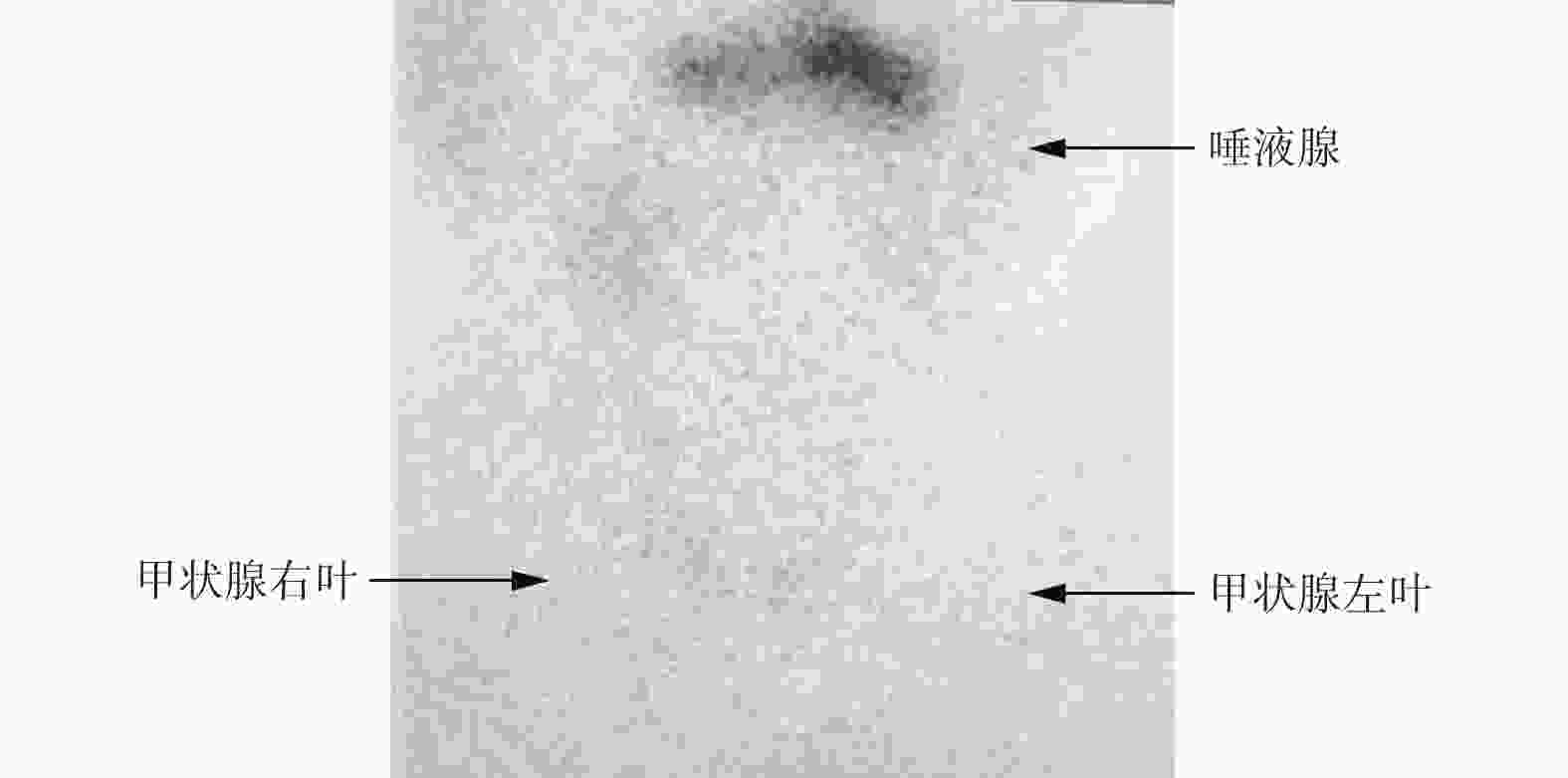
病例1为男性患者,81岁,既往有甲状腺功能亢进症(简称甲亢)病史,已停药20余年。2019年12月12日因膀胱肿瘤入院,术前1 d甲功测定仅血清TSH低于正常水平,甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPO-Ab)高于正常水平,T3、T4、游离三碘甲腺原氨酸(free thiiodothronine,FT3)、游离甲状腺素(free thyroxine,FT4)水平均在正常范围内。为进一步鉴别诊断自身免疫甲状腺炎与甲亢(Grave's 病),行甲状腺99TcmO4− SPECT显像,扫描结果提示甲状腺摄取弥漫性增高(图1),给予甲巯咪唑5 mg,口服,1次/d,术后组织病理学检查结果确诊为膀胱尿路上皮乳头状癌,侵及肌层。2020年1月2日首次行德瓦单抗免疫治疗,即程序性细胞死亡配体1(programmed cell death 1 ligand 1,PD-L1)抑制性抗体免疫治疗,次日甲功各项指标平稳(表1),患者继续口服甲巯咪唑,剂量仍为5 mg。2020年1月21日行第2次德瓦单抗免疫治疗,次日甲功各项指标略有波动(表1)。患者主诉偶有心慌,嘱其口服甲巯咪唑10 mg,1次/d。2020年2月9日行第3次德瓦单抗免疫治疗,次日甲功各项指标波动较前次明显(表1),患者主诉偶有心慌,嘱其口服甲巯咪唑10 mg,2次/d。2020年3月31日因局部复发行“经尿道膀胱肿瘤电切术”,术前甲功各项指标(除TPO-Ab)较前次改善(表1),患者无心慌、乏力等不适主诉,继续口服甲巯咪唑10 mg,每日2次。
图 1 膀胱尿路上皮乳头状癌患者(男性,81岁)免疫治疗前99TcmO4− SPECT甲状腺平面显像图 SPECT为单光子发射计算机体层摄影术
Figure 1. The imaging of thyroid 99TcmO4− SPECT scintigraphy before immunotherapy in patient with bladder urothelial papillary carcinoma (male, 81 years old)
日期 T3(nmol/L) T4(nmol/L) FT3(pmol/L) FT4(pmol/L) TSH(μIU/mL) TPO-Ab(IU/mL) 2020.1.3 1.53 76.00 5.33 19.05 0.01 30.45 2020.1.22 1.90 106.50 6.99 24.36 0.01 36.33 2020.2.10 4.27 231.50 15.20 50.21 0.02 73.17 2020.3.31 2.34 95.10 9.09 25.29 0.02 220.91 正常范围 0.98~2.83 54.10~157.50 3.20~6.50 10.70~23.40 0.35~5.50 0~9.00 注:T3为三碘甲腺原氨酸;T4为甲状腺素;FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;TSH为促甲状腺激素;TPO-Ab为甲状腺过氧化物酶抗体 表 1 81岁膀胱尿路上皮乳头状癌男性患者不同时间免疫治疗后甲状腺功能各项指标的水平
Table 1. Thyroid function indexes of 81 years old male patient with bladder urothelial papillary carcinoma after each immunotherapy
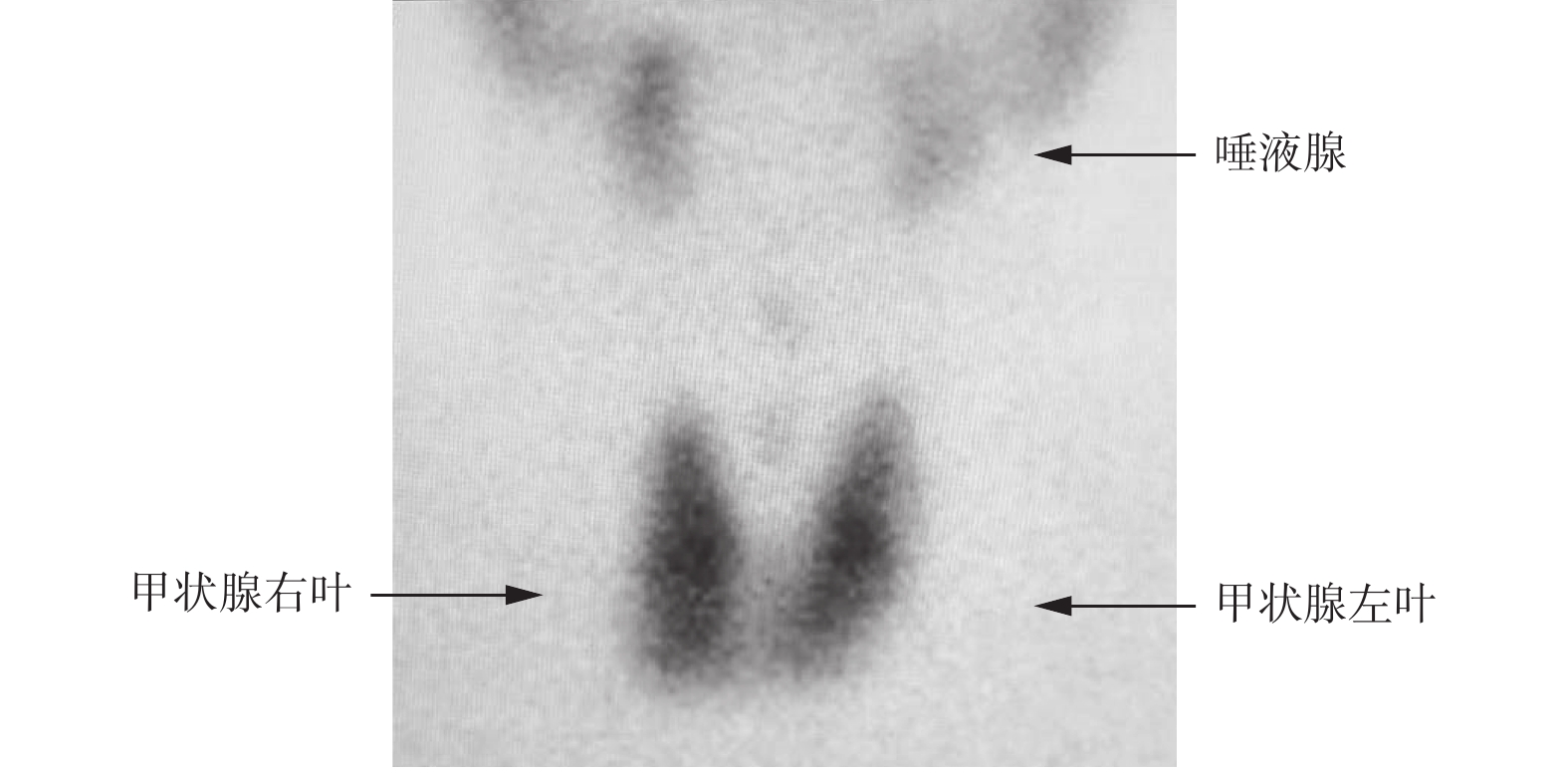
病例2为男性患者,64岁,因膀胱占位于2019年7月22日行手术治疗,术后组织病理学检查结果确诊为膀胱高级别乳头状尿路上皮癌,侵及肌层,分期为pT2NxMx。2019年8月13日入院行免疫治疗,治疗前甲功各项指标均处于正常范围内(表2),给予信迪利单抗(PD-1)免疫治疗,治疗后患者无明显不良反应。2019年9月2日入院行第2次免疫治疗,治疗前TSH水平低于正常范围,其余各项指标均正常(表2),继续给予信迪利单抗免疫治疗,治疗后患者无明显不适,出院。2019年9月23日入院行第3次免疫治疗,治疗前TSH水平低于正常范围,FT3和FT4水平高于正常范围值(表2),为进一步鉴别诊断自身免疫甲状腺炎与甲亢 ,行甲状腺99TcmO4− SPECT显像,结果显示甲状腺摄取呈弥漫性减低(图2),因患者偶有心慌,无其他不适主诉,为避免对免疫治疗造成影响,给予β受体阻滞剂对症治疗后,继续给予信迪利单抗免疫治疗,治疗后患者无明显不适,出院。2019年11月11日因疾病进展行“膀胱全切术+双侧盆腔淋巴结清扫术+全尿道切除术+回肠代膀胱术”。 2019年12月10日入院行第4次免疫治疗,治疗前TSH水平高于正常范围,其余指标均正常(表2),嘱患者口服优甲乐25 μg,1次/d,并继续给予信迪利单抗免疫治疗,治疗后患者无明显不适,出院。2020年1月6日入院行第5次免疫治疗,治疗前TSH水平高于正常范围,其余指标均在正常范围内(表2),嘱患者口服优甲乐37.5 μg,1次/d,并继续给予信迪利单抗免疫治疗,治疗后患者无明显不适,出院。2020年3月28日入院行第6次免疫治疗,治疗前TSH水平高于正常范围,伴FT4水平低于正常范围,其余指标均正常(表2),嘱患者口服优甲乐50 μg,1次/d,并继续给予信迪利单抗免疫治疗,治疗后患者无明显不适,出院。
日期 T3(nmol/L) T4(nmol/L) FT3(pmol/L) FT4(pmol/L) TSH(μIU/mL) TPO-Ab(μIU/mL) 2019.8.13 1.93 125.80 4.85 16.91 1.08 0.50 2019.9.2 1.86 98.40 5.89 16.37 0.34 0.47 2019.9.23 2.79 146.50 9.19 29.29 0.01 0.40 2019.12.10 1.56 59.80 3.69 12.50 21.33 0.48 2020.1.6 1.88 68.90 4.96 12.78 18.53 0.57 2020.3.28 2.56 64.90 5.24 6.73 34.01 0.41 正常范围 0.98~2.83 54.10~157.50 3.20~6.50 10.70~23.40 0.35~5.50 0~9.00 注:T3为三碘甲腺原氨酸;T4为甲状腺素;FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;TSH为促甲状腺激素;TPO-Ab为甲状腺过氧化物酶抗体 表 2 64岁膀胱高级别乳头状尿路上皮癌男性患者不同时间免疫治疗前甲状腺功能各项指标的水平
Table 2. Thyroid function indexes of a 64 years old male patient with high-grade papillary urothelial carcinoma of the bladder before each immunotherapy
-
免疫治疗并非直接针对肿瘤细胞,而是通过解除免疫系统的限制(PD-1抗体),或者解除肿瘤细胞的防御系统(PD-L1抗体),让身体的免疫系统来杀灭肿瘤细胞。近年来,PD-1及PD-L1的抑制性抗体在恶性肿瘤临床治疗试验中的作用已经得到认同[1]。但此类药物会引发一些不良反应,主要包括皮疹、乏力、食欲减低和免疫相关不良反应等[2],后者以甲功障碍多见,尤其是既往有甲状腺病史的患者更容易发生甲功紊乱,其中甲状腺功能减退症(简称甲减)更为常见,且多数患者在发生甲减之前均有短暂的亚临床甲减或一过性甲亢发生[3-5]。参照2016年版美国甲状腺协会指南[6],甲减为FT4水平降低、TSH水平高于正常范围;甲亢指FT4水平升高、TSH水平低于正常范围;亚临床甲亢或甲减则为TSH水平降低或升高,但FT4水平正常。本报告中的2例患者经免疫治疗后的首发表现均为TSH水平降低,FT3水平和FT4水平升高,而进行甲状腺99TcmO4− SPECT显像得到的结果却截然不同,选择的处理方式及患者预后也大相径庭。因此,我们认为,临床上遇到甲功各项指标水平升高时,一定要进行甲功显像,进一步鉴别诊断自身免疫甲状腺炎与 甲亢,指导后续治疗及预后评价。
病例1有甲亢病史,本次复发考虑为 PD-L1抑制剂诱发所致。PD-L1抑制剂诱发甲亢的概率约为3.1%[7]。2017 年欧洲临床肿瘤协会发表了《免疫治疗的毒性管理:ESMO临床诊断、治疗随访临床实践指南》[8]。该指南中提出发生甲亢,特别是有症状的患者需要使用 β 受体阻滞剂、抗甲状腺药物或类固醇激素治疗。本例患者经抗甲状腺药物治疗后甲功明显改善。
病例2无甲状腺相关病史,在行免疫治疗后出现自身免疫性甲状腺炎,为避免类固醇激素治疗影响免疫治疗的疗效,根据该领域首个多学科指南《免疫检查点抑制剂引起的内分泌急性并发症管理》[9],经患者同意,仅给予β受体阻滞剂对症治疗。随着免疫治疗对甲状腺刺激的逐渐增加,患者发展为亚临床甲减,进而发展为甲减,需长期使用甲状腺激素替代治疗。在既往的使用单药PD-1抗体治疗实体瘤的研究中,药物相关甲减的发生率为 5%~21%[3-4,10-11]。该患者甲功的变化过程与文献报道的一过性甲亢类似[3-5]。但我们认为,其甲功升高是自身免疫性甲状腺炎所致,并非甲亢,此时若行甲状腺99TcmO4− SPECT,有利于指导治疗及预后判断。
目前,关于 PD-1 和 PD-L1 抗体治疗引起甲功不良反应的机制尚不明确。有研究结果显示,发生甲功不良反应可能与免疫相关炎症性甲状腺炎有关。有研究者认为,大多数免疫检查点抑制剂(ICIs)引起的甲功障碍均较轻微,无需因此调整免疫检查点抑制剂用药[12]。本报告中的2例患者在治疗早期均表现为甲功各项指标升高,但行甲状腺99TcmO4− SPECT显像发现两者的发病机理不同,治疗方法及预后也不同,这是临床工作中需要注意的。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 董华负责方法的建立、论文的撰写;刘东海、李亚男负责数据的收集与整理;胡海龙负责临床资料撰写的指导;张遵城负责论文的审阅。
肿瘤免疫治疗致甲状腺功能异常的99TcmO4− SPECT显像分析及文献复习
Analysis of 99TcmO4− SPECT imaging and literature review of thyroid function elevation induced by tumor immunotherapy
-
摘要: 近年来,程序性细胞死亡受体1及其配体的抑制性抗体在恶性肿瘤临床治疗试验中的作用已经得到认同。但此类药物会引发一些不良反应,以甲状腺功能障碍为主的免疫相关不良反应越来越被重视。笔者报道了99TcmO4− SPECT显像在2例肿瘤免疫治疗后甲状腺功能异常患者中的应用。
-
关键词:
- 免疫疗法 /
- 单光子发射计算机体层摄影术 /
- 99m锝高锝酸盐 /
- 程序性细胞死亡受体1 /
- 程序性细胞死亡配体1 /
- 甲状腺功能亢进症 /
- 甲状腺功能减退症
Abstract: Recently, the role of inhibitory antibodies to programmed cell death 1 receptor and programmed cell death ligand 1 in clinical treatment trials of malignant tumors has been recognized. But such drugs can cause some adverse reactions, and the immune-related adverse events, especially thyroid dysfunction, are paid more and more attention. Application of 99TcmO4− SPECT imaging in 2 patients with elevated thyroid function after tumor immunotherapy was reported. -
表 1 81岁膀胱尿路上皮乳头状癌男性患者不同时间免疫治疗后甲状腺功能各项指标的水平
Table 1. Thyroid function indexes of 81 years old male patient with bladder urothelial papillary carcinoma after each immunotherapy
日期 T3(nmol/L) T4(nmol/L) FT3(pmol/L) FT4(pmol/L) TSH(μIU/mL) TPO-Ab(IU/mL) 2020.1.3 1.53 76.00 5.33 19.05 0.01 30.45 2020.1.22 1.90 106.50 6.99 24.36 0.01 36.33 2020.2.10 4.27 231.50 15.20 50.21 0.02 73.17 2020.3.31 2.34 95.10 9.09 25.29 0.02 220.91 正常范围 0.98~2.83 54.10~157.50 3.20~6.50 10.70~23.40 0.35~5.50 0~9.00 注:T3为三碘甲腺原氨酸;T4为甲状腺素;FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;TSH为促甲状腺激素;TPO-Ab为甲状腺过氧化物酶抗体 表 2 64岁膀胱高级别乳头状尿路上皮癌男性患者不同时间免疫治疗前甲状腺功能各项指标的水平
Table 2. Thyroid function indexes of a 64 years old male patient with high-grade papillary urothelial carcinoma of the bladder before each immunotherapy
日期 T3(nmol/L) T4(nmol/L) FT3(pmol/L) FT4(pmol/L) TSH(μIU/mL) TPO-Ab(μIU/mL) 2019.8.13 1.93 125.80 4.85 16.91 1.08 0.50 2019.9.2 1.86 98.40 5.89 16.37 0.34 0.47 2019.9.23 2.79 146.50 9.19 29.29 0.01 0.40 2019.12.10 1.56 59.80 3.69 12.50 21.33 0.48 2020.1.6 1.88 68.90 4.96 12.78 18.53 0.57 2020.3.28 2.56 64.90 5.24 6.73 34.01 0.41 正常范围 0.98~2.83 54.10~157.50 3.20~6.50 10.70~23.40 0.35~5.50 0~9.00 注:T3为三碘甲腺原氨酸;T4为甲状腺素;FT3为游离三碘甲腺原氨酸;FT4为游离甲状腺素;TSH为促甲状腺激素;TPO-Ab为甲状腺过氧化物酶抗体 -
[1] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252−264. DOI: 10.1038/nrc3239. [2] Boutros C, Tarhini A, Routier E, et al. Safety profiles of anti-CTLA-4 and anti-PD-1 antibodies alone and in combination[J]. Nat Rev Clin Oncol, 2016, 13(8): 473−486. DOI: 10.1038/nrclinonc.2016.58. [3] Osorio JC, Ni A, Chaft JE, et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer[J]. Ann Oncol, 2017, 28(3): 583−589. DOI: 10.1093/annonc/mdw640. [4] Delivanis DA, Gustafson MP, Bornschlegl S, et al. Pembrolizumab-induced thyroiditis: comprehensive clinical review and insights into underlying involved mechanisms[J]. J Clin Endocrinol Metab, 2017, 102(8): 2770−2780. DOI: 10.1210/jc.2017-00448. [5] Orlov S, Salari F, Kashat L, et al. Induction of painless thyroiditis in patients receiving programmed death 1 receptor immunotherapy for metastatic malignancies[J]. J Clin Endocrinol Metab, 2015, 100(5): 1738−1741. DOI: 10.1210/jc.2014-4560. [6] Ross DS, Burch HB, Cooper DS, et al. 2016 American Thyroid Association Guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis[J]. Thyroid, 2016, 26(10): 1343−1421. DOI: 10.1089/thy.2016.0229. [7] Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(2): 173−182. DOI: 10.1001/jamaoncol.2017.3064. [8] Haanen JBAG, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28(S4): Siv119−iv142. DOI: 10.1093/annonc/mdx225. [9] Higham CE, Olsson-Brown A, Carroll P, et al. Society for Endocrinology Endocrine Emergency Guidance: acute management of the endocrine complications of checkpoint inhibitor therapy[J/OL]. Endocr Connect, 2018, 7(7): G1−G7[2020-04-07]. https://ec.bioscientifica.com/view/journals/ec/7/7/EC-18-0068.xml. DOI: 10.1530/EC-18-0068. [10] Robert C, Schachter J, Long GV, et al. Pembrolizumab versus ipilimumab in advanced melanoma[J]. N Engl J Med, 2015, 372(26): 2521−2532. DOI: 10.1056/NEJMoa1503093. [11] Garon EB, Rizvi NA, Hui RN, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018−2028. DOI: 10.1056/NEJMoa1501824. [12] Chang LS, Barroso-Sousa R, Tolaney SM, et al. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints[J]. Endocr Rev, 2019, 40(1): 17−65. DOI: 10.1210/er.2018-00006. -





 下载:
下载: