-
脑出血(intracerebral hemorrhage, ICH)是临床常见病、多发病,具有发病率、病死率、致残率均高等特点,已成为威胁人类健康的主要疾病之一[1-3]。因此,进行ICH的早诊断、早治疗以及急慢性期病理生理改变的实验研究是非常重要的[4]。目前,大鼠是构建ICH动物模型最常用的动物之一,研究者常通过神经行为学评分,如神经损伤严重缺损评分、平衡木测试、水迷宫测试等方法判断大鼠的神经功能损伤程度,以间接评价大鼠ICH模型构建成功与否,以及评价后期相关干预实验。传统的神经功能损伤评分等方法因其具有间接性和不可避免的主观性,对评估大鼠ICH后神经功能损伤程度尚有一定局限性[5]。Micro-PET/CT能清晰、灵敏地显示脑血肿及其周围神经细胞的代谢情况,明确病变位置、范围和大小,为研究ICH的发病机制、病理转归、生理学改变甚至药物干预提供了有效手段。近年来,国内外已有一些学者利用micro-PET/CT研究ICH[6-7],但有关micro-PET/CT在验证ICH模型中的价值的研究少有报道。本研究应用18F-FDG micro-PET/CT动态观察大鼠ICH模型在不同出血时间点脑血肿体积的变化,直接评价大鼠ICH模型构建成功与否以及后期的恢复情况。
-
采用简单随机抽样法选取32只健康雄性成年SD大鼠[原泸州医学院现西南医科大学动物中心提供, 动物许可证号为SCXK(川)2013-17],清洁级Ⅱ级,2~3月龄,体重250~350 g,饲养于无特定病原体级动物房,室温控制在20~26℃,相对湿度控制在50%~60%。采用简单随机抽样法将大鼠分为假手术组4只,ICH模型组28只。ICH模型组建模成功后,按脑出血后时间点将大鼠分为7个组:6、24、48 h和3、5、7、14 d,每组4只。各组大鼠自由进食全价鼠饲料及清洁水,12 h/12 h明暗交替光照。
-
ICH模型组参照文献[8]的方法进行改进,常温下按照体重给予大鼠1%的戊巴比妥钠(60 mg/kg),腹腔内麻醉,直至浅感觉消失(用镊子夹尾或眼睑无反应),待呼吸平稳后,俯卧位固定头部于立体定位仪上,保持前囟和后囟在同一水平,头顶部剪毛、消毒,头皮正中切口10 mm,将5 μL微量进样器固定在定位仪上,以前囟为原点,定位进针(前囟前0.2 mm,头尾正中线右侧旁开3 mm),并做记号。取下微量进样器,用颅钻在记号处钻孔达硬脑膜表面。5 μL微量进样器抽取胶原酶Ⅳ(购自北京Solarbio科技有限公司)2 μL(0.125 U/μL),重新固定在头部立体定位仪上,沿着钻孔进针,并以颅骨外板为零点垂直进针6 mm。手动缓慢(0.5 μL/min)将胶原酶Ⅳ溶液注入右侧基底节区,留针10 min,缓慢退针(0.5 μL/min)。骨蜡封闭钻孔,缝合头皮,待大鼠苏醒后放回饲养笼。假手术组以0.9%生理盐水2 μL代替胶原酶Ⅳ,余操作同ICH模型组。
-
采用Zea-Longa 5级评分法[9-10] 分别对假手术组及7个ICH模型组(6、24、48 h和3、5、7、14 d)大鼠行神经功能损伤评分。0分:神经功能正常;1分:轻度神经功能缺损(提尾时左前肢屈曲);2分:中度神经功能缺损(行走时向左侧旋转);3分:重度神经功能缺损(向左侧倾斜);4分:无自发行走,意识减退。得分越高者说明神经功能受损越严重。
-
使用德国Siemens公司 Inveon 型micro-PET/CT仪,图像采集和图像分析采用IRW工作站配备的德国Siemens公司Inveon Acquisition Workplace及ASIPro VM软件和自购PMOD软件(平生医疗科技有限公司)。室温下按照体重给予假手术组和7个ICH模型组大鼠1%的戊巴比妥钠(60 mg/kg),腹腔内麻醉,麻醉良好后(浅感觉消失),尾静脉注射18F-FDG(由西南医科大学附属医院核医学科合成,放射化学纯度≥95%)(17.8±0.4) MBq,30 min后行micro-PET/CT显像,保证大鼠显像前均禁食禁水12 h以上。PET采集时间为10 min,同位素选择F-18,其余参数选择系统默认(电流500 μA,电压80 kV,获取时间600 s,轴向扫描长度127 mm,时间窗3438 ns);CT扫描参数选择系统默认(电流500 μA,电压80 kV,轴向扫描长度133 mm),数据重建采用滤波反投影法(FBP),其余重建参数选择系统默认(矩阵128×128,图片缩放1)。
-
对图像进行视觉分析和半定量分析。图像分析应用仪器自带ASIPro VM软件及PMOD软件。PET/CT融合图像显示显像剂分布稀疏或缺失为阳性(患侧与健侧脑摄取比值<0.5),根据血肿大小勾画每个层面的葡萄糖摄取减低或缺损区边缘,即ROI,利用micro-PET/CT自带的半自动体积测量工具计算ICH模型组大鼠各时间点的脑血肿体积。以上操作由2名核医学科副高及以上职称的医师完成。
-
7个ICH模型组大鼠在行18F-FDG micro-PET/CT显像后取脑,将脑组织放入中性甲醛液中固定,5~7 d后用专用刀片将脑组织沿针尖处切开,观察脑内血肿情况,并用数码相机对准血肿部位拍照。使用专用刀片手动将血肿切片(切片数为C),层厚约1mm,选择血肿最大层面测量的长径(A)和短径(B,与A垂直的长径),并利用多田公式(血肿体积=A×B×C/2)计算脑血肿体积。在利用多田公式计算脑血肿体积时,有效切片中的血肿面积不得小于血肿最大面积的25%,如果切片中血肿面积大于血肿最大面积的75%,则切片数计为1;如果切片中血肿面积为血肿最大面积的25%~75%,则计为0.5[11-12]。切片的制作及脑血肿体积的计算由2名本专业工作满2年以上的实验员完成,分别计算出脑血肿体积,再取平均值。最后对大鼠脑组织行常规苏木精-伊红染色。
-
应用SPSS17.0软件进行统计学分析。符合正态分布的计量资料以
$\bar{x}\pm s$ 表示。同一种方法的不同时间点计算所得的脑血肿体积的比较采用单因素方差分析;同一时间点18F-FDG micro-PET/CT勾画ROI法和多田公式计算所得的脑血肿体积的比较采用配对t检验。将2种方法所得的脑血肿体积行Pearson相关性分析。P<0.05为差异有统计学意义。 -
假手术组大鼠的神经功能损伤评分均为0分。ICH模型组大鼠在ICH模型构建完成、麻醉苏醒后均出现了明显的神经精神症状,表现为精神萎靡不振、食欲欠佳、运动缓慢、左侧肢体瘫痪、行走时向左侧内旋转甚至伴有全身震颤等。ICH后6、24、48 h和3、5、7、14 d,ICH模型组大鼠神经功能损伤评分分别为(2.21±0.30)、(3.51±0.66)、(2.83±0.20)分和(2.12±0.50)、(1.44±0.37)、(1.02±0.25)、(0.51±0.12)分,其中24 h的评分最高,之后随着时间的推移大鼠神经功能开始逐渐恢复。
-
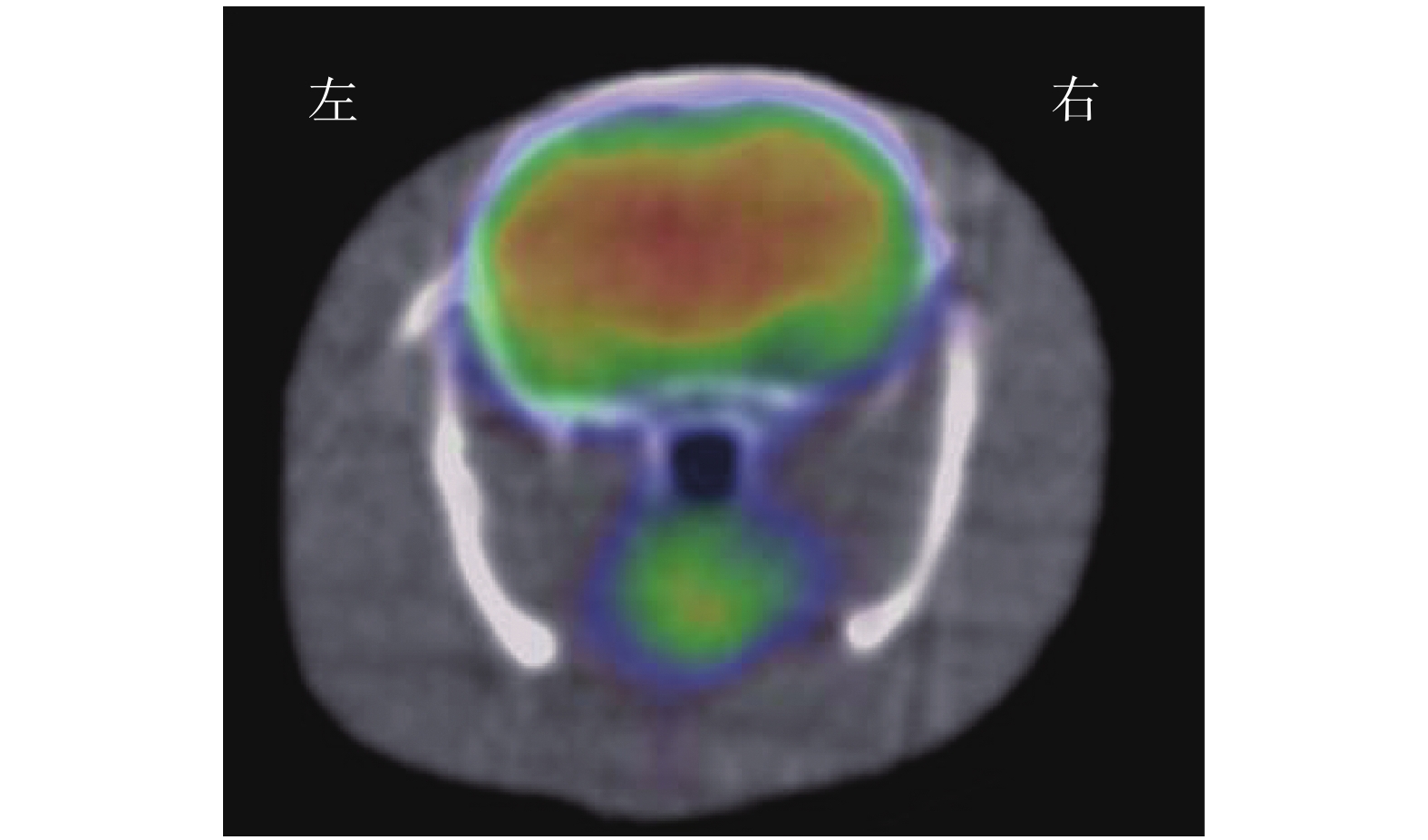
(1)视觉分析结果:18F-FDG micro-PET/CT显像示假手术组大鼠大脑的 18F-FDG分布均匀,典型图像见图1。ICH模型组大鼠各个时间点大脑右侧基底节区18F-FDG摄取均减低或缺损(即血肿部位)(图2A),且与大鼠解剖后脑组织血肿区域相对应(图2B)。(2)半定量分析结果:ICH模型组大鼠在ICH后各个时间点micro-PET/CT勾画ROI法测得的脑血肿体积的结果见表1,其中24 h脑血肿体积最大,之后随着出血时间的推移脑血肿体积开始逐渐缩小;24 h脑血肿体积与6、48 h脑血肿体积比较,差异无统计学意义(F=2.27,P>0.05),与3、5、7、14 d比较,差异有统计学意义(F=29.65,P<0.05)。
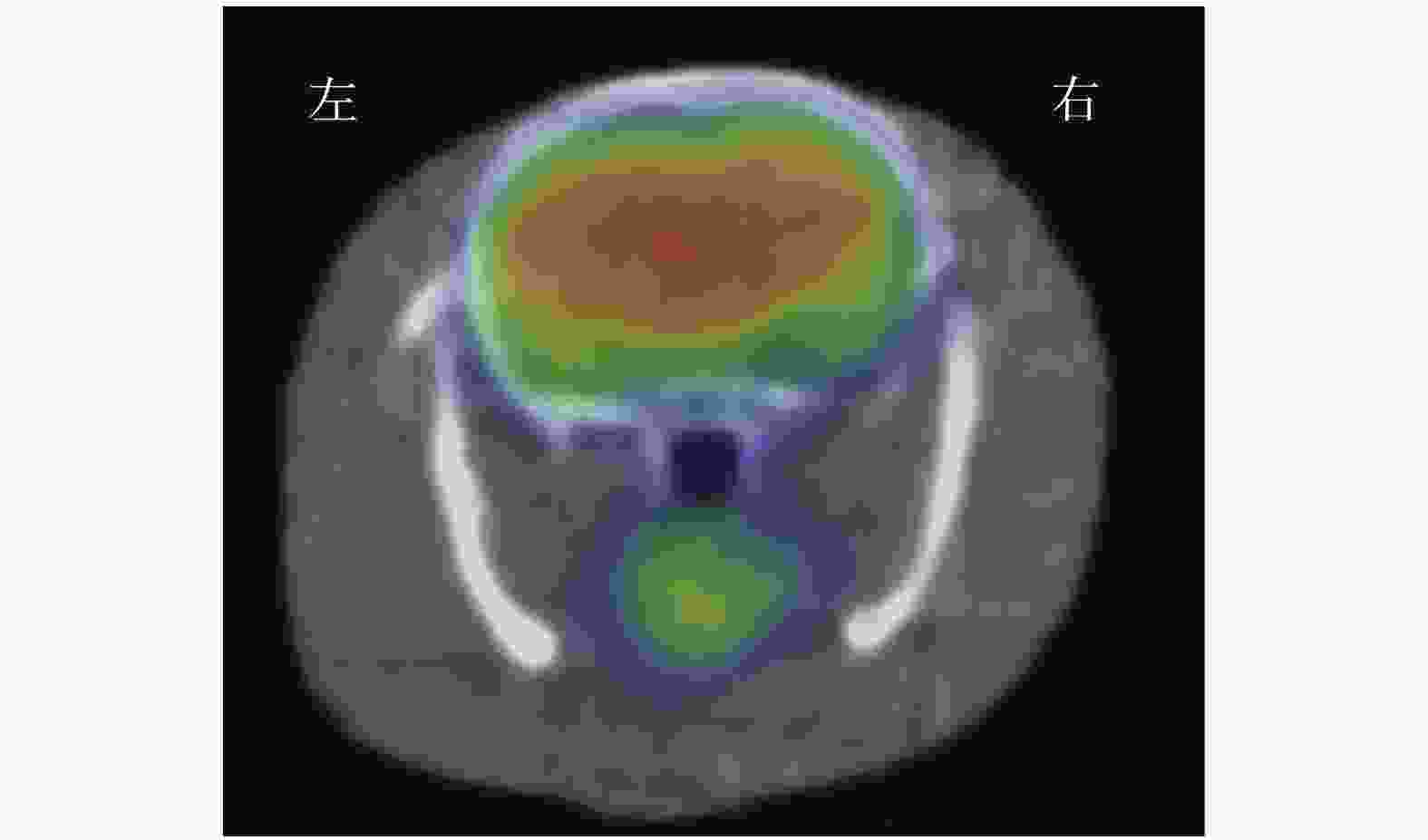
图 1 假手术组大鼠的18F-FDG micro-PET/CT横断位显像图 显示大鼠大脑18F-FDG分布均匀。假手术组为以0.9%生理盐水代替胶原酶Ⅳ构建的假脑出血模型。FDG为氟脱氧葡萄糖;PET/CT为正电子发射断层显像计算机体层摄影术
Figure 1. 18F-FDG micro-PET/CT transverse imaging of rats in the sham operation group
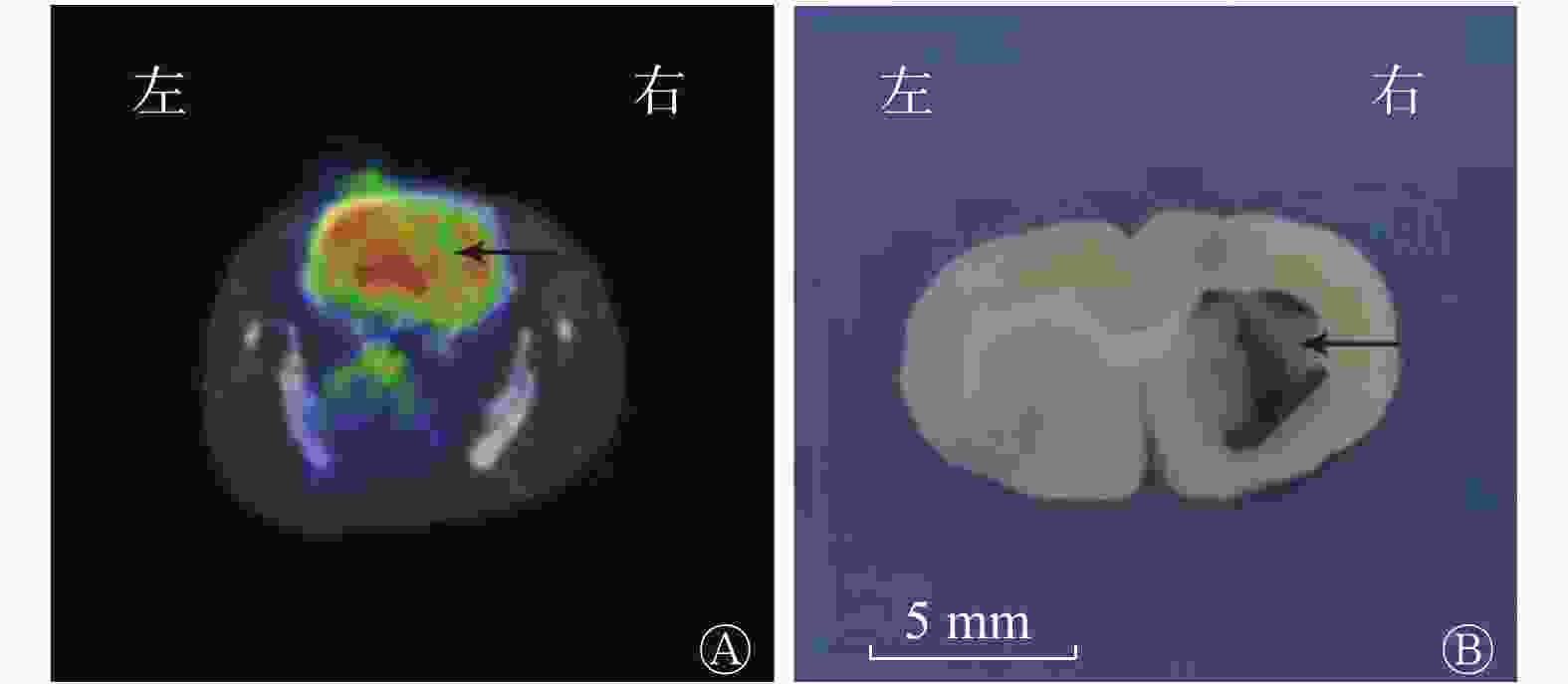
图 2 脑出血模型组大鼠18F-FDG micro-PET/CT横断位显像图(A)与脑血肿解剖图(B)
Figure 2. 18F-FDG micro-PET/CT transverse imaging (A) and cerebral hematoma anatomical topography (B) of rats in the intracerebral hemorrhage model group
方法 6 h 24 h 48 h 3 d 5 d 7 d 14 d micro-PET/CT
勾画ROI法24.05±3.00 27.19±1.25 25.58±1.57 21.94±0.98 19.88±1.53 18.35±2.11 16.29±1.53 多田公式 23.17±1.93 26.09±1.35 24.64±1.95 21.31±1.32 19.07±1.64 17.29±1.38 15.63±1.98 t 值 1.58 1.18 3.06 1.80 2.21 2.84 1.91 P值 0.21 0.32 0.06 0.17 0.11 0.07 0.15 注:PET/CT为正电子发射断层显像计算机体层摄影术;多田公式为A×B×C/2(A和B分别为血肿最大层面测量的长径和短径;C为血肿切片数) 表 1 2种方法测得的脑出血模型组大鼠在脑出血后不同时间点脑血肿体积的比较[(
$\bar{x}\pm s$ Table 1. Comparison of cerebral hematoma volume measured by two methods in rats in the intracerebral hemorrhage model group at different time points after intracerebral hemorrhage [(
$\bar{x}\pm s $ -
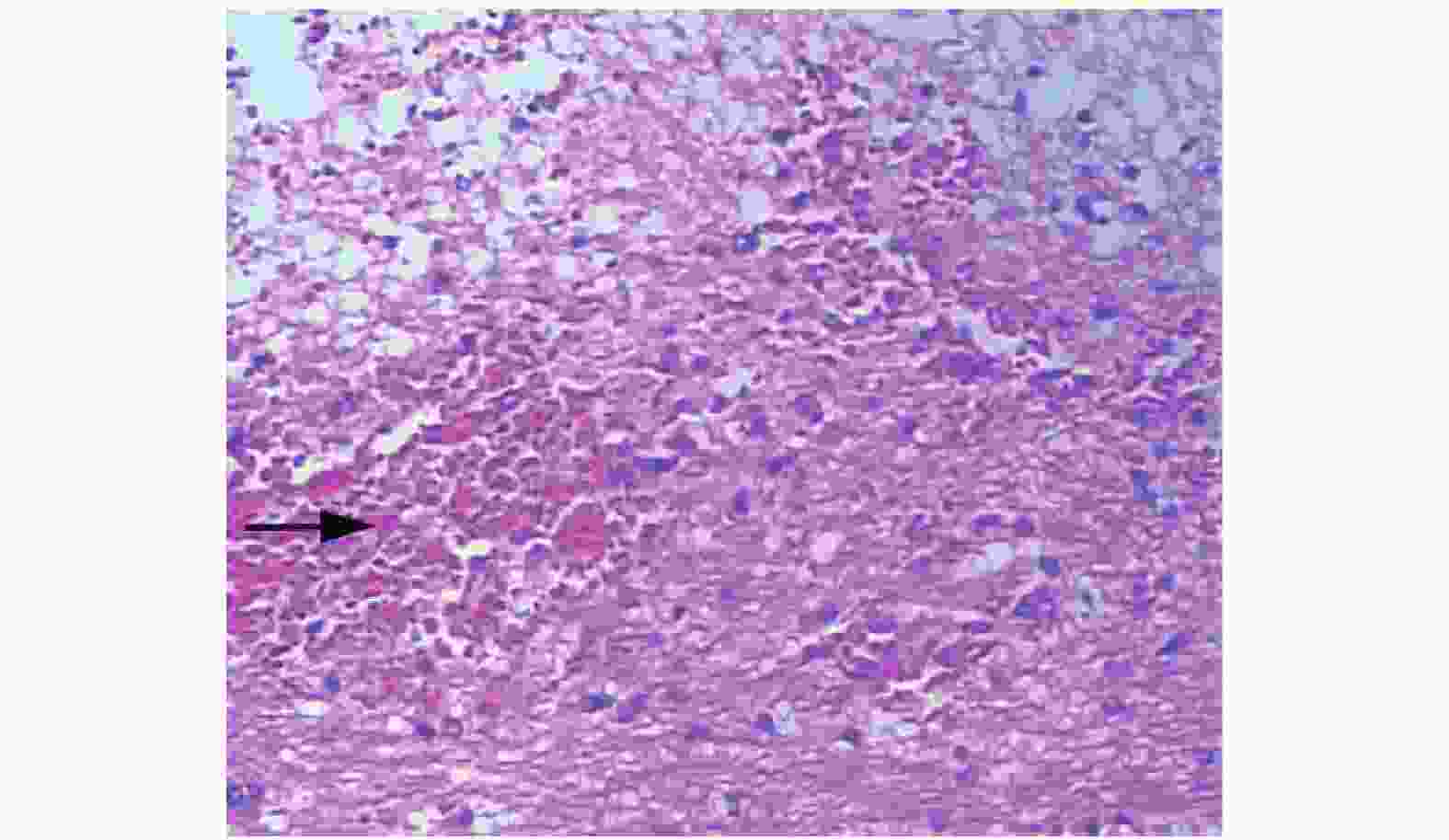
ICH模型组在各个时间点解剖后,大脑右侧基底节区均可见不规则的血肿形成,与18F-FDG micro-PET/CT显示的放射性稀疏及缺损区相对应。而且随着出血后时间的延长,脑血肿体积逐渐缩小。典型的大鼠脑血肿解剖图见图2B。图3示脑组织血肿内大量弥漫分布的红细胞。
-
Micro-PET/CT勾画ROI法和多田公式测得的ICH大鼠各个时间点的脑血肿体积的差异均无统计学意义(均P>0.05,表1);2种方法测得的脑血肿体积呈显著正相关(r=0.99,P<0.001)。
-
ICH已成为威胁人类健康及生活质量的重要事件之一。随着医学界对ICH组织学、病理生理学研究的深入,研究者们不但需要稳定的ICH动物模型, 同时还需要可靠的活体验证ICH模型的方法和手段, 以便得出可靠的数据和可信的结果。Micro-PET/CT是专门为研究人类疾病的小动物模型而设计的临床前影像设备,其能提供给研究者一个与人体相似的活体分子影像,解决模拟人体的活体实验问题,被誉为是生命的断层显像技术[13]。18F-FDG可通过血脑屏障被脑细胞摄取,其摄取量与该部位葡萄糖代谢水平息息相关。葡萄糖是脑内最主要的供能物质,其代谢水平与神经元的活动程度关系密切[14]。ICH后,病灶部位代谢水平与神经元的活动度降低,18F-FDG micro-PET/CT显像显示脑血肿表现为显像剂摄取稀疏甚至缺损,根据糖代谢水平的差异可以反映脑血肿的位置、大小和形状[6]。
本研究使用micro-PET/CT对大鼠ICH模型进行显像,克服了小动物影像学检查的难题,其扫描速度快,灵敏度和空间分辨率高(PET灵敏度>10%、空间分辨率1.4 mm;CT最大分辨率20 μm),后处理软件丰富。本研究结果表明,micro-PET/CT勾画ROI法与多田公式所得的ICH模型组各个时间点脑血肿体积的差异均无统计学意义;18F-FDG micro-PET/CT显示的放射性稀疏及缺损区与大鼠解剖后脑组织血肿区域相对应,这足以说明不同时间点的micro-PET/CT融合图像可以很好地显示脑血肿的位置、大小、形状。神经功能损伤评分示ICH模型组24 h的评分最高,之后随着时间的推移大鼠神经功能开始逐渐恢复,与18F-FDG micro-PET/CT显示的ICH情况大致相符,但是3 d后神经功能损伤评分已非常接近(均低于2分),其得分结果很容易受主观因素的影响,而18F-FDG micro-PET/CT显像通过客观数据显示,ICH模型组3 d后脑血肿的大小仍在不断地发展变化。由此可见,关于神经功能损伤的一些神经生物学评分对评价ICH后神经功能损伤程度甚至治疗干预后神经功能恢复情况尚有一定局限性,而18F-FDG micro-PET/CT显像则可长期动态观察活体大鼠ICH后脑血肿大小的演变情况。付怀栋等[15]的研究结果也表明,神经功能损伤评分用来判断ICH模型是否构建成功具有不确定性。Micro-PET/CT适合的对象为小型呲齿类动物(小鼠或大鼠),其不但能稳定、可靠地检测出ICH模型是否构建成功,而且能很好地显示脑血肿的位置、形状及大小,得出的结果直观、可靠,还可以进一步进行大鼠ICH药物治疗后脑血肿及周围脑组织功能代谢演变等方面的研究。且已有一些研究者应用PET或PET/CT评价ICH动物模型脑的糖代谢变化及药物干预后的疗效,均取得了很好的结果[7,16-17]。
综上所述,18F-FDG micro-PET/CT活体验证大鼠ICH后脑血肿的位置、形状、大小是可行可靠的,这也是众多研究者利用micro-PET/CT研究ICH的重要基础,与神经功能损伤评分相互补充,能更好地评估大鼠ICH后神经功能损伤程度及恢复后的改变情况,其可以作为大鼠ICH模型评价的新型手段,这也为临床18F-FDG PET/CT应用于ICH的诊断及指导治疗决策提供帮助。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 杨凡慧负责现场的实验、论文的撰写;杨朝鲜负责数据及图像的处理与分析;张春银负责方法的建立、论文的审阅。
18F-FDG micro-PET/CT 在活体大鼠脑出血模型中的诊断价值
Diagnostic value of 18F-FDG micro-PET/CT in rat models of intracerebral hemorrhage
-
摘要:
目的 评价18F-氟脱氧葡萄糖(FDG) micro-PET/CT 对活体大鼠脑出血(ICH)模型的诊断价值。 方法 采用简单随机抽样法选取32只健康雄性成年SD大鼠,其中28只在大鼠大脑右侧基底节区注射0.125 U/μL胶原酶Ⅳ构建大鼠ICH模型(ICH模型组),其余4只以0.9%生理盐水代替胶原酶Ⅳ构建假模型(假手术组)。采用简单随机抽样法将ICH模型组大鼠按脑出血后的时间分为7个组:6、24、48 h和3、5、7、14 d,每组4只。假手术组和7个ICH模型组均行神经功能损伤评分和18F-FDG micro-PET/CT显像,18F-FDG micro-PET/CT勾画感兴趣区(ROI)法和多田公式分别计算ICH模型组各时间点的脑血肿体积。大鼠显像后取脑,观察脑内血肿情况。同一时间点2种方法得出的脑血肿体积的比较采用配对t检验,并将2种方法得出的脑血肿体积行Pearson相关性分析。 结果 假手术组大鼠神经功能损伤评分均为0分;18F-FDG micro-PET/CT显像结果显示大鼠大脑18F-FDG分布均匀。ICH模型组大鼠在出血后6、24、48 h和3、5、7、14 d的神经功能损伤评分分别为(2.21±0.30)、(3.51±0.66)、(2.83±0.20)、(2.12±0.50)、(1.44±0.37)、(1.02±0.25)、(0.51±0.12)分;18F-FDG micro-PET/CT显像结果显示,在各个时间点大鼠大脑右侧基底节区均见18F-FDG摄取减低或缺损;18F-FDG micro-PET/CT勾画ROI法测得的脑血肿体积分别为(24.05±3.00)、(27.19±1.25)、(25.58±1.57)、(21.94±0.98)、(19.88±1.53)、(18.35±2.11)、(16.29±1.53) mm3;多田公式计算的脑血肿体积分别为(23.17±1.93)、(26.09±1.35)、(24.64±1.95)、(21.31±1.32)、(19.07±1.64)、(17.29±1.38)、(15.63±1.98) mm3。2种方法计算所得的ICH模型组大鼠在各个时间点的脑血肿体积间的差异均无统计学意义(t=1.18~3.06,均P>0.05)。2种方法所得的脑血肿体积呈显著正相关(r=0.99,P<0.001)。ICH模型组大鼠解剖后,大脑右侧基底节区均可见不规则血肿形成,与18F-FDG micro-PET/CT显示的放射性稀疏及缺损区相对应。 结论 18F-FDG micro-PET/CT能准确显示ICH后血肿的位置、形态及大小,其可以作为活体验证大鼠ICH模型构建成功与否的新型方法。 -
关键词:
- 脑出血 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18 /
- 大鼠 /
- 模型,动物
Abstract:Objective To assess the diagnostic value of 18F-fluorodeoxyglucose (FDG) micro-PET/CT in evaluating an intracerebral hemorrhage (ICH) model in rats in vivo. Methods A simple random sampling method was used to select 32 healthy male adult SD rats, 4 of which were placed in the sham operation group and 28 rats were injected with 0.125 U/µL collagenase Ⅳ into the right basal ganglia to induce ICH (ICH model group). In the sham operation group, 0.9% saline was used instead of collagenase Ⅳ to make the sham model. The ICH model group was divided into seven groups by simple random sampling according to the time after ICH, which were 6, 24, 48 h and 3, 5, 7, 14 d (4 rats in each group). The sham operation and seven ICH model groups (6, 24, 48 h and 3, 5, 7, 14 d) underwent the neurological impairment scoring and 18F-FDG micro-PET/CT imaging. The hematoma volume at each time point in the ICH model group was calculated according to 18F-FDG micro-PET/CT imaging to delineate the region of interest (ROI) and Tada's formula. After imaging, the head was decapitated and the brain was obtained for hematoma observation and histopathological examination. The hematoma volume obtained by the two methods at the same time was compared by paired t-test and evaluated by Pearson correlation analysis. Results In the sham operation group: the neurological impairment scores were zero; and micro-PET/CT clearly showed homogeneous 18F-FDG uptake in the brain tissue. The ICH model group: the neurological impairment scores were (2.21±0.30), (3.51±0.66), (2.83±0.20), (2.12±0.50), (1.44±0.37), (1.02±0.25) and (0.51±0.12) at 6, 24, 48 h and 3, 5, 7, 14 d after ICH, respectively. At each time point, the 18F-FDG uptake decreased or became defective in the right basal ganglia of the rat brain. The cerebral hematoma volumes evaluated by 18F-FDG micro-PET/CT were (24.05±3.00), (27.19±1.25), (25.58±1.57), (21.94±0.98), (19.88±1.53), (18.35±2.11) and (16.29±1.53) mm3, respectively. The cerebral hematoma volumes evaluated by Tada's formula were (23.17±1.93), (26.09±1.35), (24.64±1.95), (21.31±1.32), (19.07±1.64), (17.29±1.38), and (15.63±1.98) mm3, respectively. No significant difference in the hematoma volume was found between two methods at each time point in the ICH model group (t=1.18−3.06, all P>0.05). The cerebral hematoma volume obtained by the two methods was significantly positively correlated (r=0.99, P<0.001). After the dissection of the ICH model group, irregular hematoma formation was seen in the right basal ganglia of the brain tissue, which was opposite to the radioactive sparse and defective areas shown by 18F-FDG micro-PET/CT. Conclusion 18F-FDG micro-PET/CT can accurately display the position, shape and size of the hematoma after ICH, and thus can be to verify the success of the rat ICH model in vivo. -
表 1 2种方法测得的脑出血模型组大鼠在脑出血后不同时间点脑血肿体积的比较[(
$\bar{x}\pm s$ Table 1. Comparison of cerebral hematoma volume measured by two methods in rats in the intracerebral hemorrhage model group at different time points after intracerebral hemorrhage [(
$\bar{x}\pm s $ 方法 6 h 24 h 48 h 3 d 5 d 7 d 14 d micro-PET/CT
勾画ROI法24.05±3.00 27.19±1.25 25.58±1.57 21.94±0.98 19.88±1.53 18.35±2.11 16.29±1.53 多田公式 23.17±1.93 26.09±1.35 24.64±1.95 21.31±1.32 19.07±1.64 17.29±1.38 15.63±1.98 t 值 1.58 1.18 3.06 1.80 2.21 2.84 1.91 P值 0.21 0.32 0.06 0.17 0.11 0.07 0.15 注:PET/CT为正电子发射断层显像计算机体层摄影术;多田公式为A×B×C/2(A和B分别为血肿最大层面测量的长径和短径;C为血肿切片数) -
[1] Jolink WMT, Wiegertjes K, Rinkel GJE, et al. Location-specific risk factors for intracerebral hemorrhage: systematic review and meta-analysis[J]. Neurology, 2020, 95(13): e1807−e1818. DOI: 10.1212/WNL.0000000000010418. [2] Kim JY, Bae HJ. Spontaneous intracerebral hemorrhage: management[J]. J Stroke, 2017, 19(1): 28−39. DOI: 10.5853/jos.2016.01935. [3] Majidi S, Olan WJ, Sigounas D. Intensive reduction of systolic blood pressure in acute intracerebral hemorrhage: is there a benefit?[J]. World Neurosurg, 2017, 101: 742−743. DOI: 10.1016/j.wneu.2017.03.079. [4] Cao HJ, Liu T, Li PF , et al. Altered long noncoding RNA and messenger RNA expression in experimental intracerebral hemorrhage—a preliminary study[J]. Cell Physiol Biochem, 2018, 45(3): 1284−1301. DOI: 10.1159/000487464. [5] Xi GH, Strahle J, Hua Y, et al. Progress in translational research on intracerebral hemorrhage: is there an end in sight?[J]. Prog Neurobiol, 2014, 115: 45−63. DOI: 10.1016/j.pneurobio.2013.09.007. [6] 杨凡慧, 曹龄之, 黄晓红, 等. 姜黄素治疗大鼠脑出血后脑葡萄糖代谢变化的18F-FDG microPET/CT显像观察[J]. 中华核医学与分子影像杂志, 2017, 37(10): 627−631. DOI: 10.3760/cma.j.issn.2095-2848.2017.10.006.
Yang FH, Cao LZ, Huang XH, et al. Protective effect of curcumin on glucose metabolism evaluated by 18F-FDG microPET/CT in rat models of intracerebral hemorrhage[J]. Chin J Nucl Med Mol Imaging, 2017, 37(10): 627−631. DOI: 10.3760/cma.j.issn.2095-2848.2017.10.006.[7] Shang HB, Cui DR, Yang DH, et al. The radical scavenger edaravone improves neurologic function and perihematomal glucose metabolism after acute intracerebral hemorrhage[J]. J Stroke Cerebrovasc Dis, 2015, 24(1): 215−222. DOI: 10.1016/j.jstrokecerebrovasdis.2014.08.021. [8] Takamatsu Y, Tamakoshi K, Waseda Y, et al. Running exercise enhances motor functional recovery with inhibition of dendritic regression in the motor cortex after collagenase-induced intracerebral hemorrhage in rats[J]. Behav Brain Res, 2016, 300: 56−64. DOI: 10.1016/j.bbr.2015.12.003. [9] 王雄, 邬玉芹, 陈红, 等. ApoE基因敲除构建大鼠缺血性脑卒中模型的实验研究[J]. 中国实验诊断学, 2020, 24(8): 1302−1306. DOI: 10.3969/j.issn.1007-4287.2020.08.024.
Wang X, Wu YQ, Chen H, et al. Experimental study of apoE gene knockout in rats with ischemic stroke model[J]. Chin J Lab Diagn, 2020, 24(8): 1302−1306. DOI: 10.3969/j.issn.1007-4287.2020.08.024.[10] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84−91. DOI: 10.1161/01.str.20.1.84. [11] Delcourt C, Carcel C, Zheng D, et al. Comparison of ABC methods with computerized estimates of intracerebral hemorrhage volume: the INTERACT2 study[J]. Cerebrovasc Dis Extra, 2019, 9(3): 148−154. DOI: 10.1159/000504531. [12] 徐兴华, 陈晓雷, 张军, 等. 多田公式计算脑内血肿体积的准确性和可靠性[J]. 中国神经精神疾病杂志, 2015, 41(2): 87−91. DOI: 10.3936/j.issn.1002-0152.2015.02.005.
Xu XH, Chen XL, Zhang J, et al. Study on the accuracy and reliability of the ABC/2 formula for volume assessment of intracerebral hematoma[J]. Chin J Nerv Ment Dis, 2015, 41(2): 87−91. DOI: 10.3936/j.issn.1002-0152.2015.02.005.[13] 邝忠华, 李成, 李兰君, 等. 高分辨率及高灵敏度小动物PET研究进展[J]. 原子核物理评论, 2016, 33(3): 336−344. DOI: 10.11804/NuclPhysRev.33.03.336.
Kuang ZH, Li C, Li LJ, et al. Progress of small animal PET scanners with high spatial resolution and high sensitivity[J]. Nucl Phys Rev, 2016, 33(3): 336−344. DOI: 10.11804/NuclPhysRev.33.03.336.[14] López-Gambero AJ, Martínez F, Salazar K, et al. Brain glucose-sensing mechanism and energy homeostasis[J]. Mol Neurobiol, 2019, 56(2): 769−796. DOI: 10.1007/s12035-018-1099-4. [15] 付怀栋, 潘永进, 王秀彬, 等. 磁共振成像在大鼠脑出血模型制作中的初步应用研究[J]. 重庆医学, 2012, 41(16): 1607−1608, 1611. DOI: 10.3969/j.issn.1671-8348.2012.16.017.
Fu HD, Pan YJ, Wang XB, et al. Preliminary study of MR imaging in making intracerebral hemorrhage model of rats[J]. Chongqing Med, 2012, 41(16): 1607−1608, 1611. DOI: 10.3969/j.issn.1671-8348.2012.16.017.[16] Zhu Y, Deng L, Tang HJ, et al. Electroacupuncture improves neurobehavioral function and brain injury in rat model of intracerebral hemorrhage[J]. Brain Res Bull, 2017, 131: 123−132. DOI: 10.1016/j.brainresbull.2017.04.003. [17] Wang Y, An FF, Chan M, et al. 18F-positron-emitting/fluorescent labeled erythrocytes allow imaging of internal hemorrhage in a murine intracranial hemorrhage model[J]. J Cereb Blood Flow Metab, 2017, 37(3): 776−786. DOI: 10.1177/0271678X16682510. -





 下载:
下载: