-
肾上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma,EAML)是一种具有恶性倾向的间叶性肿瘤,在既往研究中,其上皮样细胞占比从5%~100%不等,且上皮样细胞占比越高,恶性倾向越明显[1-3]。2016年世界卫生组织泌尿系统和男性生殖器官肿瘤分类标准[4]中明确定义肾EAML中上皮样细胞占比应≥80%。笔者将EAML以外含上皮样成分的血管平滑肌脂肪瘤(angiomyolipoma,AML)称为类上皮样AML(尚未有文献明确指出如何命名)。目前,肾EAML术前影像学的准确诊断仍然存在困难,其常被误诊为其他类型的肾AML或肾透明细胞癌,部分患者因诊治不当出现复发和(或)远处转移[2]。本研究回顾性分析原病理诊断为肾EAML的患者资料,将所有病灶组织的标本重新切片、染色后镜下观察,并以此为基础,对比分析肾EAML和类上皮样AML的CT影像表现与上皮样细胞占比的关系,探讨肾EAML的CT影像特征和诊断要点,为临床诊治提供更可靠的CT影像信息。
-
收集2008年6月至2018年10月于南方医科大学顺德医院(佛山市顺德区第一人民医院)和佛山市第一人民医院就诊的22例肾EAML患者资料进行回顾性研究,其中男性4例、女性18例,中位年龄48.9(22~72)岁;15例行根治性肾切除术,7例行部分肾切除术。纳入标准:(1)术后病理诊断为肾EAML;(2)行CT增强检查后1~2周内进行手术。排除标准:(1)病理诊断为其他肾脏肿瘤;(2)临床或影像资料不完善。所有患者及家属均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
将22例患者的病灶组织(均来自术后标本)进行石蜡包埋,在南方医科大学顺德医院(佛山市顺德区第一人民医院)病理科重新进行4~5 mm切片和苏木精-伊红染色。由2位病理科主治医师在显微镜下独立观察,评估上皮样细胞、脂肪细胞和梭形平滑肌细胞的占比,并参照Brimo等[1]的定义,将上皮样细胞的核异型程度分为轻、中、重度。病理结果有异议时协商达成一致意见。按照2016版世界卫生组织泌尿系统和男性生殖器官肿瘤分类标准[4]将上皮样细胞占比≥80%的患者归入肾EAML组,将上皮样细胞占比<80%的患者归入类上皮样AML组。
-
所有患者术前均行多层螺旋CT平扫及三期增强扫描。10例患者采用荷兰Philips iCT 256层螺旋CT进行扫描(佛山市第一人民医院),扫描参数:管电压120 kV、管电流128 mA、螺距1、视野350 mm×350 mm、矩阵512×512、图像重建厚度为5 mm。12例患者采用德国Siemens Sensation 128层CT进行扫描(南方医科大学顺德医院),扫描参数:管电压120 kV、管电流211 mA、螺距0.6、视野364 mm×364 mm、矩阵512×512、图像重建厚度为5 mm。扫描范围自膈顶至肾脏下极。CT平扫后行增强扫描,经肘正中静脉留置针高压注射300 mgI/mL碘普罗胺(拜耳医药保健有限公司广州分公司)或碘佛醇注射液(江苏恒瑞医药股份有限公司),剂量为80~100 mL,流速为3~4 mL/s,30 s后行皮质期扫描,60~90 s后行髓质期扫描,2 min后行延迟扫描获得肾盂肾盏期早期图像。
-
由2位具有腹部放射学诊断工作15年以上经验的副主任医师共同阅片,对CT征象进行定性和定量分析,并协商达成一致意见。定性分析:(1)观察病灶形态,有无坏死液化、出血、肿瘤内脂肪、粗大血管等;(2)病灶强化模式以皮质期病灶实体部分的强化CT值为基准,通过髓质期病灶CT值的升降范围定义病灶强化模式[5],即≥20 HU为“快进快出”强化,≤−20 HU为“渐进强化”,−19~19 HU为“快进慢出”强化。定量分析:(1)肿瘤长径为横断面或冠状面上测得的肿瘤最大径;(2)CT值测量是在相同层面平扫、增强皮质期和髓质期分别勾画大小为0.5~1.0 cm2的ROI,分3次测量肿瘤实质部分(避开出血和坏死液化区)和邻近正常肾皮质的CT值并分别计算平均值。计算皮质期和髓质期强化比值:皮质期强化比值=肿瘤实性成分CT值/正常肾皮质皮质期CT值,髓质期强化比值=肿瘤实性成分CT值/正常肾皮质髓质期CT值,用皮质期强化比值反映皮质期的强化程度[6]。将皮质期强化比值≤0.73定义为强化较轻微,皮质期强化比值>0.73定义为强化较明显。计算差异有统计学意义的CT影像诊断的灵敏度、特异度、AUC、阳性预测值、阴性预测值和Youden指数(特异度+灵敏度−1)。
-
采用SPSS 20.0软件进行统计学分析。符合正态分布的计量资料以
$\bar x $ ±s表示,2组间的比较采用独立样本t检验(方差齐);不符合正态分布的计量资料用M(P25,P75)表示,2组间的比较采用Mann-Whitney U检验。计数资料的组间比较采用Fisher's确切概率法。P<0.05为差异有统计学意义。 -
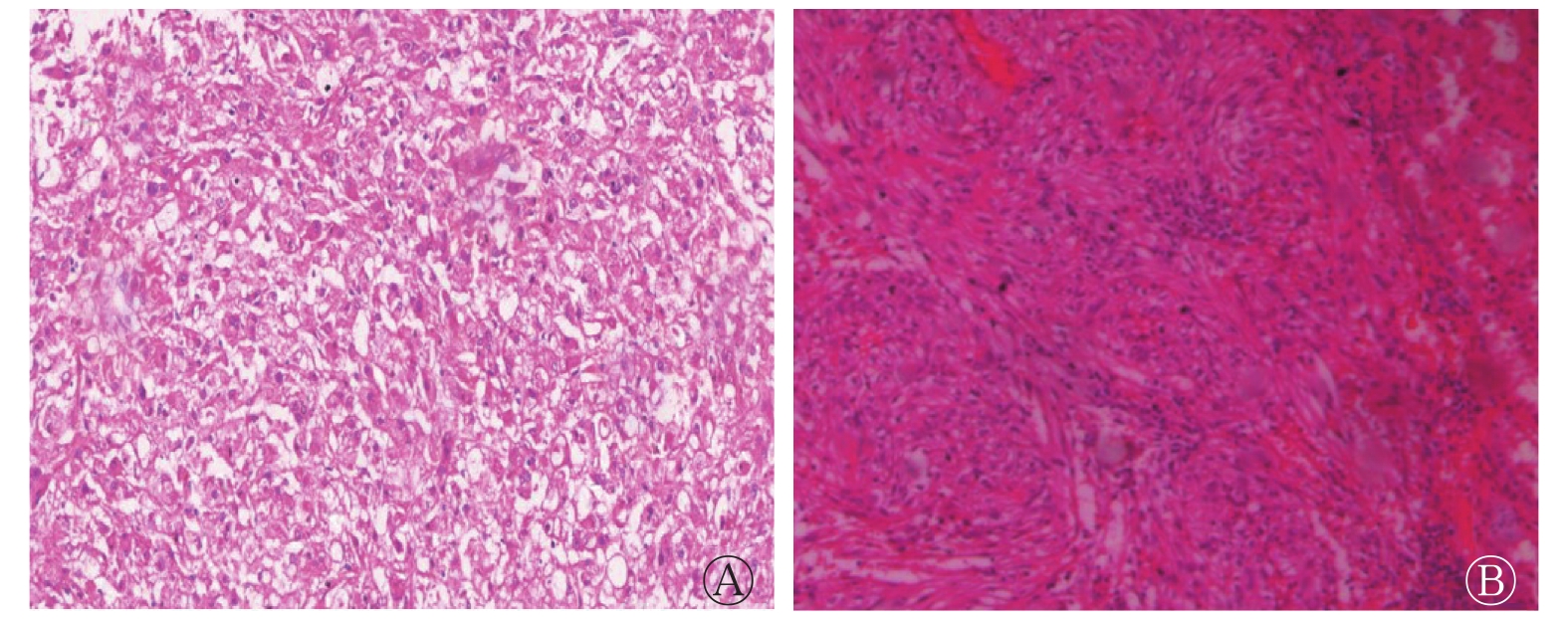
镜下肿瘤组织主要见不同占比的血管、梭形平滑肌细胞、脂肪细胞、上皮样细胞。根据上皮样细胞占载玻片总面积的百分比不同分为以下2组。(1)肾EAML组:上皮样细胞占80%~100%,均数为86.7%,细胞呈圆形或多边形,呈巢状、片状排列,部分核不规则,具有核异型性,梭形平滑肌细胞和脂肪细胞占比较少(图1中A);(2)类上皮样AML组:上皮样细胞占5%~50%,均数为23.6%,其他多为梭形平滑肌细胞和脂肪细胞(图1中B)。由表1可知,肾EAML组上皮样细胞占比明显高于类上皮样AML组,且肾EAML组上皮样细胞核异型程度高于类上皮样AML组。
图 1 肾EAML患者(女性,38岁)左肾(A)和类上皮样AML患者(男性,59岁)右肾(B)的病理图
Figure 1. Pathological pictures of left kidney of a patient(female,38 years old)with renal epithelioid angiomyolipoma and right kidney of a patient(male,59 years old)with epithelioid-like angiomyolipoma
组别 脂肪细胞占比(%) 梭形平滑肌细胞占比(%) 上皮样细胞占比(%) 上皮样细胞核异型程度(例) 轻 中 重 肾EAML组(n=15) 2.9 10.4 86.7 3 9 3 类上皮样AML组(n=7) 25.7 50.7 23.6 4 3 0 注:表中,EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤 表 1 2组患者病理学表现的比较
Table 1. Comparison of pathological findings in two groups of patients
肾EAML组患者共15例,均为单发病灶,其中男性2例、女性13例,中位年龄41(22~72)岁,5例因体检发现,9例因腰痛就诊,1例因腰痛伴血尿就诊。类上皮样AML组患者共7例,均为单发病灶,其中男性2例、女性5例,中位年龄42(37~64)岁,4例因体检入院,3例因肿瘤破裂出血急诊入院。
-
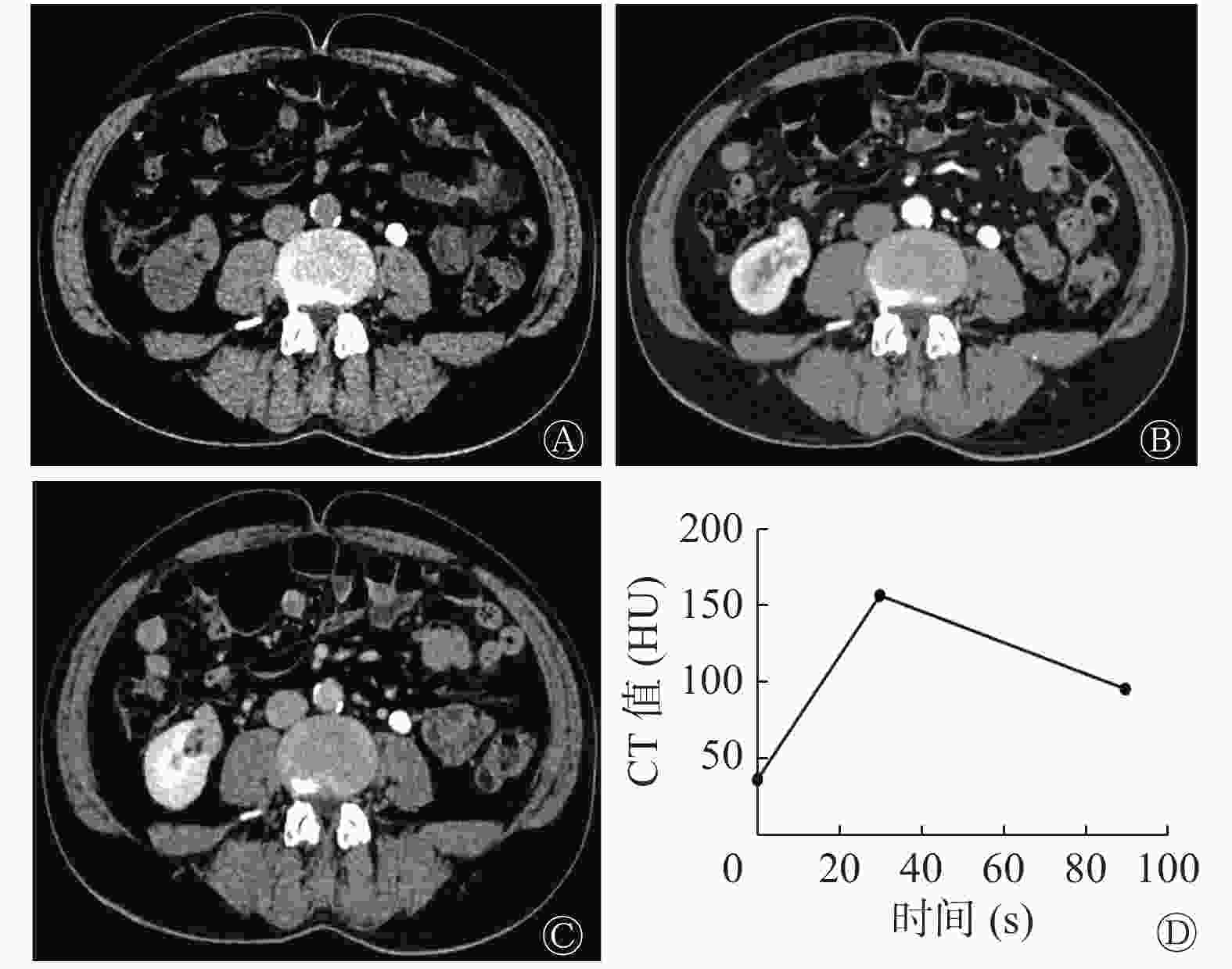
肾EAML患者左肾CT图像见图2,肾EAML患者的肿瘤大,无脂肪(图2中A),有坏死液化(图2中B~C),皮质期强化较轻微(图2中B),呈“快进慢出”的强化模式(图2中D)。右肾类上皮样AML患者CT图像见图3,类上皮样AML患者的肿瘤小,有脂肪(图3中A),无坏死液化(图3中B~C),皮质期强化较明显(图3中B),呈“快进快出”的强化模式(图3中D)。由表2可知,2组间肿瘤长径、坏死液化、肿瘤内脂肪和强化模式的差异有统计学意义(均P<0.05)。2组间不同病灶形态,不同CT平扫密度,有无出血和粗大血管的差异无统计学意义(均P>0.05)。
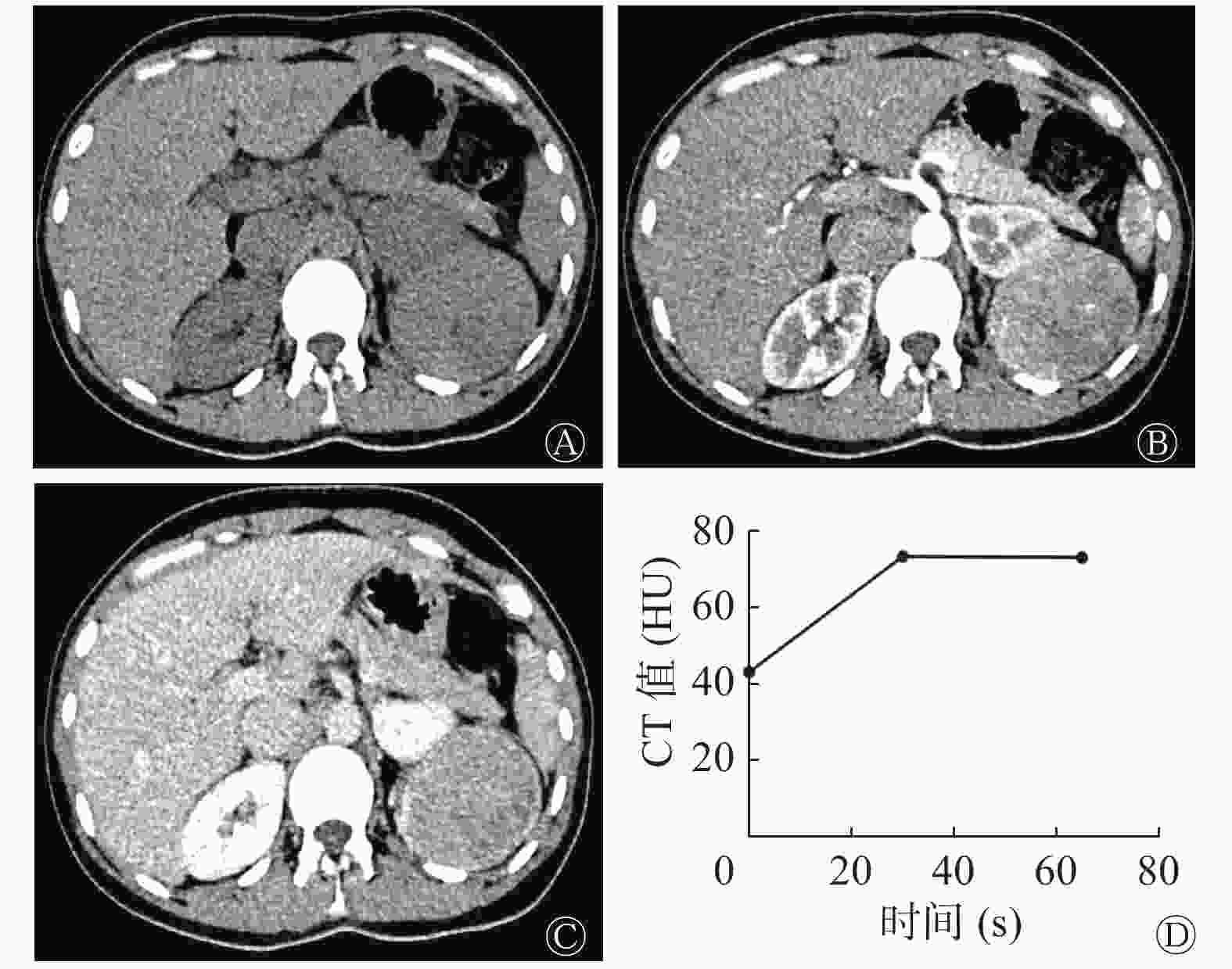
图 2 肾EAML患者(女性,38岁)左肾CT图
Figure 2. CT images of left kidney of a patient(female,38 years old)with renal epithelioid angiomyolipoma
CT征象 肾EAML组
(n=15)类上皮样
AML组(n=7)检验值 P值 肿瘤长径(cm) 8.40±4.26 4.90±1.84 t=2.66 0.015 病灶形态[例(%)] − 0.343 不规则形 4(26.7%) 4(57.1%) 类圆形 11(73.3%) 3(42.9%) CT平扫密度[例(%)] − 1.000 等或稍高密度 15(100.0%) 7(100.0%) 低或稍低密度 0(0) 0(0) 坏死液化[例(%)] − 0.020 有 11(73.3%) 1(14.3%) 无 4(26.7%) 6(85.7%) 出血[例(%)] − 0.343 有 4(26.7%) 4(57.1%) 无 11(73.3%) 3(42.9%) 肿瘤内脂肪[例(%)] − 0.002 有 2(13.3%) 6(85.7%) 无 13(86.7%) 1(14.3%) 强化模式[例(%)] − 0.017 快进快出 3(20.0%) 6(85.7%) 快进慢出 11(73.3%) 1(14.3%) 渐进强化 1(6.7%) 0(0) 粗大血管[例(%)] − 1.000 有 12(80.0%) 6(85.7%) 无 3(20.0%) 1(14.3%) 注:表中,CT:计算机体层摄影术;EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤;−:Fisher's确切概率法,无检验值 表 2 2组患者CT征象的比较
Table 2. Comparison of CT findings in two groups of patients
-
由表3可知,2组间肿瘤平扫CT值、增强皮质期及髓质期的CT值、髓质期强化比值的差异均无统计学意义(均P>0.05),而皮质期强化比值的差异有统计学意义(Z=−3.56,P<0.001)。
组别 CT值( $\bar x \pm s$ 

强化比值[M(P25,P75)] 平扫 增强皮质期 增强髓质期 皮质期 髓质期 肾EAML(n=15) 46.3±4.19 106.3±38.06 93.8±29.33 0.61(0.56,0.67) 0.52(0.43,0.55) 类上皮样AML(n=7) 43.3±3.20 119.0±16.97 82.1±11.39 0.96(0.92,0.97) 0.53(0.52,0.54) 检验值 t=1.70 t=−1.08 t=1.01 Z=−3.56 Z=−0.89 P值 0.105 0.293 0.327 <0.001 0.394 注:表中,CT:计算机体层摄影术;EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤 表 3 2组患者各期CT值及强化比值的比较
Table 3. Comparison of CT value and enhancement ratio of two groups of patients
-
由表4可知,皮质期强化比值≤0.73时肾EAML的诊断效能最高[AUC=0.981(0.813~1.000),Youden=0.87];Youden指数由高到低依次为肿瘤内无脂肪、“快进慢出”强化模式、有坏死液化、肿瘤长径>8 cm。
CT征象 灵敏度(%) 特异度(%) AUC(95%CI) 阳性预测值(%) 阴性预测值(%) Youden指数 临界值及标准 肿瘤长径 46.7 100.0 0.738(0.509~0.900) 100.0 46.7 0.47 >8 cm 坏死液化 73.3 85.7 0.795(0.571~0.935) 91.7 60.0 0.59 有 肿瘤内脂肪 86.7 85.7 0.862(0.649~0.970) 92.9 75.0 0.72 无 强化模式 80.0 85.7 0.833(0.615~0.956) 92.3 66.7 0.66 快进慢出 皮质期强化比值 86.7 100.0 0.981(0.813~1.000) 100.0 77.8 0.87 ≤0.73 注:表中,EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤;CT:计算机体层摄影术;AUC:曲线下面积;CI:可变区间 表 4 22例肾EAML与7例类上皮样AML患者CT征象诊断效能的比较
Table 4. Comparison of the diagnostic efficacy of CT findings in 22 patients with renal epithelioid angiomyolipoma and 7 patients with epithelioid-like angiomyolipoma
-
血管周围上皮样细胞瘤(PEComa)是由独特的上皮样或梭形细胞组成的间叶性肿瘤,对平滑肌和黑色素细胞标志物都具有免疫反应性[7]。它具有多分化潜能,可分化为常见的AML,也可分化为接近单一上皮样结构的肾EAML,两者关系密切。肾EAML可以是AML的一部分,也可以是单个肿瘤成分[8]。镜下观察AML中的上皮样细胞成分时,应注意上皮样细胞所占比例和上皮样细胞的核异型性,其占比可以从5%~100%不等。当上皮样细胞占比≥80%,且具有明显核异型性时,应定义为具有恶性生物学行为的肾EAML[4]。Brimo等[1]认为,如果AML中的上皮样细胞没有明显核异型性,则其仍具有良性生物学行为。故笔者将肾EAML以外含上皮样成分的AML称为“类上皮样AML”。根据肾EAML与类上皮样AML肿瘤内上皮样细胞占比的差异等不同的病理学特征及其生物学行为的潜在差异,笔者推测其CT影像表现也可能存在一定的差异,如对其加以研究分析,可能有助于提高肾EAML术前CT诊断的准确率。
本研究中患者的肾EAML多数较大,与既往研究结果基本一致[9-10]。Nese等[2]把肿瘤大小作为评估肾EAML恶性潜能高低的重要指标之一,并认为肾EAML肿瘤长径>7 cm提示预后不良。本研究结果提示,以肿瘤长径>8 cm为临界值诊断肾EAML的准确率较高,这可能与肾EAML中上皮样细胞的核异型程度高、细胞增殖活跃等密切相关。而肿瘤细胞增殖活跃,内部血供不足时[11],容易导致肿瘤坏死液化,这是CT影像上肿瘤密度不均的主要原因,也是诊断肾EAML的重要征象。本研究中肾EAML坏死液化率达73.3%(11/15),既往研究将坏死液化列为评估肾EAML恶性潜能高低的重要指标之一[2-3, 12]。
肾EAML主要的病理学特征是其上皮样细胞构成,肿瘤内几乎不含脂肪[13]。本研究中15例肾EAML患者病理切片的镜下观察结果表明,其脂肪细胞占比均数为2.9%,这与Lei等[3]认为的肾EAML肿瘤的脂肪细胞占比应<5%的观点相似。本研究中,13例肾EAML患者的CT图像(86.7%)无肉眼可见的脂肪征象,仅2例(13.3%)隐约可见脂肪征象。7例类上皮样AML患者肿瘤脂肪含量较多,镜下观察结果显示,其平均脂肪细胞占比为25.7%,6例患者的CT图像(85.7%)有肉眼可见的脂肪征象。因此CT图像无明确脂肪征象是诊断肾EAML的另一重要依据,且其Youden指数高于肿瘤长径和坏死液化征象。此外,既往有文献报道MRI显像上的出血征象是肾EAML的诊断依据之一[11]。但本研究中的患者均行CT扫描,其对于瘤内微小出血的检出不及MRI,在样本量不大的情况下,肾EAML与类上皮样AML患者比较的差异无统计学意义,因此未将其纳入诊断效能的分析。从病理学角度看,肾EAML和类上皮样AML的组织来源相同,其镜下观察均有缺乏弹力纤维的厚壁血管且都有出血倾向,但肾EAML是否更容易出血还有待进一步的研究。
肾EAML患者与类上皮样AML患者的增强CT扫描均有不同程度的强化。为了更好地反映2组间强化程度的差异,同时排除对比剂流速、心脏功能及肾动脉异常对肿瘤和肾实质强化的影响,本研究采用皮质期CT强化比值定量反映皮质期的强化程度[6],结果表明,2组间强化程度的差异有统计学意义。本研究结果显示,多数肾EAML皮质期强化比值≤0.73,强化较轻微,其诊断效能最高,具有重要特征性。此外,肾EAML主要表现为“快进慢出”的强化模式,与类上皮样AML“快进快出”的强化模式明显不同,这与Cui等[9]的研究结果相似。我们推测,肾EAML的这些强化特点,可能与其包膜完整、上皮样细胞排列密集、间质相对较少、血管壁弹性差且缺乏引流静脉等病理学基础有关[9, 14]。
值得注意的是,由于肾EAML无明确脂肪征象,因此其容易被误诊为乏脂肪型AML[15-16]。但后者肿瘤相对较小、密度均匀,通常无坏死液化。当CT影像诊断困难时,MRI的水脂分离序列图像可能有助于二者的鉴别诊断。此外,肾EAML的坏死液化征象与常见的肾透明细胞癌难以区分,结合本研究的结果,我们认为,二者的增强CT具有一定的鉴别价值。肾透明细胞癌皮质期明显强化,且多为“快进快出”[17];而肾EAML皮质期强化较轻微,且多为“快进慢出”。我们推测,进一步的皮质期和(或)髓质期强化比值定量计算也可能有利于与其他肾肿瘤病变的鉴别诊断。
本研究的不足:(1)肾EAML为罕见病,样本量有限,且病例来自多家医院,不同CT扫描的原始数据和肿瘤标本保存状况可能影响对结果的判断,但未作进一步分析;(2)仅分析了本组病例的CT影像表现,影像资料单一;(3)缺少与其他肾脏肿瘤的对比研究;(4)既往研究结果显示肾EAML可能与结节性硬化疾病相关,本研究未作进一步分析。
综上所述,肾EAML具有一定的特征性CT征象,特别是皮质期强化较轻微(肾皮质强化比值≤0.73)时应高度怀疑肾EAML可能,然而CT征象能否预测上皮样细胞占比,还有待进一步研究。本研究样本量较少,且缺少MRI影像资料,笔者后续将继续扩大样本量,加入MRI相关研究,以提高肾EAML的诊断准确率。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘子蔚负责研究命题的提出、方法的设计、文献的搜集、论文的撰写与修改;胡秋根负责论文的审阅;罗纯负责数据的收集与分析、论文的修改;杨少民、陈海雄、张榕负责数据的收集与分析;曾晓峰负责病理标本的分析。
肾上皮样与类上皮样血管平滑肌脂肪瘤CT影像与病理学表现的对照分析
Comparative analysis of CT images and pathological findings of renal epithelioid angiomyolipoma and epithelioid-like angiomyolipoma
-
摘要:
目的 探讨肾上皮样血管平滑肌脂肪瘤(EAML)与类上皮样血管平滑肌脂肪瘤(AML)的CT和病理学特征。 方法 回顾性分析2008年6月至2018年10月在南方医科大学顺德医院(佛山市顺德区第一人民医院)和佛山市第一人民医院经病理诊断为肾EAML的22例患者的资料,其中男性4例、女性18例,中位年龄48.9(22~72)岁。将所有病灶组织的标本重新切片、染色后镜下观察,并根据此次观察的标本中上皮样成分占比,分为肾EAML组和类上皮样AML组。对比分析2组患者CT图像上的肿瘤长径、形态、坏死液化、出血、肿瘤内脂肪、强化模式等CT征象并测量各期CT值,计算皮质期和髓质期的强化比值,并用皮质期强化比值反映皮质期强化程度。2组间的比较采用独立样本t检验、Mann-Whitney U检验和Fisher's确切概率法。 结果 肾EAML组(15例)的上皮样细胞占86.7%,细胞呈圆形或多边形,呈巢状、片状排列,部分核不规则,具有核异型性;类上皮样AML组(7例)的上皮样细胞占23.6%,其他多为梭形平滑肌细胞和脂肪细胞。肾EAML组和类上皮样AML组在肿瘤长径[(8.40±4.26) cm对(4.90±1.84) cm]、坏死液化[73.3%(11/15)对14.3%(1/7)]、肿瘤内脂肪[86.7%(13/15)对14.3%(1/7)]、强化模式[73.3%(11/15)对14.3%(1/7)]的差异均有统计学意义(t=2.66,Fisher's确切概率法,均P<0.05);在皮质期增强CT强化比值的差异有统计学意义[0.61(0.56, 0.67)对0.96(0.92, 0.97),Z=−3.56,P<0.001],且临界值≤0.73时的诊断效能最高[曲线下面积=0.981(0.813~1.000),Youden=0.87],Youden指数由高到低依次为肿瘤内无脂肪、“快进慢出”强化模式、有坏死液化、肿瘤长径>8 cm。 结论 肾EAML具有特征性CT征象,尤其当皮质期强化比值≤0.73时,应高度怀疑肾EAML。 -
关键词:
- 体层摄影术,X线计算机 /
- 病理学 /
- 肾上皮样血管平滑肌脂肪瘤
Abstract:Objective To investigate the CT and pathological features of renal epithelioid angiomyolipoma (EAML) and epithelioid-like angiomyolipoma (AML). Methods Retrospectively collected data on 22 cases of EAML diagnosed by initial pathology in the Shunde Hospital of the Southern Medical University (the First People's Hospital of Shunde in Foshan City) and the First People's Hospital of Foshan from June 2008 to October 2018, including 4 males and 18 females with an average age of 48.9 years (ranging from 22 years to 72 years). The specimens of all lesions were resliced, stained, observed under microscope, and divided into the EAML and epithelioid-like AML groups according to their proportion of epithelioid components. A comparative analysis of CT signs, such as lesion diameter, morphology, liquid necrosis, hemorrhage, fat, and enhanced mode, on the CT images in both groups was performed. The CT values of each phase were measured, and the enhancement ratio of the cortical and medulla phases, which can reflect the degree of enhancement in each phase, was calculated. Independent sample t test, Mann-Whitney U test, and Fisher's exact probability method were used to compare the two groups. Results The epithelioid cells in the renal EAML group (15 cases) accounted for 86.7%, and the cells were round or polygonal, arranged in nests and sheets, and some nuclei were irregular and atypia. The epithelioid cells in the epithelioid-like AML group (7 cases) accounted for 23.6%, and the rest part were mostly spindle-shaped smooth muscle cells and adipocytes. The renal EAML group and the epithelioid-like AML group had significant differences in the lesion length ((8.40±4.26) cm vs. (4.90±1.84) cm), liquid necrosis (73.3%(11/15) vs. 14.3% (1/7)), fat (86.7%(13/15) vs. 14.3%(1/7)), and enhancement pattern (73.3%(11/15) vs. 14.3%(1/7)) (t=2.66; Fisher's exact probability method; all P<0.05). The cortical phase enhancement ratio was statistically significant (0.61 (0.56, 0.67) vs. 0.96 (0.92, 0.97), Z=−3.56, P<0.001), and the diagnosis efficiency was the highest when the cutoff value was ≤0.73 (area under curve =0.981 (0.813−1.000), Youden=0.87). Youden index of fat-free, "fast-in and slow-out" intensive mode, liquid necrosis, and tumor length >8 cm in order from high to low. Conclusions EAML has characteristic CT signs especially when the cortical phase enhancement ratio is ≤0.73. In this case, EAML is highly suspected to be possible. -
Key words:
- Tomography, X-ray computed /
- Pathology /
- Renal epithelioid angiomyolipoma
-
表 1 2组患者病理学表现的比较
Table 1. Comparison of pathological findings in two groups of patients
组别 脂肪细胞占比(%) 梭形平滑肌细胞占比(%) 上皮样细胞占比(%) 上皮样细胞核异型程度(例) 轻 中 重 肾EAML组(n=15) 2.9 10.4 86.7 3 9 3 类上皮样AML组(n=7) 25.7 50.7 23.6 4 3 0 注:表中,EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤 表 2 2组患者CT征象的比较
Table 2. Comparison of CT findings in two groups of patients
CT征象 肾EAML组
(n=15)类上皮样
AML组(n=7)检验值 P值 肿瘤长径(cm) 8.40±4.26 4.90±1.84 t=2.66 0.015 病灶形态[例(%)] − 0.343 不规则形 4(26.7%) 4(57.1%) 类圆形 11(73.3%) 3(42.9%) CT平扫密度[例(%)] − 1.000 等或稍高密度 15(100.0%) 7(100.0%) 低或稍低密度 0(0) 0(0) 坏死液化[例(%)] − 0.020 有 11(73.3%) 1(14.3%) 无 4(26.7%) 6(85.7%) 出血[例(%)] − 0.343 有 4(26.7%) 4(57.1%) 无 11(73.3%) 3(42.9%) 肿瘤内脂肪[例(%)] − 0.002 有 2(13.3%) 6(85.7%) 无 13(86.7%) 1(14.3%) 强化模式[例(%)] − 0.017 快进快出 3(20.0%) 6(85.7%) 快进慢出 11(73.3%) 1(14.3%) 渐进强化 1(6.7%) 0(0) 粗大血管[例(%)] − 1.000 有 12(80.0%) 6(85.7%) 无 3(20.0%) 1(14.3%) 注:表中,CT:计算机体层摄影术;EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤;−:Fisher's确切概率法,无检验值 表 3 2组患者各期CT值及强化比值的比较
Table 3. Comparison of CT value and enhancement ratio of two groups of patients
组别 CT值( $\bar x \pm s$ 

强化比值[M(P25,P75)] 平扫 增强皮质期 增强髓质期 皮质期 髓质期 肾EAML(n=15) 46.3±4.19 106.3±38.06 93.8±29.33 0.61(0.56,0.67) 0.52(0.43,0.55) 类上皮样AML(n=7) 43.3±3.20 119.0±16.97 82.1±11.39 0.96(0.92,0.97) 0.53(0.52,0.54) 检验值 t=1.70 t=−1.08 t=1.01 Z=−3.56 Z=−0.89 P值 0.105 0.293 0.327 <0.001 0.394 注:表中,CT:计算机体层摄影术;EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤 表 4 22例肾EAML与7例类上皮样AML患者CT征象诊断效能的比较
Table 4. Comparison of the diagnostic efficacy of CT findings in 22 patients with renal epithelioid angiomyolipoma and 7 patients with epithelioid-like angiomyolipoma
CT征象 灵敏度(%) 特异度(%) AUC(95%CI) 阳性预测值(%) 阴性预测值(%) Youden指数 临界值及标准 肿瘤长径 46.7 100.0 0.738(0.509~0.900) 100.0 46.7 0.47 >8 cm 坏死液化 73.3 85.7 0.795(0.571~0.935) 91.7 60.0 0.59 有 肿瘤内脂肪 86.7 85.7 0.862(0.649~0.970) 92.9 75.0 0.72 无 强化模式 80.0 85.7 0.833(0.615~0.956) 92.3 66.7 0.66 快进慢出 皮质期强化比值 86.7 100.0 0.981(0.813~1.000) 100.0 77.8 0.87 ≤0.73 注:表中,EAML:上皮样血管平滑肌脂肪瘤;AML:血管平滑肌脂肪瘤;CT:计算机体层摄影术;AUC:曲线下面积;CI:可变区间 -
[1] Brimo F, Robinson B, Guo C, et al. Renal epithelioid angiomyolipoma with atypia: a series of 40 cases with emphasis on clinicopathologic prognostic indicators of malignancy[J]. Am J Surg Pathol, 2010, 34(5): 715−722. DOI: 10.1097/PAS.0b013e3181d90370. [2] Nese N, Martignoni G, Fletcher CD, et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney: a clinicopathologic study of 41 cases: detailed assessment of morphology and risk stratification[J]. Am J Surg Pathol, 2011, 35(2): 161−176. DOI: 10.1097/PAS.0b013e318206f2a9. [3] Lei JH, Liu LR, Wei Q, et al. A four-year follow-up study of renal epithelioid angiomyolipoma: a multi-center experience and literature review[J/OL]. Sci Rep, 2015, 5: 10030[2020-02-28]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4419536. DOI: 10.1038/srep10030. [4] Martignoni G, Reuter VE, Fletcher C, et al. Epithelioid angiomyolipoma of World Health Organization classification of tumours of the urinary system and male genital organs[M]. Lyon: IARC Press, 2016: 65−66. [5] 康钦钦, 马超, 张火俊, 等. 肾脏乏脂肪血管平滑肌脂肪瘤与透明细胞癌的高分辨螺旋CT特征分析[J]. 中华泌尿外科杂志, 2013, 34(10): 732−737. DOI: 10.3760/cma.j.issn.1000-6702.2013.10.003.
Kang QQ, Ma C, Zhang HJ, et al. Analysis of the characteristics of minimal fat renal angiomyolipoma and clear cell renal carcinoma in high resolution multi-slice spiral CT[J]. Chin J Urol, 2013, 34(10): 732−737. DOI: 10.3760/cma.j.issn.1000-6702.2013.10.003.[6] 沈江潮, 杨建峰. 肾乏脂性血管平滑肌脂肪瘤在MSCT腹部常规双期增强扫描中的强化特征分析[J]. 中国临床医学影像杂志, 2015, 26(7): 491−494.
Shen JC, Yang JF. Enhancement characteristics of renal angiomyolipoma with minimal fat on routine biphasic abdominal MSCT[J]. J Chin Clin Med Imaging, 2015, 26(7): 491−494.[7] Thway K, Fisher C. PEComa: morphology and genetics of a complex tumor family[J]. Ann Diagn Pathol, 2015, 19(5): 359−368. DOI: 10.1016/j.anndiagpath.2015.06.003. [8] Ebele JN, Sauter G, Epstein JI, et al. World Health Organization classification of tumours. Pathology and genetics of tumours of the urinary system and male genital organs[M]. Lyon: IARC Press, 2004: 64−69. [9] Cui L, Zhang JG, Hu XY, et al. CT imaging and histopathological features of renal epithelioid angiomyolipomas[J]. Clin Radiol, 2012, 67(12): e77−e82. DOI: 10.1016/j.crad.2012.08.006. [10] Zhong Y, Shen YG, Pan JJ, et al. Renal epithelioid angiomyolipoma: MRI findings[J]. Radiol Med, 2017, 122(11): 814−821. DOI: 10.1007/s11547-017-0788-9. [11] 郭锐, 康素海, 钟燕, 等. 肾上皮样与非上皮样血管平滑肌脂肪瘤磁共振影像表现与鉴别诊断[J]. 中华医学杂志, 2018, 98(45): 3701−3704. DOI: 10.3760/cma.j.issn.0376-2491.2018.45.014.
Guo R, Kang SH, Zhong Y, et al. Magnetic resonance imaging findings and differential diagnosis of renal epithelioid angiomyolipoma comparing with renal no-epithelioid angiomyolipoma[J]. Natl Med J China, 2018, 98(45): 3701−3704. DOI: 10.3760/cma.j.issn.0376-2491.2018.45.014.[12] Zheng S, Bi XG, Song QK, et al. A suggestion for pathological grossing and reporting based on prognostic indicators of malignancies from a pooled analysis of renal epithelioid angiomyolipoma[J]. Int Urol Nephrol, 2015, 47(10): 1643−1651. DOI: 10.1007/s11255-015-1079-9. [13] Jinzaki M, Silverman SG, Akita H, et al. Renal angiomyolipoma: a radiological classification and update on recent developments in diagnosis and management[J]. Abdom Imaging, 2014, 39(3): 588−604. DOI: 10.1007/s00261-014-0083-3. [14] 胡晓云, 方向明, 胡春洪, 等. 肾上皮样血管平滑肌脂肪瘤的CT表现[J]. 中华放射学杂志, 2010, 44(10): 1066−1068. DOI: 10.3760/cma.j.issn.1005-1201.2010.10.013.
Hu XY, Fang XM, Hu CH, et al. CT features of renal epithelioid angiomyolipomas[J]. Chin J Radiol, 2010, 44(10): 1066−1068. DOI: 10.3760/cma.j.issn.1005-1201.2010.10.013.[15] Cong XY, Zhang J, Xu XJ, et al. Renal epithelioid angiomyolipoma: magnetic resonance imaging characteristics[J]. Abdom Radiol (NY), 2018, 43(10): 2756−2763. DOI: 10.1007/s00261-018-1548-6. [16] 贺新华, 丁玉芹, 陈亮, 等. 肾脏乏脂肪血管平滑肌脂肪瘤的临床病理及CT表现[J]. 放射学实践, 2014, 29(6): 673−676. DOI: 10.13609/j.cnki.1000-0313.2014.06.023.
He XH, Ding YQ, Chen L, et al. Clinical, pathological and CT features of lipid-poor renal angiomyolipoma[J]. Radiol Pract, 2014, 29(6): 673−676. DOI: 10.13609/j.cnki.1000-0313.2014.06.023.[17] 丁玉芹, 于泳, 罗荣奎, 等. 多元Logistic回归分析CT征象鉴别乏脂肪血管平滑肌脂肪瘤和肾透明细胞癌的价值[J]. 临床放射学杂志, 2019, 38(3): 495−499. DOI: 10.13437/j.cnki.jcr.2019.03.032.
Ding YQ, Yu Y, Luo RK, et al. Value of multivariate Logistic regression analysis of CT features in the differential diagnosis of lipid-poor angiomyolipoma and clear cell renal cell carcinoma[J]. J Clin Radiol, 2019, 38(3): 495−499. DOI: 10.13437/j.cnki.jcr.2019.03.032. -





 下载:
下载: