-
帕金森病(Parkinson disease,PD)是一种中老年人常见的慢性进行性神经系统变性疾病。随着人口老龄化的加剧,其发病率逐年上升。目前对于PD尚无有效的预防方法,但早期诊断和治疗能有效提高患者的生活质量。近些年的研究结果显示,中脑铁沉积与多巴胺能神经元密切相关,而多巴胺能神经元的变性死亡是PD最主要的病理改变,故了解中脑的铁沉积变化情况有助于PD的诊断[1]。MR定量磁化率成像(quantitative susceptibility mapping,QSM)可从梯度回波磁共振相位图上确定脑组织的整体磁化率的空间分布,较磁敏感加权成像(susceptibility weighted imaging,SWI)和T2弛豫时间图成像(T2 Mapping)等更能反映脑内铁含量的变化[2]。目前已有学者对PD患者中脑黑质的铁沉积情况进行研究[1],但关于PD患者中脑红核铁沉积情况及其对PD的诊断价值仍缺少研究。本研究采用QSM技术评估PD患者中脑黑质及红核磁化率的变化情况,明确其对PD诊断、病程、分级及患者临床症状等评估的应用价值。
-
回顾性分析2017年2月至2019年8月于佛山市第一人民医院神经内科住院并诊断为PD的患者39例(PD组),其中男性17例、女性22例,年龄47~80(65.44±9.78)岁。纳入标准:符合英国PD学会脑库帕金森病的临床诊断标准[3]。排除标准:①PD综合征及PD叠加综合征患者;②存在精神或代谢性疾病患者;③颅脑常规MRI检查中脑部存在器质性病变的患者(如脑出血、脑梗塞或肿瘤性病变等)。患者病程为0.1~20.0(4.66±4.17)年;根据改良Hoehn-Yahr分级将患者分为1~5级,其中1级7例、1.5级5例、2级7例、2.5级4例、3级11例、4级3例、5级2例。分级≤2.5级为早期PD组(23例),分级>2.5级为中晚期PD组(16例)。记录患者发病初期肢体运动障碍的情况,其中早期PD组发病初期表现为左侧肢体运动障碍者8例、右侧15例;中晚期PD组左侧5例、右侧11例。另选取20名健康体检者作为正常对照组,其中男性8名、女性12名,年龄49~83(59.85±11.52)岁。纳入标准:①体检未见神经系统相关疾病及精神疾病等;②常规MRI检查颅脑除了退行性改变外,未见其他异常。所有受检者在检查前均签署了知情同意书。
-
所有扫描均使用美国GE Discovery 750W 3.0 T超导MRI扫描仪,16通道头颈联合线圈;在扫描过程中,提供了约束泡沫垫和耳塞以稳定每个受试者的头部并降低噪音,最大程度地减少运动伪影。图像采用轴位扫描,平行于前、后联合连线。所有受试者均行常规头颅MRI扫描,序列包括液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)-T1加权成像、快速自旋回波序列-T2加权成像、FLAIR-T2加权成像及扩散加权成像(b=0、1000 s/mm2);扫描参数:层数20层、层厚5.0 mm、层间距1.0 mm、视野240 mm×240 mm。三维扰相梯度回波序列用于QSM技术数据采集:重复时间84.3 ms、回波时间 3.1 ms、回波链数16、激励次数0.7、翻转角12°、层厚2.0 mm、层间距0 mm、视野256 mm×256 mm、矩阵256 mm×256 mm。扫描范围覆盖全脑,扫描时间为6 min 46 s。
-
将QSM技术扫描获取的原始图像导入GE AW4.6工作站Functool软件(9.4.05版)中的QSM模块,设置阈值为0.06,获得软组织分辨率高、对比度良好的磁敏感图和相位图,利用相位图获取磁化率分布图。由同一名有2年神经系统MRI诊断经验的医师在相位图上找出清晰显示中脑黑质和红核的层面,手动勾画左右两侧黑质和红核,并测量记录其磁化率,每个部位测量2次,取平均值;由另一名有5年神经系统MRI诊断经验的医师进行核对。如有异议,则重新勾画中脑双侧黑质和红核并记录测量值。
-
采用SPSS17.0软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(
$\bar{x}\pm s$ )表示。组间比较采用χ2检验和t检验(方差齐)。采用ROC曲线分析,计算确定中脑黑质及红核的诊断阈值。PD患者的中脑黑质及红核磁化率与其临床Hoehn-Yahr分级及病程、黑质与红核磁化率变化的相关性均采用Pearson相关性分析;PD组的中脑左右两侧黑质及红核磁化率变化与患者临床发病时肢体运动障碍症状侧比较采用单因素方差分析。P<0.05为差异有统计学意义。 -
PD组与正常对照组在性别、年龄方面的差异无统计学意义(χ2=0.07,P=0.79;t=2.22,P=0.19),早期PD组与中晚期PD组在性别、年龄方面的差异亦无统计学意义(χ2=0.00,P=0.62;t=0.83,P=0.21)。
-
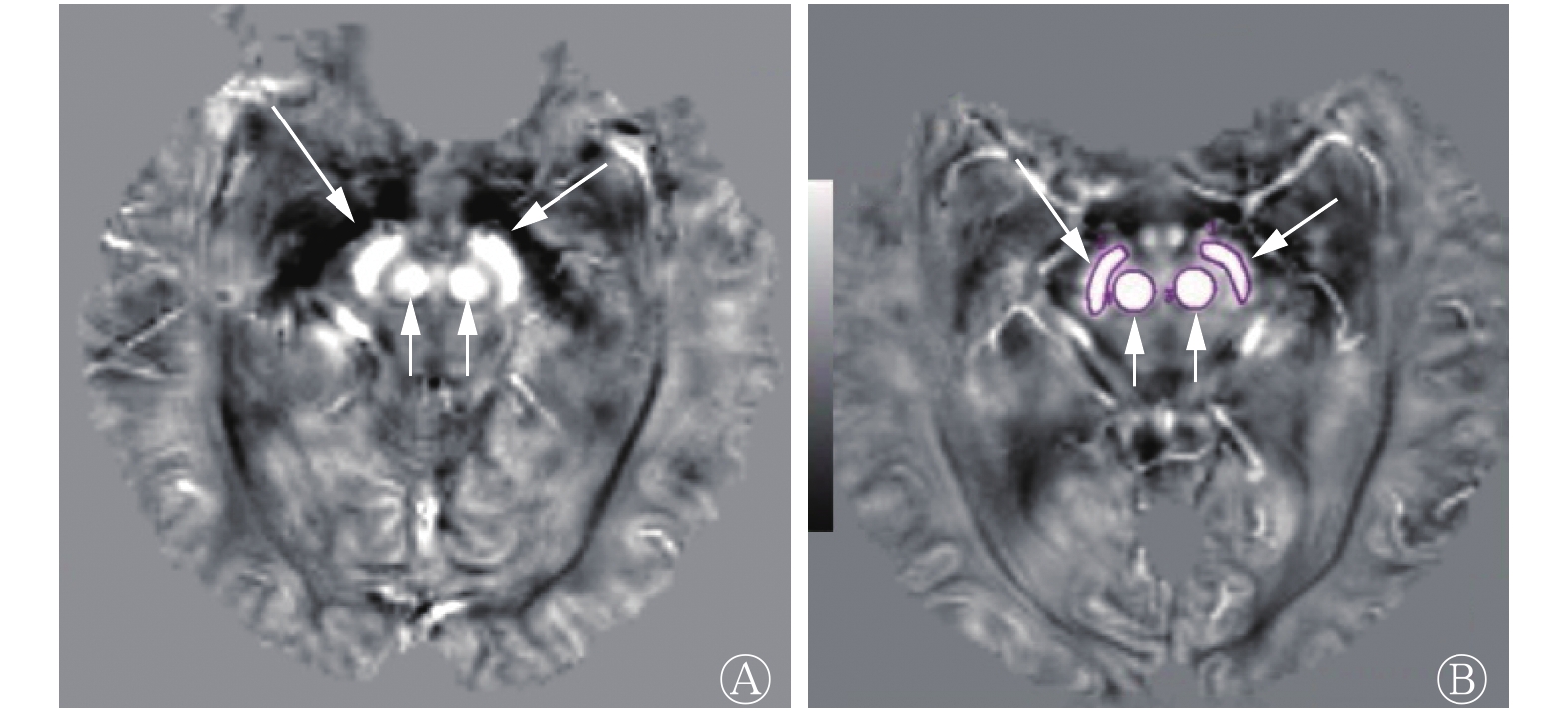
QSM图像上正常对照组和PD组的中脑黑质及红核均表现为对称高信号,边界清晰(图1)。由表1可知,PD组的中脑黑质及红核磁化率均较正常对照组显著升高,且差异均有统计学意义(t=−2.125,P=0.043; t=−2.605,P=0.015)。
图 1 正常对照者(女性,47岁)与帕金森病患者(男性,51岁)中脑定量磁化率成像的磁化率分布图
Figure 1. Magnetic susceptibility distribution of the midbrain in quantitative susceptibility mapping in the control (female, 47years old) and Parkinson disease patient(male, 51years old)
组别 例数 黑质 红核 正常对照组 20 0.058±0.028 0.072±0.035 PD组 39 0.073±0.017a 0.094±0.020a 早期PD组 23 0.073±0.019a 0.093±0.021a 中晚期PD组 16 0.072±0.014 0.094±0.020a 注:表中,a:与正常对照组比较,差异均有统计学意义(t=2.014~2.605,均P<0.05)。PD: 帕金森病 表 1 4组患者中脑黑质和红核的磁化率比较(
$\bar x $ Table 1. Mean susceptibility values of substantia nigra and red nucleus in four groups (
$\bar x $ -
由表1可知,早期PD组的中脑黑质磁化率显著高于正常对照组,且差异有统计学意义(t=2.014, P=0.031);中晚期PD组与早期PD组的中脑黑质磁化率差异无统计学意义(t=0.025, P=0.984);早期PD组及中晚期PD组红核的磁化率均显著高于正常对照组,差异均有统计学意义(t=2.417, P=0.009;t=2.445, P=0.014);早期PD组与中晚期PD组的红核磁化率差异无统计学意义(t=0.117, P=0.927)。
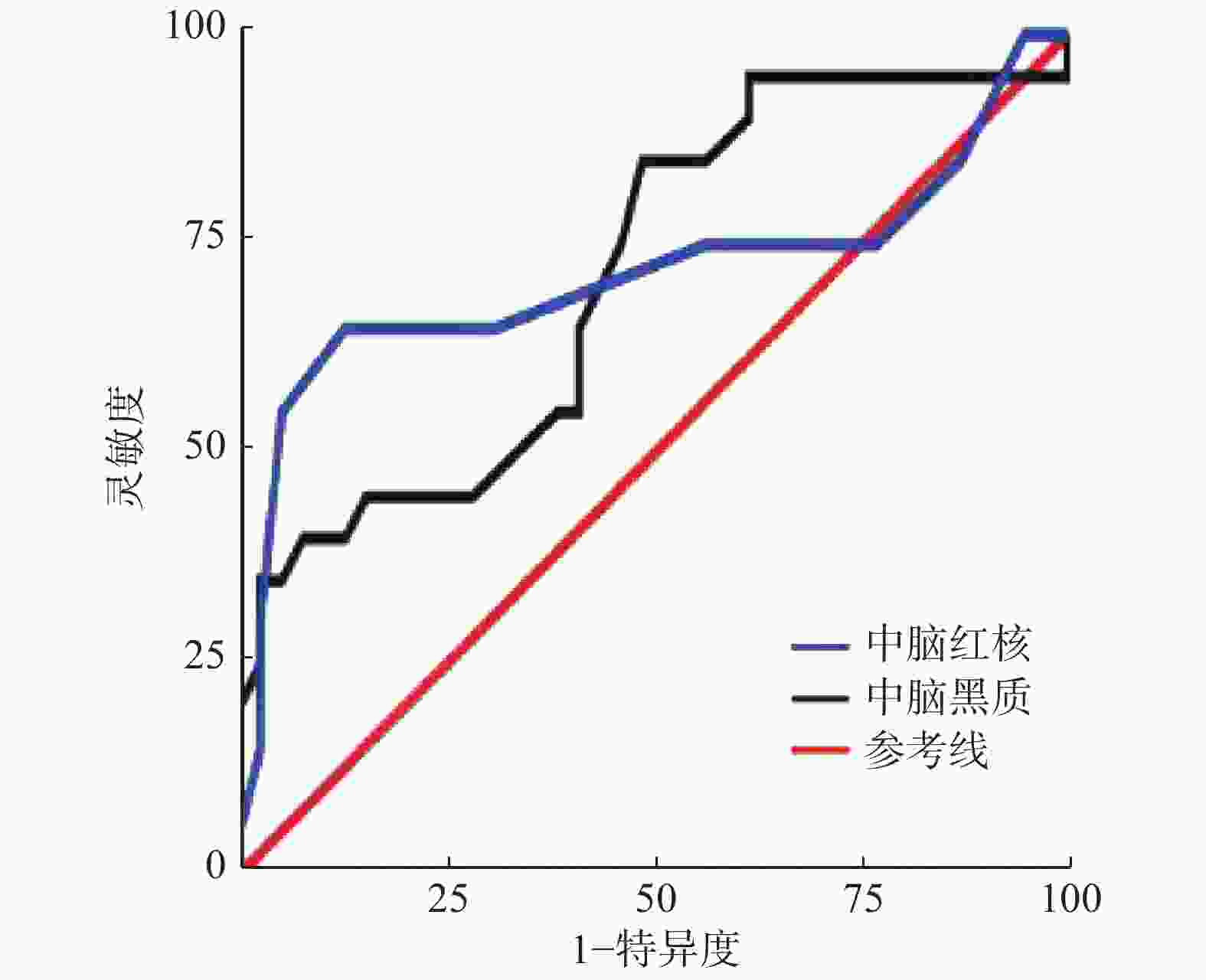
由图2可见,ROC曲线分析结果显示,以中脑黑质磁化率0.069×10−3为最佳阈值诊断PD,AUC为0.710,95% CI为0.567~0.853,灵敏度为51.3%、特异度为85.0%、准确率为62.7%;以红核磁化率0.068×10−3为最佳阈值诊断PD,AUC为0.717、95% CI为0.549~0.886、灵敏度为94.9%、特异度为60.0%、准确率为83.1%。
-
PD组的中脑黑质及红核的磁化率与Hoehn-Yahr不同分级均无相关性(r=0.051, P=0.759;r=0.045,P=0.788)。黑质磁化率与病程呈显著正相关(r=0.420,P=0.008),红核磁化率与病程无显著相关性(r=0.241,P=0.130)。PD组的中脑黑质磁化率与红核磁化率呈正相关(r=0.477,P=0.002)。
-
单因素分析结果显示,PD组的中脑左侧右侧黑质、红核磁化率的变化与患者发病初期临床肢体运动障碍症状侧的表现无显著相关性(黑质:F左=0.661, P左=0.421;F右=1.153, P右=0.290。红核:F左=0.006, P左=0.940;F右=0.109,P右=0.743)。
-
本研究采用QSM技术对PD患者的中脑黑质及红核的磁化率变化进行测量,结果提示QSM技术能准确地测量中脑黑质与红核磁化率的变化,间接反映脑内铁沉积。中脑黑质与红核的磁化率可作为诊断PD及病程评估的重要指标,而QSM技术评估PD患者病情、偏侧性肢体运动障碍临床表现等仍需进一步验证。
正常中脑黑质中含有产生神经黑色素的多巴胺能神经元,神经黑色素可使自由基失活或螯合金属铁来保护神经元免受氧化损伤[4]。但在PD患者中,多巴胺能神经元的变性死亡使得神经黑色素减少,黑质纹状体通路破坏,导致脑内铁代谢紊乱,最终引起脑内相应区域异常铁沉积。这一系列病理的改变,尤其在脑内深部核团(黑质、红核等),在PD患者出现典型的临床症状前就已经发生。QSM技术以SWI技术为基础,通过场图拟合、相位解缠绕、背景场去除及磁化率反演计算得到磁化率图像[5];相较于SWI技术,QSM技术获取的图像伪影更少、组织结构边界更清晰,且可以定量脑组织内整体磁化率空间分布,反映脑内铁的分布[6]。既往研究已证实,磁化率对脑内铁含量的变化非常敏感,尤其是在灰质结构中的铁含量变化[7]。利用QSM技术对正常人脑内磁化率的研究发现,磁化率在苍白球中最高,其次在红核及黑质,额叶白质中最低[8]。
近年来,QSM技术逐步用于检测PD患者脑内铁沉积并据此结果诊断和评估PD。本研究结果显示,PD组中脑黑质及红核磁率均较正常对照组显著升高(P<0.05),与已报道研究结果一致[9-11],提示中脑黑质和红核均有异常的铁沉积,符合PD患者因多巴胺能神经元变性死亡导致异常铁沉积的病理改变。本研究分别以黑质磁化率0.069×10−3和红核磁化率0.068×10−3为阈值诊断PD,具有较高的诊断效能(AUC分别为0.710和0.717)。可见,QSM技术定量测量中脑黑质及红核磁化率有助于PD诊断。
我们发现,早期PD组与中晚期PD组的中脑黑质及红核磁化率的差异均无统计学意义,与An等[12]研究认为PD患者在疾病晚期黑质磁化率明显升高的结果不一致,这可能与其的研究纳入对象全部在暂停抗帕金森病药物至少12 h的状态下进行黑质磁化率的测定有关。也有研究认为,随着PD患者的临床症状加重,中脑黑质内铁沉积量和铁沉积速度也会发生变化[2],该结果说明中脑黑质内铁沉积随患者病情进展而处于动态变化过程。可见利用QSM技术测定磁化率对PD患者分期评价存在不确定性,或者说PD患者随着病情的进展,不一定会伴随着黑质、红核铁沉积量和铁沉积速度的动态变化。因此,中脑黑质及红核磁化率的测定可能不适用于PD患者病情进展阶段的评估。
有研究者认为,PD不同阶段不同区域的铁沉积不同[7,13]。多巴胺能神经元主要位于中脑黑质,红核内较少,使得中脑黑质及红核的铁沉积存在差异。早期PD患者主要出现中脑黑质的铁异常沉积,而随着病情进展,红核的铁异常沉积也逐渐明显,这表明中脑红核与PD疾病的某些阶段相关[14]。但Guan等[15]认为,红核中的铁含量与PD患者病情的严重程度无相关性。我们发现早期PD组及中晚期PD组患者中脑红核的磁化率显著高于对照组,且差异有统计学意义,而早期和中晚期PD组间却未见明显差异。我们通过该结果推测中脑红核磁化率测量可能有助于提示患者处于早期PD阶段,从而缩短传统的PD临床诊断时间窗,为PD患者早期临床干预提供依据,但该测量值可能无助于中晚期PD患者的病情进展评估。我们也同时发现,中脑红核磁化率与黑质存在正相关,这可能是由于黑质、红核间存在臂旁核或神经纤维通路[16],导致红核内铁的异常沉积受黑质细胞代谢异常影响。但是从黑质、红核磁化率诊断PD的灵敏度(51.3%、94.9%)和特异度(85.0%、60.0%)来看,二者显然存在差异。这是否与入组对象或病理改变程度等其他因素有关,尚待进一步研究。
目前因Hoehn-Yahr分级操作简单,能有效显示PD的病情进展情况、评价治疗效果,并能作为手术指征等重要参考,在临床上得到广泛应用。Guan等[15]把中脑黑质分为致密部和网状部两个亚结构进行研究,结果表明黑质致密部的铁含量与Hoehn-Yahr分级显著相关。也有研究认为,脑内磁化率分布与PD患者临床症状相关性存在一种异质性模式,即病程较短患者的黑质磁化率与Hoehn-Yahr分级不相关,但随着病程进展,其相关性逐渐明显[11]。而本研究结果提示,中脑黑质及红核磁化率与PD的Hoehn-Yahr不同分级均无相关性。本研究结果与文献[11]结果存在差异,这可能是由于二者在研究方法上的差异而导致。本研究未把黑质分为致密部和网状部两个亚结构,而是作为一个整体进行评估,也可能是由于本研究纳入的晚期患者相对少。故应用QSM技术测定中脑黑质及红核磁化率评估PD患者Hoehn-Yahr分级的方法和效能,有待进一步优化与验证。但中脑黑质的磁化率随着病程的增加而增加,提示黑质磁化率对病程评估具有一定价值。
本研究结果提示,中脑左右两侧黑质和红核的磁化率的变化与患者发病初期临床肢体运动障碍症状侧无显著性差异,考虑黑质及红核左右侧磁化率变化对临床症状无显著性影响,与Murakami等[9]报道结果一致。王波等[17]认为,PD患者虽然是一侧肢体表现出临床症状,但事实上中脑左右两侧黑质及红核都已经在病理生理上发生了改变,因此不能根据黑质及红核磁化率来判断PD患者的肢体运动障碍偏侧性临床表现。PD患者的肢体运动障碍偏侧性临床症状表现与黑质、红核多巴胺能神经元变性死亡导致异常铁沉积病理改变的关系需要进一步研究。
综上所述,QSM技术能测量中脑内黑质与红核磁化率,间接反映脑内铁沉积情况,对PD的诊断及病程评估具有临床价值。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 冯燕韻负责研究的选题与设计、试验的实施、数据的分析、论文的撰写与修改;徐志锋负责研究的选题与设计、方案的建立、资料的选取;贺小红负责对数据的采集、论文的修改;吴文秀负责数据的统计学分析;刘健萍、罗纯负责数据的测量、记录与核对。
MR定量磁化率成像在帕金森病临床诊断中的价值研究
Value of MR quantitative susceptibility mapping in the diagnosis of Parkinson disease
-
摘要:
目的 分析帕金森病(PD)患者的中脑黑质及红核的磁化率变化情况,明确MR定量磁化率成像(QSM)技术在PD临床诊断中的价值。 方法 回顾性分析2017年2月至2019年8月于佛山市第一人民医院诊断为PD的患者39例(PD组),其中男性17例、女性22例,年龄47~80(65.44±9.78)岁。根据改良Hoehn-Yahr分级将患者分为早期PD组(23例)及中晚期PD组(16例),另选取20名健康体检者作为正常对照组。所有患者及正常对照者均进行QSM扫描,测量各组中脑左右两侧黑质和红核的磁化率,取平均值。采用独立样本t检验分析PD患者的中脑黑质及红核磁化率的变化特征,并与PD的临床诊断、分级和病程进行Pearson相关性分析;采用单因素分析中脑左右侧黑质及红核的磁化率变化与临床肢体运动障碍症状侧的关系。 结果 PD组的中脑黑质及红核的磁化率较正常对照组显著升高 [(0.073±0.017)×10−3对(0.058±0.028)×10−3,t=−2.125,P=0.043;(0.094±0.020)×10−3对(0.072±0.035)×10−3,t=−2.605,P=0.015]。PD组的中脑黑质及红核的磁化率与Hoehn-Yahr分级无显著相关性(r=0.051,P=0.759;r=0.045,P=0.788);黑质的磁化率与病程呈显著正相关(r=0.420,P=0.008),红核的磁化率与病程无相关性(r=0.241,P=0.130)。PD组的中脑左右侧黑质、红核的磁化率变化与患者临床发病时肢体运动障碍症状的表现无显著相关性(黑质:F左=0.661,P左=0.421;F右=1.153,P右=0.290。红核:F左=0.006,P左=0.940;F右=0.109,P右=0.743)。 结论 QSM技术能够测量中脑黑质及红核的磁化率,并间接反映脑内铁沉积情况,对PD诊断及病程评估具有临床价值。 Abstract:Objective To analysis the changes in the magnetic susceptibility of substantia nigra(SN) and red nucleus(RN) in midbrain in Parkinson disease (PD), and determine the value of MR quantitative susceptibility mapping (QSM) in the clinical diagnosis of PD. Methods A total of 39 PD patients (PD group) who were hospitalized in the First People's Hospital of Foshan from February 2017 to August 2019, including 17 males and 22 females, aged 47−80 (65.44±9.78) years old, were divided into early PD group (n=23) and progress PD group (n=16) according to improved Hoehn-Yahr classification. And 20 normal controls were selected. All were scanned by QSM technique, and the magnetic susceptibility of SN and RN were measured. The independent sample t test was used to analyze the change of magnetic susceptibility of SN and RN in PD patients, which were analysis with the clinical diagnosis, grading and course of PD perform with Pearson correlation analysis. Univariate analysis was used to analyze the relationship between the magnetic susceptibility of bilateral SN and RN with the symptom of physical movement disorder. Results The magnetic susceptibility value of the SN and RN in the PD group are significantly increase compared with control group ((0.073±0.017) ×10−3 vs. (0.058±0.028) ×10−3; (0.094±0.020) ×10−3 vs. (0.072±0.035) ×10−3), the difference is statistically significant (t=−2.125, P=0043; t=−2.605, P=0.015). No significant correlation among the magnetic susceptibility of SN and RN and the Hoehn-Yahr classification (r=0.051, P=0.759; r=0.045, P=0.788), but the magnetic susceptibility of SN was positively correlated with the course of the disease (r=0.420, P=0.008), while not the RN (r=0.241, P=0.130). There was no significant difference among the magnetic susceptibility of SN and RN on the left or right sides of the midbrain in the PD group, and the symptoms of limb movement disorder during clinical onset (SN: FL=0.661, PL=0.421; FR=1.153, PR=0.290. RN: FL=0.006, PL=0.940; FR=0.109, PR=0.743). Conclusions QSM technology can indirectly reflect the iron deposition in the brain by measure the magnetic susceptibility of SN and RN in midbrain. It is valuable for the diagnosis and assessing the course of PD. -
表 1 4组患者中脑黑质和红核的磁化率比较(
$\bar x $ Table 1. Mean susceptibility values of substantia nigra and red nucleus in four groups (
$\bar x $ 组别 例数 黑质 红核 正常对照组 20 0.058±0.028 0.072±0.035 PD组 39 0.073±0.017a 0.094±0.020a 早期PD组 23 0.073±0.019a 0.093±0.021a 中晚期PD组 16 0.072±0.014 0.094±0.020a 注:表中,a:与正常对照组比较,差异均有统计学意义(t=2.014~2.605,均P<0.05)。PD: 帕金森病 -
[1] Ghassaban K, Liu SF, Jiang CH, et al. Quantifying iron content in magneticresonance imaging[J]. Neuroimage, 2019, 187: 77−92. DOI: 10.1016/j.neuroimage.2018.04.047. [2] 熊洧, 唐北沙, 雷立芳. 铁沉积测定在帕金森病诊断及鉴别诊断中的应用[J]. 中华老年医学杂志, 2019, 38(5): 594−600. DOI: 10.3760/cma.j.issn.0254-9026.2019.05.029.
Xiong W, Tang BS, Lei LF. A review on evaluating application of abnormal iron deposition in brain on diagnosis and differential diagnosis of Parkinson's disease[J]. Chin J Geriatr, 2019, 38(5): 594−600. DOI: 10.3760/cma.j.issn.0254-9026.2019.05.029.[3] Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992, 55(3): 181−184. DOI: 10.1136/jnnp.55.3.181. [4] Lotfipour AK, Wharton S, Schwarz ST, et al. High resolution magnetic susceptibility mapping of the substantia nigra in Parkinson's disease[J]. J Magn Reson Imaging, 2012, 35(1): 48−55. DOI: 10.1002/jmri.22752. [5] 郑志伟, 蔡聪波, 蔡淑惠, 等. 定量磁化率成像的基本原理及方法概述[J]. 磁共振成像, 2016, 7(6): 454−460. DOI: 10.12015/issn.1674-8034.2016.06.011.
Zheng ZW, Cai CB, Cai SH, et al. Brief overview of principles and methods of quantitative esusceptibility mapping[J]. Chin J Magn Reson Imaging, 2016, 7(6): 454−460. DOI: 10.12015/issn.1674-8034.2016.06.011.[6] 夏爽, 柴超, 沈文, 等. MR定量磁敏感图评估正常人脑铁含量的初步研究[J]. 中华放射学杂志, 2014, 48(9): 730−735. DOI: 10.3760/cma.j.issn.1005-1201.2014.09.008.
Xia S, Chai C, Shen W, et al. Preliminary study of distribution and age-related changes of iron-content in the brain using MR quantitative susceptibility mapping[J]. Chin J Radiol, 2014, 48(9): 730−735. DOI: 10.3760/cma.j.issn.1005-1201.2014.09.008.[7] Chen QQ, Chen YT, Zhang Y, et al. Irondeposition in Parkinson's disease by quantitative susceptibility mapping[J]. BMC Neurosci, 2019, 20(1): 23. DOI: 10.1186/s12868-019-0505-9. [8] Persson N, Wu JL, Zhang Q, et al. Age and sex related differences in subcortical brain iron concentrations among healthy adults[J]. Neuroimage, 2015, 122: 385−398. DOI: 10.1016/j.neuroimage.2015.07.050. [9] Murakami Y, Kakeda S, Watanabe K, et al. Usefulness of quantitative susceptibility mapping for the diagnosis of Parkinson disease[J]. AJNR Am J Neuroradiol, 2015, 36(6): 1102−1108. DOI: 10.3174/ajnr.A4260. [10] 安荷娣, Rajeev O , 秧杰, 等. 磁共振定量磁化率成像定量帕金森病患者脑铁沉积的临床研究[J]. 中华神经科杂志, 2016, 49(4): 299−301. DOI: 10.3760/cma.j.issn.1006-7876.2016.04.008.
An HD, Rajeev O, Yang J, et al. Clinical study of iron deposition in patients with Parkinson's disease by quantitative magnetic susceptibility[J]. Chin J Neurol, 2016, 49(4):299−301. DOI:10.3760/cma.j.issn. 1006-7876.2016.04.008.[11] Langkammer C, Pirpamer L, Seiler S, et al. Quantitative susceptibility mapping in Parkinson's disease[J/OL]. PLoS One, 2016, 11(9): e0162460[2020-01-23]. https://www.ncbi.nlm.nih.https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0162460. DOI: 10.1371/journal.pone.0162460. [12] An HD, Zeng XY, Niu TF, et al. Quantifying iron deposition within the substantia nigra of Parkinson's disease by quantitative susceptibility mapping[J]. J Neurol Sci, 2018, 386: 46−52. DOI: 10.1016/j.jns.2018.01.008. [13] Guan XJ, Xuan M, Gu QQ, et al. Influence of regional iron on the motor impairments of Parkinson's disease: A quantitative susceptibility mapping study[J]. J Magn Reson Imaging, 2017, 45(5): 1335−1342. DOI: 10.1002/jmri.25434. [14] Shahmaei V, Faeghi F, Mohammdbeigi A, et al. Evaluation of irondeposition in brain basal ganglia of patients with Parkinson's disease using quantitative susceptibility mapping[J/OL]. Eur J Radiol Open, 2019, 6: 169-174[2020-01-23]. https://www.ejropen.com/article/S2352-0477(19)30020-6/fulltext. DOI:10.1016/j.ejro.2019.04.005. [15] Guan XJ, Xuan M, Gu QQ, et al. Regionally progressive accumulation of iron in Parkinson's disease as measured byquantitative susceptibility mapping[J/OL]. NMR Biomed, 2017, 30(4):1-17[2020-01-23]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4977211/. DOI:10.1002/nbm.3489. [16] Massey LA, Yousry TA. Anatomy of the substantia nigra and subthalamic nucleus on MR imaging[J]. Neuroimaging Clin N Am, 2010, 20(1): 7−27. DOI: 10.1016/j.nic.2009.10.001. [17] 王波, 戴敏方, 王云勇, 等. 帕金森病脑内铁沉积的SWI定量研究[J]. 放射学实践, 2012, 27(11): 1174−1179. DOI: 10.3969/j.issn.1000-0313.2012.11.004.
Wang B, Dai MF, Wang YY, et al. Susceptibility weighted imaging quantitative study of brain iron deposition in Parkinson's disease[J]. Radiol Practice, 2012, 27(11): 1174−1179. DOI: 10.3969/j.issn.1000-0313.2012.11.004. -





 下载:
下载: