-
在我国,乳腺癌位居女性恶性肿瘤发病率的首位[1]。目前,对于早期乳腺癌患者,保乳术后结合放化疗已成为标准治疗方式,其可显著提高肿瘤局部控制率及患者的远期生存率[2]。在行乳腺癌保乳术后,乳腺外形轮廓呈不规则形,而放疗靶区的均匀性和适形性会影响放疗的疗效和并发症的发生。不同的放疗技术在剂量学上存在较大差异,因此优化放疗计划对乳腺癌患者非常重要。传统放疗采用三维适形放疗(three dimensional conformal radiation therapy,3DCRT),由于靶区受呼吸运动的影响,常采用两切线适形野,并将胸廓方向适形的多叶光栅整体外放2 cm,但靶区剂量的均匀性及适形性难以满足要求[3]。适形调强放疗(intensity modulated radiation therapy,IMRT)可提高靶区剂量的均匀性和适形性,减少周边正常组织的受照剂量和受照体积。容积旋转调强放疗(volumetric modulated arc therapy,VMAT)在保证靶区剂量和周围正常组织剂量要求的情况下,大幅度缩短了治疗时间,提高了患者的舒适度和机器的治疗效率。考虑到乳腺癌患者的放疗靶区受呼吸运动影响以及靶区的均匀性和适形性,本研究采用基于固定角度IMRT的混合调强(简称3DCRT+IMRT)、基于VMAT的混合调强(简称3DCRT+VMAT)和切线弧容积旋转调强(tangential volumetric modulated arc therapy,t-VMAT)3种不同的放疗技术对患者进行治疗,并通过比较3种放疗计划的剂量学差异,探讨其临床应用价值。
-
对2019年3月至8月在西安交通大学第一附属医院需要接受放疗的早期左侧乳腺癌保乳术后的12例女性患者的临床资料进行回顾性分析,患者年龄32~50(42.4±6.8)岁。纳入标准:术后病理结果均为手术切缘无残留;腋窝或者前哨淋巴结均为阴性;照射范围只包括胸壁乳腺区;心肺功能基本正常。排除标准:右侧乳腺癌;乳腺癌改良根治术后;照射范围包含锁骨上下区。所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
患者取仰卧位,乳腺托架固定,双臂外展上举,采用荷兰Philips公司的 Brilliance 大孔径模拟CT定位机,利用激光定位灯指示摆位,在患者平静呼吸状态下进行扫描,扫描层厚5 mm,扫描后将CT图像传输至飞利浦公司的Pinnacle 9.10计划系统,用于靶区勾画和放疗计划的设计。
-
所有靶区均由1名副主任医师勾画,勾画临床靶区、计划靶区(planning target volume,PTV)和危及器官。其中,临床靶区包括患侧完整乳腺组织和胸大肌筋膜;临床靶区外放得到PTV,头角方向外放1.0~1.5 cm,胸骨、腋窝和肺方向外放0.5~1.0 cm,皮肤方向限皮下0.5 cm;危及器官包括左右肺、心脏和对侧乳腺。
-
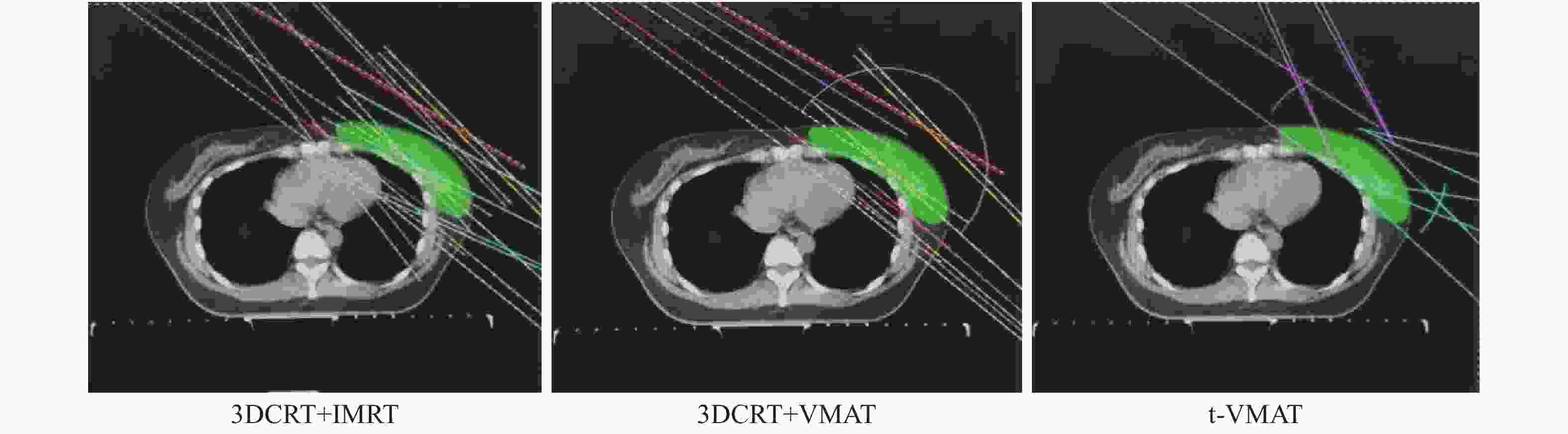
采用Pinnacle 9.10计划系统对12例患者分别设计3种不同的调强计划,每组计划均采用瑞典医科达公司生产的Versa HD直线加速器,采用6 MV X射线照射。PTV处方剂量为50 Gy(2.0 Gy/次,共25次)。①3DCRT+IMRT:先设计两个三维适形平野,其中一野为内切线野,另一野为外切线野,然后对PTV进行适形,并将沿胸廓方向适形的多叶光栅整体外放2 cm,此处方剂量为40 Gy,采用CC算法进行计算。在此基础上,内切线野和外切线野内收10°~15°,在此范围内各添加一个固定角度调强野,两个调强野的处方剂量为10 Gy,然后在3DCRT计划基础上优化目标参数。②3DCRT+VMAT:复制3DCRT+IMRT计划,删除两个调强野,以保证两个三维适形野和3DCRT+IMRT完全一致,然后添加一个旋转弧,起始角度为三维适形野内切线野角度,终止角度为外切线野角度,同样该旋转弧的处方剂量为10 Gy。同样在3DCRT基础上进行优化,优化目标参数与3DCRT+IMRT设置参数保持一致。③ t-VMAT:设计两段弧,第一段弧起始角度为3DCRT+VMAT中三维适形野的内切线平野的角度,顺时针旋转角度设为60°;第二段弧终止角度为外切线平野的角度,同样顺时针旋转角度设为60°,优化目标参数与3DCRT+IMRT、3DCRT+VMAT设置保持一致。3组计划目标参数设定PTV 最小剂量为4950 cGy,最大剂量为5350 cGy,Dmean(平均剂量)为5200 cGy;最小剂量体积直方图设为5000 cGy≥95%(95%靶区体积至少被5000 cGy的剂量包绕),左肺V20<25%、V5<55%(V20:≥20 Gy体积占总体积的百分比,V5:≥5 Gy体积占总体积的百分比),右肺V20<10%,心脏V30<10%(V30:≥30 Gy体积占总体积的百分比)、Dmean<1000 cGy,对侧乳腺Dmean<500 cGy。3种放疗计划布野方式CT图像见图1。
-
比较3种放疗计划的靶区剂量分布、危及器官的剂量学分布和机器跳数(monitor unit,MU)。靶区的剂量分布指标:① PTV的靶区适形性指数(conformity index,CI)[4]=
$ \dfrac{{\rm{V}}_{\rm{T},\rm{r}\rm{e}\rm{f}}}{{\rm{V}}_{\rm{T}}} $ ×$ \dfrac{{\rm{V}}_{\rm{T},\rm{r}\rm{e}\rm{f}}}{{\rm{V}}_{\rm{r}\rm{e}\rm{f}}} $ ,其中VT,ref是PTV被95%处方剂量线所包绕的体积,VT是PTV的体积,Vref是人体被95%处方剂量所包绕的所有照射体积。CI为0~1,CI越大表示适形度越好;②PTV的靶区均匀性指数(homogeneity index,HI)[4]=$ \dfrac{{\rm{D}}_{2\rm{\%}}-{\rm{D}}_{98\rm{\%}}}{{\rm{D}}_{50\rm{\%}}} $ ,其中D2% 、D98%分别是2%、98%靶体积的受照剂量,D50%是中位剂量。HI越小,表示靶区内剂量均匀性越好。危及器官评价参数包括患侧肺V5、V10、V20、Dmean,健侧肺V5、Dmean,心脏V30、V40、Dmean以及健侧乳腺V5、Dmean。 -
采用SPSS 19.0 软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar{{x}}\pm {s}$ 表示,组间数据比较采用配对t检验。P<0.05为差异有统计学意义。 -
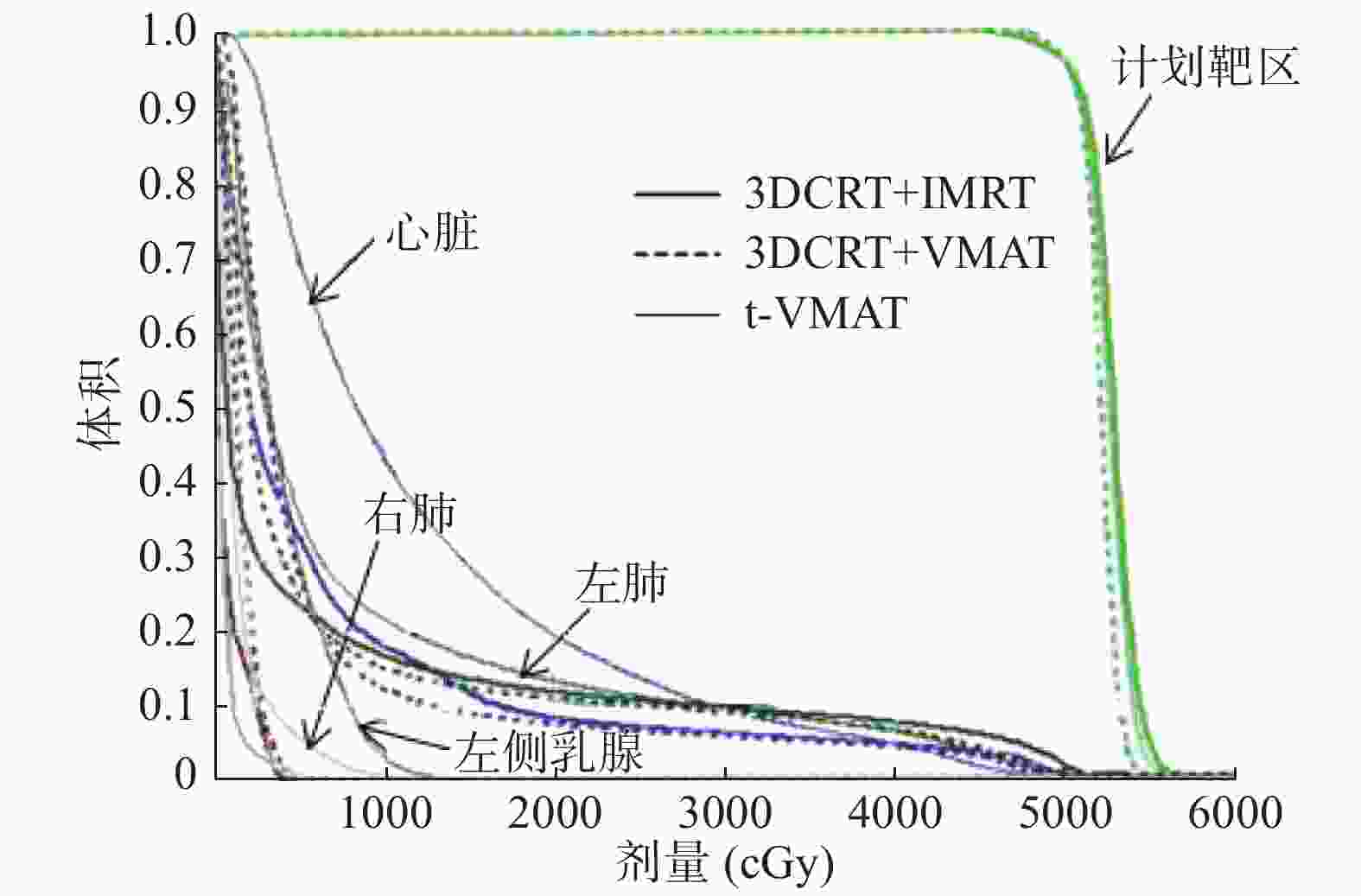
早期乳腺癌保乳术后靶区相对简单,12例患者的3种调强计划均能满足临床要求,图2是其中1例患者的3种放疗计划的剂量体积直方图比较,靶区及危及器官的受照剂量均存在一定差异。
-
由表1可知,3DCRT+VMAT的CI最大,t-VMAT次之,3DCRT+IMRT最小,3种放疗计划间两两比较,差异均有统计学意义(t=−9.01~4.28,均P<0.01) 。3DCRT+VMAT的HI最小,分别与t-VMAT和3DCRT+IMRT比较,差异均有统计学意义(t=6.47、−2.91,均P<0.05)。3DCRT+IMRT的MU最小,分别与3DCRT+VMAT和t-VMAT比较,差异均有统计学意义(t=−4.07、−3.40,均P<0.05),而3DCRT+VMAT的MU与t-VMAT比较,差异无统计学意义(t=2.14,P=0.06)。
放疗计划 CI HI MU 3DCRT+IMRT 0.74±0.06 0.14±0.03 280.90±52.18 3DCRT+VMAT 0.84±0.05a 0.10±0.03a 360.02±41.55a t-VMAT 0.79±0.06a,b 0.13±0.03b 336.57±42.34a 注:表中,a为与3DCRT+IMRT比较,差异有统计学意义(t=−9.01~6.47,均P<0.05);b为与3DCRT+VMAT比较,差异有统计学意义(t=4.28、−2.91,均P<0.05)。3DCRT+IMRT:基于固定角度适形调强放疗的混合调强;3DCRT+VMAT:基于容积旋转调强放疗的混合调强;t-VMAT:切线弧容积旋转调强;CI:适形性指数;HI:均匀性指数;MU:机器跳数 表 1 左侧乳腺癌保乳术后3种放疗计划的靶区剂量学指标 的比较(n=12,
$\bar{{x}}\pm {s}$ Table 1. Comparison of target dosimetric parameters of three radiotherapy plans after breast conserving surgery for left breast cancer(n=12,
$\bar{{x}}\pm {s}$ -
由表2可知,在患侧(左)肺受照剂量体积比较中,3DCRT+IMRT的
$ {\rm{V}}_{5}{\text{、}}{\rm{D}}_{\rm{m}\rm{e}\rm{a}\rm{n}} $ 数值最小,3DCRT+VMAT次之,t-VMAT最大,3种放疗计划间两两比较,差异均有统计学意义(t=−7.67~−2.65,均P<0.05);3DCRT+IMRT和3DCRT+VMAT的V10、V20均小于t-VMAT,且差异均有统计学意义(t=−7.02~−5.51,均 P<0.05),但3DCRT+IMRT的V10、V20与3DCRT+VMAT的比较,差异均无统计学意义(t=−2.05、1.00,均P>0.05)。在健侧(右)肺受照剂量体积比较中,3DCRT+IMRT的V5、Dmean数值最小,3DCRT+VMAT与t-VMAT之间的比较,差异均无统计学意义(t=−0.68、0.14,均P>0.05)。在心脏受照剂量体积比较中,3DCRT+VMAT的V30、V40最小,3DCRT+IMRT的Dmean最小,t-VMAT的V30、V40、Dmean均最大,3种放疗计划间两两比较,差异均有统计学意义(t=−17.11~3.45,均P<0.05)。在健侧(右)乳腺受照剂量体积比较中,3DCRT+IMRT和3DCRT+VMAT的V5小于t-VMAT,但3DCRT+VMAT与3DCRT+IMRT间的比较,差异无统计学意义(t=−1.44, P=0.18), 3DCRT+IMRT的Dmean最小,与其他两种放疗计划比较,差异均有统计学意义(t=−8.21、−6.60,均P<0.05)。放疗计划 左肺 右肺 心脏 右乳腺 V5(%) V10(%) V20(%) Dmean(Gy) V5(%) Dmean(Gy) V30(%) V40(%) Dmean(Gy) V5(%) Dmean(Gy) 3DCRT+IMRT 35.92±8.01 25.50±6.91 17.50±5.70 10.14±2.43 0.50±1.45 0.55±0.21 5.00±3.25 3.25±2.53 6.18±2.01 0.17±0.58 0.86±0.38 3DCRT+VMAT 49.33±12.05a 26.92±7.23 17.33±5.68 11.07±2.88a 2.17±3.76 1.79±0.58a 4.50±2.88a 2.50±2.11a 7.11±1.77a 1.92±4.10 1.65±0.45a t-VMAT 60.58±12.94a,b 41.25±10.37a,b 24.67±8.59a,b 14.52±3.32a,b 3.00±4.94a 1.75±0.70a 8.42±2.78a,b 4.58±2.07a,b 10.91±2.58a,b 8.25±8.61a,b 2.46±0.86a,b 注:表中,a为与3DCRT+IMRT比较,差异有统计学意义(t=−8.21~3.45,均 P<0.05);b为与3DCRT+VMAT比较,差异有统计学意义(t=−17.11~−2.73,均 P<0.05)。3DCRT+IMRT:基于固定角度适形调强放疗的混合调强;3DCRT+VMAT:基于容积旋转调强放疗的混合调强;t-VMAT:切线弧容积旋转调强;V5:≥5 Gy体积占总体积的百分比;V10:≥10 Gy体积占总体积的百分比;V20:≥20 Gy体积占总体积的百分比;Dmean:平均剂量;V30:≥30 Gy体积占总体积的百分比;V40:≥40 Gy体积占总体积的百分比 表 2 左侧乳腺癌保乳术后3种放疗计划危及器官的剂量学参数的比较(n=12,
$\bar{{x}}\pm {s}$ Table 2. Comparison of dosimetric parameters of organs at risk after breast conserving surgery for left breast cancer(n=12,
$\bar{{x}}\pm {s}$ -
早期乳腺癌保乳术后的放疗有很多种方式,基于固定角度IMRT混合调强照射技术可防止呼吸及摆位误差引起的靶区漏照,同时可保证靶区的适形性和均匀性,布野沿切线方向又可很好的保护肺和健侧乳腺,因而在临床上广泛被使用。近年来,VMAT作为一种新技术,逐渐应用于临床肿瘤放疗,有研究结果显示,其靶区剂量分布更好,还可缩短治疗时间[5],本研究采用VMAT混合调强和t-VMAT方式,研究其剂量学特点。
本研究结果显示,3种调强计划的靶区剂量分布和危及器官受量都能满足临床要求。3DCRT+VMAT在提高PTV的均匀性和适形性等方面有明显优势,PTV的均匀性越好,对皮肤和乳腺腺体组织的保护越好,可达到长期美容效果[6-7]。PTV的适形度越高,越能保证靶区足够的受照剂量,对肿瘤的控制效果更好。本研究结果发现,3DCRT+VMAT的均匀性和适形性均优于t-VMAT,我们认为可能是因为本研究中3DCRT+VMAT中VMAT部分采用从内切线野到外切线野的连续弧,考虑到本研究所有病例均为早期乳腺癌,靶区仅包括胸壁乳腺区,不带锁骨上下区,为保护健侧肺和乳腺,t-VMAT采用从内切线野到外切线野的两段部分弧。在危及器官保护方面,应尽量降低肺、心脏和健侧乳腺的受照剂量,从而减少远期心肺功能损伤、放疗并发症并降低二次致癌的发生率[8-9]。有文献报道,肺的照射体积V5、V10、V20、Dmean是放射性肺炎重要的预测性指标[10-11]。在本研究中,3DCRT+IMRT对患侧肺V5、V10、Dmean和健侧肺V5、Dmean的保护最好,3DCRT+VMAT患侧肺
$ {\mathrm{V}}_{20} $ 略优于3DCRT+IMRT,总体来说,3DCRT+IMRT在低剂量区(<20 Gy)对肺的保护占优势,在高剂量区(>20 Gy),3DCRT+VMAT占优势,而t-VMAT患侧肺的V5、V10、Dmean明显高于3DCRT+IMRT和3DCRT+VMAT,可能会增加放射性肺损伤。在左侧乳腺癌放疗中,心脏很难避免地暴露于射野内,有文献报道,控制心脏照射体积V30、V40,对减少心脏相关疾病有重要意义[12-13]。本研究结果显示,3DCRT+VMAT的心脏V30、V40明显优于3DCRT+IMRT和t-VMAT,对心脏的保护最好。乳腺癌放疗应尽量减少健侧乳腺的受照剂量,以免引发二次致癌的风险,本研究中3种放疗计划的健侧乳腺Dmean均低于2.5 Gy,可有效预防二次致癌风险,而3DCRT+IMRT对健侧乳腺的保护最好。在治疗效率方面,3DCRT+IMRT的平均MU最少,但t-VMAT的治疗时间最短,不仅提高了治疗效率和患者的舒适度,还减少了分次内体位移动、器官运动等不确定因素。综上所述,3DCRT+IMRT在低剂量区(<20 Gy)对健侧肺、患侧肺、健侧乳腺等危及器官的保护比较好,3DCRT+VMAT在提高靶区的均匀性和适形性方面有明显优势,且在高剂量区(>20 Gy)对患侧肺及心脏的保护更好,t-VMAT缩短了治疗时间,但是并没有提高靶区的均匀性和适形性,在危及器官保护方面也不占优势,而且计划设计没有考虑到呼吸运动的影响,在没有呼吸门控技术及四维锥形束CT等做图像引导的情况下,有可能造成靶区漏照。因此,对于早期左侧乳腺癌保乳术后靶区只包括胸壁乳腺区、不带锁骨上下区的放疗患者,根据不同的临床需求,本研究推荐采用3DCRT+IMRT和3DCRT+VMAT计划。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 柴林燕负责放疗计划的设计、数据的统计分析与论文的撰写;王科峰负责靶区的勾画;张晓智负责靶区的勾画与放疗计划的审核;范秋红负责数据的记录、统计与论文的审阅。
3种不同放疗技术在左侧乳腺癌保乳术后全乳腺放疗中的剂量学比较
Dosimetric comparison of three different radiotherapy techniques in whole breast radiotherapy after breast-conserving surgery for left breast cancer
-
摘要:
目的 比较3种调强放疗技术在早期左侧乳腺癌保乳术后全乳腺放疗中的剂量学差异。 方法 回顾性分析2019年3月至8月在西安交通大学第一附属医院治疗的12例早期左侧乳腺癌保乳术后女性患者,年龄32~50(42.4±6.8)岁。分别设计基于固定角度适形调强放疗的混合调强(3DCRT+IMRT)、容积旋转调强放疗的混合调强(3DCRT+VMAT)和切线弧容积旋转调强放疗计划(t-VMAT),并比较3种放疗计划的计划靶区、危及器官剂量参数以及治疗效率的差异。组间数据比较采用配对t检验。 结果 3种调强放疗计划的靶区剂量分布和危及器官受量均能满足临床要求。3DCRT+IMRT和t-VMAT两种计划相比,3DCRT+VMAT的靶区剂量学指标适形性指数(0.84±0.05对0.74±0.06对0.79±0.06)和均匀性指数(0.10±0.03对0.14±0.03对0.13±0.03)最优,差异均有统计学意义(t=−9.01~6.47,均P<0.05);3DCRT+IMRT对患侧(左)肺的V5[(35.92±8.01)%对(49.33±12.05)%对(60.58±12.94)%]、V10[(25.50±6.91)%对(26.92±7.23)%对(41.25±10.37)%]、Dmean[(10.14±2.43)Gy对(11.07±2.88)Gy对(14.52±3.32)Gy]和健侧(右)肺的V5[(0.50±1.45)%对(2.17±3.76)%对(3.00±4.94)%]、Dmean[(0.55±0.21)Gy对(1.79±0.58)Gy对1.75±0.70)Gy]及健侧(右)乳腺的V5[(0.17±0.58)%对(1.92±4.10)%对(8.25±8.61)%]、Dmean[(0.86±0.38)%对(1.65±0.45)%对(2.46±0.86)%]的保护最好。3DCRT+VMAT的心脏V30[(4.50±2.88)%对(5.00±3.25)%对(8.42±2.78)%]、V40[(2.50±2.11)%对(3.25±2.53)%对(4.58±2.07)%]明显优于3DCRT+IMRT和t-VMAT,且差异均有统计学意义(t=−17.11~3.45,均P<0.05)。3DCRT+IMRT的平均机器跳数最小(280.90±52.18),t-VMAT的治疗时间最短。 结论 3DCRT+IMRT在低剂量区(<20 Gy)对健侧肺、患侧肺,健侧乳腺等危及器官的保护比较好,3DCRT+VMAT在提高靶区的均匀性和适形性方面有明显优势,且在高剂量区(>20 Gy)对患侧肺及心脏保护更好,t-VMAT缩短了治疗时间,提高了治疗效率和患者舒适度。 -
关键词:
- 乳腺肿瘤 /
- 放射治疗计划,计算机辅助 /
- 放射疗法,调强适形 /
- 容积旋转调强放疗 /
- 剂量学
Abstract:Objective To compare the dosimetry of three different intensity-modulated radiation therapy (IMRT) techniques in patients undergoing whole-breast radiotherapy after breast-conserving surgery for early left breast cancer. Methods Between March 2019 and August 2019, 12 female patients with early left breast cancer who underwent breast-conservative surgery in the First Affiliated Hospital of Xi'an Jiaotong University were analyzed retrospectively. The patient age was between 32 and 50 years, with an average of 42.4±6.8 years. The IMRT-based hybrid plan (3D conformal radiation therapy or 3DCRT + IMRT), the volumetric modulated arc therapy (VMAT)-based hybrid plan (3DCRT+VMAT), and the tangential VMAT plan (t-VMAT) were designed. The dosimetric parameters of the target and the organs at risk and treatment efficiency were compared among the three plans, and t-test was used for data analysis. Results Both the dose distribution in the target and dose to the organs at risk can meet the clinical requirements of the three plans. The conformal index (0.84±0.05 vs. 0.74±0.06 vs. 0.79±0.06) and uniformity index (0.10±0.03 vs. 0.14±0.03 vs. 0.13±0.03) of 3DCRT+VMAT were the best, and the difference was statistically significant compared with the two other plans (t=–9.01–6.47, all P<0.05). The protective effect of 3DCRT+IMRT was the best for V5 ((35.92±8.01)% vs. (49.33±12.05)% vs. (60.58±12.94)%), V10 ((25.50±6.91)% vs. (26.92±7.23)% vs. (41.25±10.37)%), Dmean ((10.14±2.43) Gy vs. (11.07±2.88) Gy vs. (14.52±3.32) Gy) of the ipsilateral (left) lung, V5( (0.50±1.45)% vs.(2.17±3.76)% vs. (3.00±4.94)%), and Dmean ((0.55±0.21) Gy vs. (1.79±0.58) Gy vs. (1.75±0.70) Gy) of the contralateral (right) lung and the V5 ((0.17±0.58)% vs. (1.92±4.10)% vs. (8.25±8.61)%) and Dmean ((0.86±0.38) Gy vs. (1.65±0.45) Gy vs. (2.46±0.86) Gy) of the contralateral (right) breast. 3DCRT+VMAT was significantly better than 3DCRT+IMRT and t-VAMT in V30 ((4.50±2.88)% vs. (5.00±3.25)% vs. (8.42±2.78)%) and V40 ((2.50±2.11)% vs. (3.25±2.53)% vs. (4.58±2.07)%) of the heart (t=–17.11–3.45, all P<0.05). The mean monitor unit of 3DCRT+IMRT was the lowest (280.90±52.18), but the treatment time of t-VMAT was the shortest. Conclusions The protective effect of 3DCRT+IMRT in the low-dose area (<20 Gy) for the ipsilateral lung, contralateral lung, and contralateral breast was better. 3DCRT+VMAT has obvious advantages in improving the uniformity and conformability of the target area and has better protection in the high-dose area (>20 Gy) for the contralateral lung and heart. Thus, t-VMAT shortens the treatment time and improves treatment efficiency and patient comfort. -
表 1 左侧乳腺癌保乳术后3种放疗计划的靶区剂量学指标 的比较(n=12,
$\bar{{x}}\pm {s}$ Table 1. Comparison of target dosimetric parameters of three radiotherapy plans after breast conserving surgery for left breast cancer(n=12,
$\bar{{x}}\pm {s}$ 放疗计划 CI HI MU 3DCRT+IMRT 0.74±0.06 0.14±0.03 280.90±52.18 3DCRT+VMAT 0.84±0.05a 0.10±0.03a 360.02±41.55a t-VMAT 0.79±0.06a,b 0.13±0.03b 336.57±42.34a 注:表中,a为与3DCRT+IMRT比较,差异有统计学意义(t=−9.01~6.47,均P<0.05);b为与3DCRT+VMAT比较,差异有统计学意义(t=4.28、−2.91,均P<0.05)。3DCRT+IMRT:基于固定角度适形调强放疗的混合调强;3DCRT+VMAT:基于容积旋转调强放疗的混合调强;t-VMAT:切线弧容积旋转调强;CI:适形性指数;HI:均匀性指数;MU:机器跳数 表 2 左侧乳腺癌保乳术后3种放疗计划危及器官的剂量学参数的比较(n=12,
$\bar{{x}}\pm {s}$ Table 2. Comparison of dosimetric parameters of organs at risk after breast conserving surgery for left breast cancer(n=12,
$\bar{{x}}\pm {s}$ 放疗计划 左肺 右肺 心脏 右乳腺 V5(%) V10(%) V20(%) Dmean(Gy) V5(%) Dmean(Gy) V30(%) V40(%) Dmean(Gy) V5(%) Dmean(Gy) 3DCRT+IMRT 35.92±8.01 25.50±6.91 17.50±5.70 10.14±2.43 0.50±1.45 0.55±0.21 5.00±3.25 3.25±2.53 6.18±2.01 0.17±0.58 0.86±0.38 3DCRT+VMAT 49.33±12.05a 26.92±7.23 17.33±5.68 11.07±2.88a 2.17±3.76 1.79±0.58a 4.50±2.88a 2.50±2.11a 7.11±1.77a 1.92±4.10 1.65±0.45a t-VMAT 60.58±12.94a,b 41.25±10.37a,b 24.67±8.59a,b 14.52±3.32a,b 3.00±4.94a 1.75±0.70a 8.42±2.78a,b 4.58±2.07a,b 10.91±2.58a,b 8.25±8.61a,b 2.46±0.86a,b 注:表中,a为与3DCRT+IMRT比较,差异有统计学意义(t=−8.21~3.45,均 P<0.05);b为与3DCRT+VMAT比较,差异有统计学意义(t=−17.11~−2.73,均 P<0.05)。3DCRT+IMRT:基于固定角度适形调强放疗的混合调强;3DCRT+VMAT:基于容积旋转调强放疗的混合调强;t-VMAT:切线弧容积旋转调强;V5:≥5 Gy体积占总体积的百分比;V10:≥10 Gy体积占总体积的百分比;V20:≥20 Gy体积占总体积的百分比;Dmean:平均剂量;V30:≥30 Gy体积占总体积的百分比;V40:≥40 Gy体积占总体积的百分比 -
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: Cancer J Clin, 2018, 368: 394−424. DOI: 10.3322/caac.21492. [2] Sakka M, Kunzelmann L, Metzger M, et al. Cardiac dose-sparing effects of deep-inspiration breath-hold in left breast irradiation: Is IMRT more beneficial than VMAT?[J]. Strahlenther Onkol, 2017, 193(10): 800−811. DOI: 10.1007/s00066-017-1167-0. [3] Thomsen MS, Harrov U, Fledelius W, et al. Inter-and intra-fraction geometric errors in daily image-guided radiotherapy of free-breathing breast cancer patients measured with continuous portal imaging[J]. Acta Oncol, 2014, 53(6): 802−808. DOI: 10.3109/0284186X.2014.905700. [4] Singla R, King S, Albuquerque K, et al. Simultaneous-integrated boost intensity-modulated radiation therapy (SIB-IMRT) in the treatment of early-stage left-sided breast carcinoma[J]. Med Dosim, 2006, 31(3): 190−196. DOI: 10.1016/j.meddos.2005.11.001. [5] Popescu CC, Olivotto IA, Beckham WA, et al. Volumetric modulated arc therapy improves dosimetry and reduces treatment time compared to conventional intensity-modulated radiotherapy for locoregional radiotherapy of left-sided breast cancer and internal mammary nodes[J]. Int J Radiat Oncol Biol Phys, 2010, 76(1): 287−295. DOI: 10.1016/j.ijrobp.2009.05.038. [6] Tortorelli G, Di MurroL, Barbarino R, et al. Standard or hypofractionated radiotherapy in the postoperative treatment of breast cancer: a retrospective analysis of acute skin toxicity and dose inhomogeneities[J]. BMC Cancer, 2013, 13: 230. DOI: 10.1186/1471-2407-13-230. [7] Limbergen EV, Rijnders A, der Schueren EV, et al. Cosmetic evaluation of breast conserving treatment for mammary cancer. 2. A quantitative analysis of the influence of radiation dose, fractionation schedules and surgical treatment techniques on cosmetic results[J]. Radiother Oncol, 1989, 16(4): 253−267. DOI: 10.1016/0167-8140(89)90037-6. [8] Preston DL, Pierce DA, Shimizu Y, et al. Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates[J]. Radiat Res, 2004, 162(4): 37−389. DOI: 10.1667/rr3232. [9] Bahig H, Roussin É, Yassa M, et al. Partial kilovoltage cone beam computed tomography, complete kilovoltage cone beam computed tomography, and electronic portal images for breast radiation therapy: A dose-comparison study[J]. Pract Radiat Oncol, 2015, 5(5): e521−e529. DOI: 10.1016/j.prro.2015.02.009. [10] Yorke ED, Jackson A, Rosenzweig KE, et al. Correlation of dosimetric factors and radiation pneumonitis for non-small-cell lung cancer patients in a recently completed dose escalation study[J]. Int J Radiat Oncol Biol Phys, 2005, 63(3): 672−682. DOI: 10.1016/j.ijrobp.2005.03.026. [11] Marks LB, Bentzen SM, Deasy JO, et al. Radiation dose-volume effects in the lung[J]. Int J Radiat Oncol Biol Phys, 2010, 76(3 Suppl): S70−S76. [12] Abdel-Qadir H, Austin PC, Lee DS, et al. A population-based study of cardiovascular mortality following early-stage breast cancer[J]. JAMA Cardio, 2017, 2(1): 88−93. DOI: 10.1001/jamacardio.2016.3841. [13] Jacobse JN, Duane FK, Boekel NB, et al. Radiation dose response for risk of myocardial infarction in breast cancer survivors[J]. Int J Radiat Oncol Biol Phys, 2019, 103(3): 595−604. DOI: 10.1016/j.ijrobp.2018.10.025. -





 下载:
下载: