-
肺动脉高压(pulmonary arterial hypertension, PAH)是一种病因复杂多样的肺血管疾病,其发病常累及右心室,右心室的衰竭是导致患者病死的主要原因[1]。在PAH发展进程中,右心室功能经历从代偿到失代偿的过程。在这一过程中,PAH患者除了心室结构和功能改变之外,其右心室心肌的代谢方式也由脂肪酸氧化供能向糖酵解供能转化[2]。有研究发现,右心室心肌18F-FDG摄取与PAH的严重程度有关,采用18F-FDG PET评估右心室心肌的葡萄糖摄取情况,对PAH患者的预后具有重要意义[3-4]。然而PAH分类复杂,其中动脉型PAH包括特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)和先天性心脏病相关肺动脉高压(pulmonary arterial hypertension related to congenital heart disease,PAH-CHD)等。不同类型PAH的病理生理机制不同。不同类型PAH患者右心室心肌葡萄糖代谢的比较研究较少,尤其关于PAH-CHD右心室心肌葡萄糖代谢的研究更少,且均采用半定量指标测量右心室和(或)左心室心肌的18F-FDG摄取率[5]。本研究应用动态18F-FDG PET心肌代谢显像,采用绝对定量的葡萄糖代谢指标心肌葡萄糖利用率(rate of myocardium glucose utilization,rMGU),比较IPAH与PAH-CHD 2组患者右心室心肌葡萄糖代谢的差异,及其与右心导管检测的血流动力学指标的相关性。
-
选取2016年11月至2018年12月在中国医学科学院北京协和医学院阜外医院经右心导管检查确诊的IPAH患者26例(IPAH组),其中男性9例、女性17例,年龄(28.23±8.92)岁;PAH-CHD患者16例(PAH-CHD组),其中男性6例、女性10例,年龄(29.19±10.62)岁。IPAH和PAH-CHD患者的纳入标准:经右心导管检查,静息状态下平均肺动脉压力(mean pulmonary artery pressure, mPAP)≥25 mm Hg (1 mm Hg=0.133 kPa)。PAH-CHD患者检查前均未行先天性心脏病矫正手术治疗。排除标准:患者糖耐量异常;患有糖尿病、冠心病、心肌病和心脏瓣膜病等。
所有患者均于检查前签署了知情同意书。本研究获得了中国医学科学院北京协和医学院阜外医院伦理学委员会的批准(批准号:NCT03554330)。
-
使用德国西门子医疗集团有限公司生产的Truepoint Biography 64型PET仪。18F-FDG由北京原子高科股份有限公司提供,放射化学纯度≥95%。显像前患者禁食至少8 h,空腹血糖<7.0 mmol/L。患者仰卧于检查床上,建立静脉通道。先进行CT扫描(140 kV,35 mA)用于心脏定位和衰减校正。随后快速向患者静脉注射18F-FDG以进行动态PET显像,剂量为185 MBq(5 mCi)。动态PET显像共采集60 min,列表模式采集。显像结束后,将PET采集的数据分为33帧连续图像(12×5 s、4×15 s、6×20 s和11×300 s)。采用CT数据进行衰减校正。图像重建采用迭代有序子集最大期望值法(OSEM),4次迭代,8个子集,矩阵256×256,重建放大倍数1.3。由2名具有6年以上工作经验的核医学科医师在PET图像上勾画患者右心室和左心室游离壁作为ROI,得到右心室和左心室心肌的时间-放射性活度曲线。采用Patlak法和空腹血糖水平,计算得到右心室和左心室的心肌葡萄糖净摄取率(Ki)和rMGU,集总常数采用0.67[6]。计算公式:rMGU= Ki×空腹血糖值×0.67。
-
动态18F-FDG PET心肌代谢显像后1周内,所有患者均行右心导管检查。测定的血流动力学参数包括mPAP、收缩期肺动脉压力(pulmonary artery pressure,PAP)和舒张期PAP。采用Fick法[7]计算肺循环血流量(Qp)、体循环血流量(Qs)、Qp与Qs的比值(Qp/Qs)和肺血管阻力(pulmonary vascular resistance, PVR)。
-
应用SPSS 22.0软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar{x}\pm s$ 表示,方差齐的2组数据比较采用独立样本t检验;计数资料组间比较采用Fish's确切概率法。采用Pearson相关分析对2组数据的相关性进行分析。P<0.05为差异有统计学意义。 -
由表1可知,PAH-CHD组患者包括房间隔缺损6例、室间隔缺损5例、动脉导管未闭3例、房间隔缺损合并动脉导管未闭1例、室间隔缺损合并动脉导管未闭1例。PAH-CHD组患者的Qp/Qs为1.78±0.81。IPAH组和PAH-CHD组患者的mPAP和PVR之间的差异均无统计学意义(均P>0.05,表1)。
临床资料 IPAH组(n=26) PAH-CHD组(n=16) 检验值 P值 年龄(岁) 28.23±8.92 29.19±10.62 t=0.31 0.75 男性/女性(例) 9/17 6/10 − 0.85 空腹血糖(mmol/L) 4.46±0.64 4.73±0.75 t=1.23 0.23 纽约心功能分级 Ⅰ/Ⅱ/Ⅲ/Ⅳ(例) 0/15/9/2 3/7/6/0 − − LVEF(%) 56.26±12.17 61.44±9.35 t=1.45 0.15 Qp/Qs − 1.78±0.81 − − 先天性心脏病类型 ASD/VSD/PDA/ASD合并PDA/VSD合并PDA(例) − 6/5/3/1/1 − − mPAP(mm Hg) 59.85±16.46 69.75±18.93 t=1.79 0.81 DPAP(mm Hg) 42.73±14.47 51.81±17.91 t=−1.80 0.08 SPAP(mm Hg) 89.27±23.39 100.19±23.29 t=−1.48 0.15 PVR(Wood 单位) 13.45±7.42 10.86±4.45 t=−1.26 0.22 右心室 rMGU(μmol·g−1·min−1) 0.095±0.074 0.135±0.165 t=1.07 0.29 左心室 rMGU(μmol·g−1·min−1) 0.057±0.065 0.070±0.047 t=0.77 0.49 注:IPAH为特发性肺动脉高压;PAH-CHD为先天性心脏病相关肺动脉高压;LVEF为左心室射血分数;Qp/Qs为肺循环血流量与体循环血流量的比值;ASD为房间隔缺损;VSD为室间隔缺损;PDA为动脉导管未闭;mPAP为平均肺动脉压力;DPAP为舒张期肺动脉压力;SPAP为收缩期肺动脉压力;PVR为肺血管阻力;rMGU为心肌葡萄糖利用率。− 表示无此项数据。1 mm Hg=0.133 kPa 表 1 2组患者的临床资料
Table 1. Clinical characteristics of two group patients
-
动态18F-FDG PET心肌代谢显像测得的IPAH组和PAH-CHD 组患者右心室rMGU 之间的差异均无统计学意义(均 P>0.05,表1)。典型病例的动态18F-FDG PET显像图见图1。

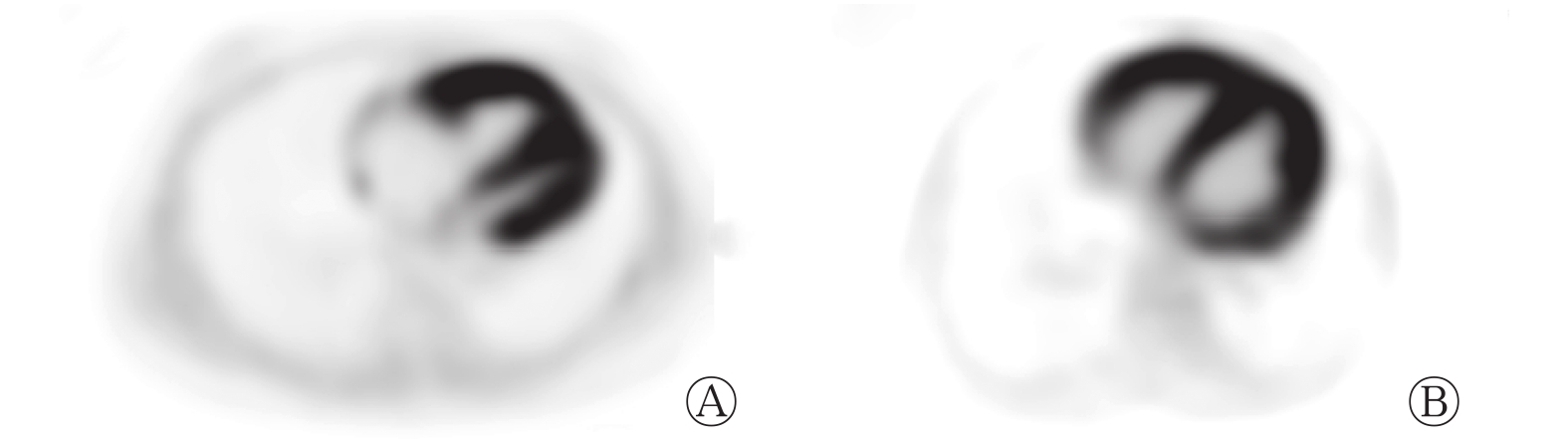
图 1 特发性肺动脉高压患者(A)和先天性心脏病相关肺动脉高压患者(B)右心室长轴动态18F-FDG PET显像图
Figure 1. The representative long-axis slices from 18F-FDG PET images of patient with idiopathic pulmonary arterial hypertension (A, male, 26 years old) and patient with pulmonary arterial hypertension related to congenital heart disease (B, female, 29 years old)
-
IPAH组患者右心室的rMGU与mPAP存在正相关(图2 A),与PVR无相关性(图2 B);左心室的rMGU与mPAP、PVR均无相关性(r=0.173,P=0.400;r=0.062,P=0.770)。PAH-CHD组患者右心室的rMGU与mPAP、PVR均无相关性(图2 C、D);左心室的rMGU与mPAP、PVR也均无相关性(r=0.079,P=0.772;r=−0.247,P=0.357)。
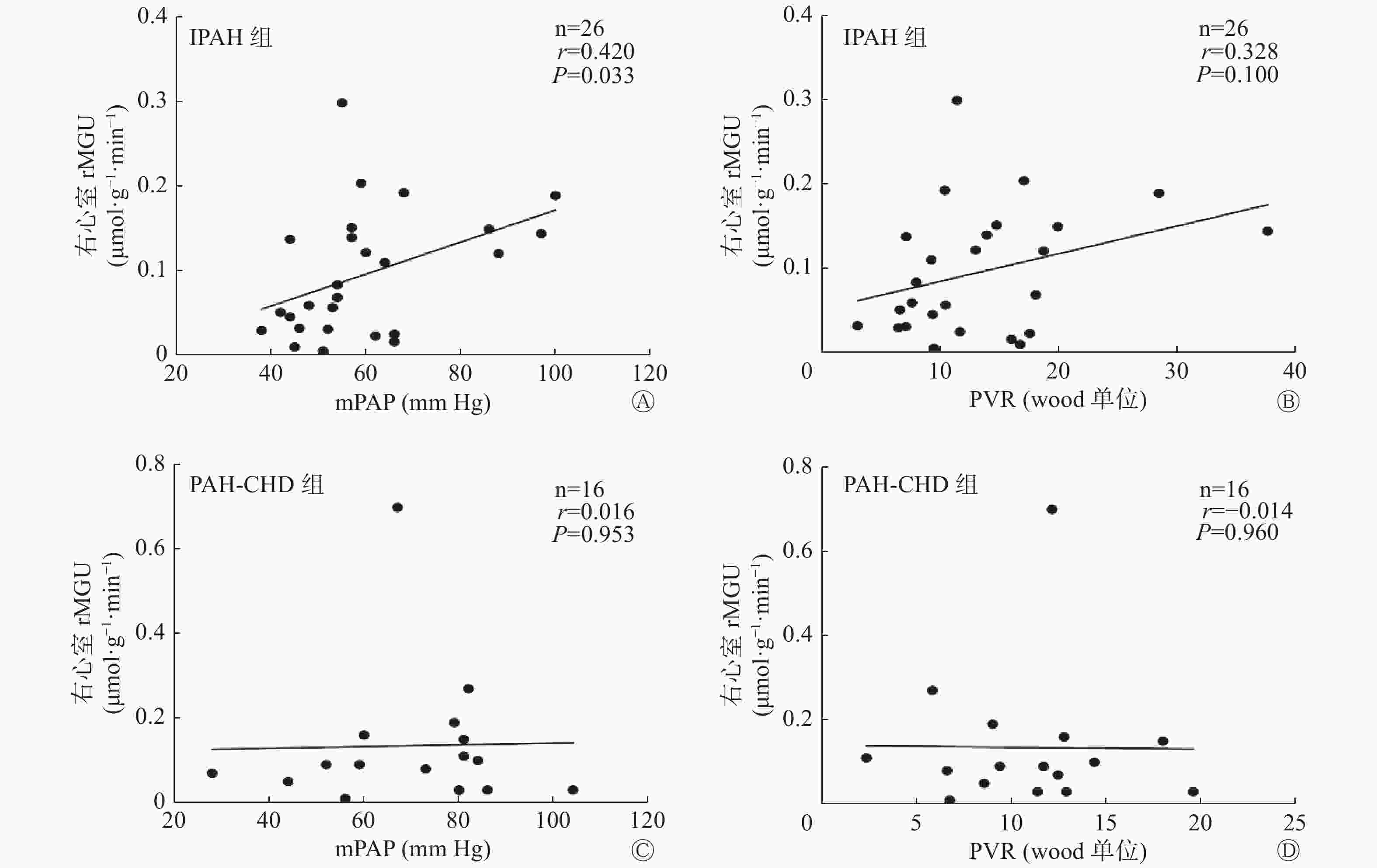
图 2 IPAH组和PAH-CHD组患者右心室rMGU与mPAP(A、C)和PVR(B、D)相关性分析的散点图
Figure 2. Scatter plot of correlation analysis between right ventricular rate of myocardium glucose utilization and mean pulmonary artery pressure (A, C) and pulmonary vascular resistance (B, D) in idiopathic pulmonary arterial hypertension and pulmonary arterial hypertension related to congenital heart disease
-
PAH是一种以进行性肺血管重构为特征的疾病,右心室功能是影响PAH患者预后的主要因素[8]。随着疾病的进展,在右心室重构过程中,心肌能量代谢的方式由脂肪酸氧化供能转变为糖酵解供能,脂肪酸氧化代谢随之降低[9]。18F-FDG作为一种葡萄糖类似物,可以被心肌细胞吸收,但其进入细胞后不能被进一步利用,而是聚集在细胞内作为示踪剂,从而反映心肌细胞对葡萄糖的摄取[10]。在本研究中我们发现,IPAH患者右心室的rMGU与mPAP存在正相关,与之前的研究结果一致[5]。Oikawa 等[11]的研究结果表明,IPAH患者右心室游离壁18F-FDG 的SUV增加,并且发现其与右心室负荷的严重程度有关。此外一些研究结果显示,IPAH患者右心室心肌18F-FDG 的SUV与6 min步行试验距离、mPAP、PVR以及三尖瓣环收缩期位移、Tei指数等功能指标相关[5-6, 12-14]。Can等[15]研究发现,PAH患者右心室/左心室心肌葡萄糖摄取率与收缩期PAP呈线性相关,与PVR、mPAP无相关性。综上研究结果表明,右心室心肌18F-FDG摄取具有评估患者PAH严重程度的潜力。
值得注意的是,以往的研究很少涉及不同类型PAH患者右心室代谢的比较。Fang等[5]研究结果发现,IPAH患者与PAH-CHD患者右心室、左心室的心肌葡萄糖摄取率的差异无统计学意义。IPAH患者右心室/左心室心肌18F-FDG摄取率与mPAP和PVR均呈正相关;而PAH-CHD患者右心室/左心室18F-FDG摄取率仅与PVR相关。在本研究中,PAH-CHD组和IPAH组患者右心室的rMGU差异无统计学意义,且IPAH组患者右心室的rMGU与mPAP存在相关性,与Fang等[5]的研究结果一致。但在本研究中,PAH-CHD患者右心室的rMGU与PVR及mPAP均无相关性。其原因可能是本研究纳入的PAH-CHD患者均未行心脏根治手术并且采用右心室的rMGU作为指标。而在Fang等[5]的研究中,所有PAH-CHD患者在检查前均行心脏外科根治术,且采用的半定量指标是右心室/左心室心肌18F-FDG摄取率[5]。由于IPAH与PAH-CHD的病理生理机制不同,IPAH患者心脏结构完整,随着疾病的进展,PVR增加,右心室受累逐渐加重,rMGU增高;而PAH-CHD患者早期存在左向右分流,右心室前负荷增加,右心室受累,随着疾病的进展,可出现双向分流或者右向左分流,右心室前负荷较之前减少,这可能是导致PAH-CHD患者右心室的rMGU与PVR、mPAP无相关性的原因。
本研究通过对右心室和左心室心肌葡萄糖摄取的绝对定量测量,结果发现,PAH患者以右心室心肌葡萄糖代谢增高为主,而左心室心肌葡萄糖代谢水平变化不明显。然而,本研究还存在一些不足:作为初步的探索性研究,样本量较小,研究结论还需要更大规模的前瞻性研究证实;此外,仅研究了IPAH和PAH-CHD 2种类型的PAH,还需要对更多类型进行深入的探讨。
综上所述,应用动态18F-FDG PET心肌代谢显像,可以绝对定量检测PAH患者右心室和左心室心肌葡萄糖的摄取情况,能够在一定程度上反映IPAH的严重程度,mPAP无差异的IPAH 和PAH-CHD患者右心室的心肌葡萄糖代谢水平无明显差异。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 王歆惠负责数据的统计与分析、论文的撰写;汪蕾负责研究方案的设计、论文撰写的指导;方纬负责入组病例的提供与分析;闫朝武负责病例的收集与整理、论文的审阅。
特发性肺动脉高压与先天性心脏病相关肺动脉高压患者右心室心肌葡萄糖代谢的比较研究
A comparative study of right ventricular glucose metabolism between patients with idiopathic pulmonary arterial hypertension and pulmonary arterial hypertension related to congenital heart disease
-
摘要:
目的 比较分析特发性肺动脉高压(IPAH)与先天性心脏病相关肺动脉高压(PAH-CHD)患者右心室心肌葡萄糖代谢的差异。 方法 选取2016年11月至2018年12月在中国医学科学院北京协和医学院阜外医院确诊的26例IPAH患者(IPAH组)[女性17例、男性9例,年龄(28.23±8.92)岁] 和16例PAH-CHD患者(PAH-CHD组) [女性10例、男性6例,年龄(29.19±10.62)岁]。所有患者均行动态18F-FDG PET心肌代谢显像,根据Patlak法计算得出右心室和左心室心肌葡萄糖利用率(rMGU)。显像后1周内患者接受右心导管检查,测定血流动力学指标。采用独立样本t检验比较2组的rMGU等指标;采用Pearson相关分析对2组患者右心室的rMGU与平均肺动脉压力(mPAP)或肺血管阻力的相关性进行分析。 结果 IPAH组与PAH-CHD组患者mPAP之间的差异无统计学意义 [(59.85±16.46) mm Hg 对(69.75±18.93) mm Hg,t=1.79,P=0.81](1 mm Hg=0.133 kPa)。动态18F-FDG PET心肌代谢显像测得的2组患者右心室rMGU[(0.095±0.074) μmol·g−1·min−1 对(0.135±0.165) μmol·g−1·min−1]与左心室rMGU[(0.057±0.065) μmol·g−1·min−1 对(0.070±0.047) μmol·g−1·min−1] 之间的差异均无统计学意义(t=1.07, P=0.29;t=0.77,P=0.49)。IPAH组患者右心室的rMGU与mPAP存在正相关(r=0.420,P=0.033),但PAH-CHD组患者右心室的rMGU与mPAP无相关性(r=0.016,P=0.953)。 结论 mPAP无差异的IPAH和 PAH-CHD患者右心室心肌葡萄糖代谢水平无明显差异。 -
关键词:
- 肺动脉高压 /
- 正电子发射断层显像术 /
- 心肌代谢显像 /
- 心肌葡萄糖利用率 /
- 先天性心脏病
Abstract:Objective To analyze the glucose metabolism of right ventricle between patients with idiopathic pulmonary arterial hypertension (IPAH) and patients with pulmonary arterial hypertension related to congenital heart disease (PAH-CHD). Methods From November 2016 to December 2018, 26 patients with IPAH (the IPAH group) (17 females, 9 males, 28.23±8.92 years old) and 16 patients with PAH-CHD (the PAH-CHD group) (10 females, 6 males, 29.19±10.62 years old) diagnosed in Fuwai Hospital, Chinese Academy of Medical Sciences, Peking Union Medical College were enrolled and underwent dynamic 18F-FDG PET myocardial metabolic imaging. The rate of myocardium glucose utilization (rMGU) of both the right and left ventricles was quantified via Patlak analysis. Within 1 week, right heart catheterization was performed in all subjects to evaluate pulmonary hemodynamic parameters. rMGU and other parameters were compared via independent sample t test. The relationship between rMGU and pulmonary vascular resistance and mean pulmonary artery pressure (mPAP) in the two groups of patients was analyzed via Pearson correlation analysis. Results No significant difference in mPAP was observed between patients in IPAH group and PAH-CHD group ((59.85±16.46) mm Hg) vs. (69.75±18.93) mm Hg, t=1.79, P=0.81) (1 mm Hg=0.133 kPa). The right ventricular rMGU of patients in PAH-CHD group was not significantly different from that of patients in IPAH group ((0.135±0.165) μmol·g−1·min−1 vs. (0.095±0.074) μmol·g−1·min−1, t=1.07, P=0.29). Similarly, the left ventricular rMGU between the former ((0.070±0.047) μmol·g−1·min−1) and the latter ((0.057±0.065) μmol·g−1·min−1) was not significantly different (t=0.77, P=0.49). The right ventricular rMGU was significantly correlated with mPAP in patients with IPAH (r=0.420, P=0.033), but not in patients with PAH-CHD (r=0.016, P=0.953). Conclusion In patients with PAH-CHD and IPAH with no difference in mPAP, no significant difference in rMGU was found in both the right ventricles. -
图 1 特发性肺动脉高压患者(A)和先天性心脏病相关肺动脉高压患者(B)右心室长轴动态18F-FDG PET显像图
Figure 1. The representative long-axis slices from 18F-FDG PET images of patient with idiopathic pulmonary arterial hypertension (A, male, 26 years old) and patient with pulmonary arterial hypertension related to congenital heart disease (B, female, 29 years old)
图 2 IPAH组和PAH-CHD组患者右心室rMGU与mPAP(A、C)和PVR(B、D)相关性分析的散点图
Figure 2. Scatter plot of correlation analysis between right ventricular rate of myocardium glucose utilization and mean pulmonary artery pressure (A, C) and pulmonary vascular resistance (B, D) in idiopathic pulmonary arterial hypertension and pulmonary arterial hypertension related to congenital heart disease
表 1 2组患者的临床资料
Table 1. Clinical characteristics of two group patients
临床资料 IPAH组(n=26) PAH-CHD组(n=16) 检验值 P值 年龄(岁) 28.23±8.92 29.19±10.62 t=0.31 0.75 男性/女性(例) 9/17 6/10 − 0.85 空腹血糖(mmol/L) 4.46±0.64 4.73±0.75 t=1.23 0.23 纽约心功能分级 Ⅰ/Ⅱ/Ⅲ/Ⅳ(例) 0/15/9/2 3/7/6/0 − − LVEF(%) 56.26±12.17 61.44±9.35 t=1.45 0.15 Qp/Qs − 1.78±0.81 − − 先天性心脏病类型 ASD/VSD/PDA/ASD合并PDA/VSD合并PDA(例) − 6/5/3/1/1 − − mPAP(mm Hg) 59.85±16.46 69.75±18.93 t=1.79 0.81 DPAP(mm Hg) 42.73±14.47 51.81±17.91 t=−1.80 0.08 SPAP(mm Hg) 89.27±23.39 100.19±23.29 t=−1.48 0.15 PVR(Wood 单位) 13.45±7.42 10.86±4.45 t=−1.26 0.22 右心室 rMGU(μmol·g−1·min−1) 0.095±0.074 0.135±0.165 t=1.07 0.29 左心室 rMGU(μmol·g−1·min−1) 0.057±0.065 0.070±0.047 t=0.77 0.49 注:IPAH为特发性肺动脉高压;PAH-CHD为先天性心脏病相关肺动脉高压;LVEF为左心室射血分数;Qp/Qs为肺循环血流量与体循环血流量的比值;ASD为房间隔缺损;VSD为室间隔缺损;PDA为动脉导管未闭;mPAP为平均肺动脉压力;DPAP为舒张期肺动脉压力;SPAP为收缩期肺动脉压力;PVR为肺血管阻力;rMGU为心肌葡萄糖利用率。− 表示无此项数据。1 mm Hg=0.133 kPa -
[1] Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension: the joint task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT)[J]. Eur Heart J, 2016, 37(1): 67−119. DOI: 10.1093/eurheartj/ehv317. [2] Ohira H, deKemp R, Pena E, et al. Shifts in myocardial fatty acid and glucose metabolism in pulmonary arterial hypertension: a potential mechanism for a maladaptive right ventricular response[J]. Eur Heart J Cardiovasc Imaging, 2016, 17(12): 1424−1431. DOI: 10.1093/ehjci/jev136. [3] Shrestha U, Sciammarella M, Alhassen F, et al. Measurement of absolute myocardial blood flow in humans using dynamic cardiac SPECT and 99mTc-tetrofosmin: method and validation[J]. J Nucl Cardiol, 2017, 24(1): 268−277. DOI: 10.1007/s12350-015-0320-3. [4] Saygin D, Highland KB, Farha S, et al. Metabolic and functional evaluation of the heart and lungs in pulmonary hypertension by gated 2-[18F]-fluoro-2-deoxy-D-glucose positron emission tomography[J]. Pulm Circ, 2017, 7(2): 428−438. DOI: 10.1177/2045893217701917. [5] Fang W, Zhao L, Xiong CM, et al. Comparison of 18F-FDG uptake by right ventricular myocardium in idiopathic pulmonary arterial hypertension and pulmonary arterial hypertension associated with congenital heart disease[J]. Pulm Circ, 2012, 2(3): 365−372. DOI: 10.4103/2045-8932.101651. [6] Wang L, Li W, Yang Y, et al. Quantitative assessment of right ventricular glucose metabolism in idiopathic pulmonary arterial hypertension patients: a longitudinal study[J]. Euro Heart J Cardiovasc Imaging, 2016, 17(10): 1161−1168. DOI: 10.1093/ehjci/jev297. [7] Yan CW, Pan XB, Wan LY, et al. Combination of F-ASO and targeted medical therapy in patients with secundum ASD and severe PAH[J]. JACC Cardiovasc Interv, 2020, 13(17): 2024−2034. DOI: 10.1016/j.jcin.2020.04.027. [8] Vonk-Noordegraaf A, Haddad F, Chin KM, et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology[J]. J Am Coll Cardiol, 2013, 62(25 Suppl): SD22−D33. DOI: 10.1016/j.jacc.2013.10.027. [9] Graham BB, Kumar R, Mickael C, et al. Severe pulmonary hypertension is associated with altered right ventricle metabolic substrate uptake[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(5): L435−L440. DOI: 10.1152/ajplung.00169.2015. [10] Marsboom G, Wietholt C, Haney CR, et al. Lung 18F-fluorodeoxyglucose positron emission tomography for diagnosis and monitoring of pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2012, 185(6): 670−679. DOI: 10.1164/rccm.201108-1562OC. [11] Oikawa M, Kagaya Y, Otani H, et al. Increased [18F]fluorodeoxyglucose accumulation in right ventricular free wall in patients with pulmonary hypertension and the effect of epoprostenol[J]. J Am Coll Cardiol, 2005, 45(11): 1849−1855. DOI: 10.1016/j.jacc.2005.02.065. [12] Kazimierczyk R, Szumowski P, Nekolla SG, et al. Prognostic role of PET/MRI hybrid imaging in patients with pulmonary arterial hypertension[J]. Heart, 2021, 107(1): 54−60. DOI: 10.1136/heartjnl-2020-316741. [13] Tatebe S, Fukumoto Y, Oikawa-Wakayama M, et al. Enhanced [18F]fluorodeoxyglucose accumulation in the right ventricular free wall predicts long-term prognosis of patients with pulmonary hypertension: a preliminary observational study[J]. Eur Heart J Cardiovasc Imaging, 2014, 15(6): 666−672. DOI: 10.1093/ehjci/jet276. [14] Yang T, Wang L, Xiong CM, et al. The ratio of 18F-FDG activity uptake between the right and left ventricle in patients with pulmonary hypertension correlates with the right ventricular function[J]. Clin Nucl Med, 2014, 39(5): 426−430. DOI: 10.1097/RLU.0000000000000422. [15] Can MM, Kaymaz C, Tanboga IH, et al. Increased right ventricular glucose metabolism in patients with pulmonary arterial hypertension[J]. Clin Nucl Med, 2011, 36(9): 743−748. DOI: 10.1097/RLU.0b013e3182177389. -





 下载:
下载: