-
间充质干细胞(mesenchymal stem cells,MSCs)能自主地聚集到肿瘤组织的间质,并分化为多种肿瘤间质相关的细胞,如脉管系统相关的内皮细胞、间质成纤维细胞样细胞等。正是由于存在这种内在的肿瘤归巢特性,MSCs成为理想的肿瘤靶向递送载体,近年来以MSCs作为载体对肿瘤进行靶向治疗已成为研究热点[1-5]。MSCs作为递送载体作用非常重要,从MSCs归巢至肿瘤组织的时间和空间分布关系到其是否能完成靶向治疗,这就需要实时、动态掌握MSCs在体内的运行状态,因此分子影像示踪MSCs具有重要的研究意义。骨髓起源的MSCs表面表达多种抗原,如CD90、CD73和CD105等[6]。本研究使用125I标记CD90单克隆抗体(monoclonal antibody,mAb)进行体外、体内实验,探讨125I-CD90 mAb示踪MSCs的可能性。
-
CD90 mAb(规格:1 mg/mL)购自江苏睿捷生物科技有限公司。Na125I溶液(规格:100 mCi/50~100 μL)购自加拿大Mcmaster大学。氯胺T购自国药集团化学试剂有限公司,偏重亚硫酸钠购自江苏强盛功能化学股份有限公司。小鼠骨髓MSCs购自赛业生物科技有限公司,乳腺癌MCF-7细胞株购自美国模式培养物研究所。Micro-SPECT/CT成像系统(U-SPECT/CT型)购自荷兰MILabs公司,放射性核素活度计(CRC-55tR型)购自美国Capintec公司,γ计数仪(GC-2016型)购自中科中佳科学仪器有限公司,PD10纯化柱购自美国GE公司。
雌性无特定病原体级BALB/c裸鼠20只,4~6周龄,体重(20.0±0.8)g,由昭衍(苏州)新药研究中心有限公司提供,许可证号:SCXK(苏)2018-0006。饲养于无特定病原体级动物房,控制室内温度在23℃左右,相对湿度保持在40%~70%,裸鼠随意采食全价鼠饲料及清洁水。
-
采用氯胺T法对CD90 mAb进行125I标记。取CD90 mAb原液50 μL,加入200 μL(0.02 mol/L)PBS(pH=7.4)和50 μL Na125I溶液,混匀,加入20 μL氯胺T溶液(5 mg/mL),室温下在混匀器上反应50 s,加入150 μL偏重亚硫酸钠溶液(5 mg/mL),继续反应5 min,用PD10柱分离纯化,洗脱液为含0.1%牛血清白蛋白的PBS(0.02 mol/L,pH=7.4),每管收集0.5 mL,观察其颜色、透明度,测定每管放射性活度,计算标记率,采用纸层析法对标记产物进行纯度鉴定。
-
计数MSCs并调整细胞浓度为4.0×104个/mL,使用1.5 mL的离心管,根据设定的不同的时间点(10 min、30 min、1 h、2 h、6 h和8 h)分为6组,每组6个复孔,共36个离心管。每管加入100 μL的MSCs悬浮液,然后加入3.7×103 Bq/2 μL的125I-CD90 mAb,每隔15 min摇晃一下。于每个时间点2500×g离心5 min,取上清液,加入1 mL的PBS,再离心取上清液,然后加入500 μL的PBS,吹起沉淀细胞。将所有上清液存于放免管中,记为上清液管(F),将吹起的沉淀细胞存于另一个放免管中,记为细胞管(B),用γ计数仪分别检测上清液管(F)和细胞管(B)的放射性计数,根据公式B/(B+F)×100%,计算125I-CD90 mAb与MSCs的细胞结合率。将乳腺癌MCF-7细胞作为对照,按上述同样的步骤进行实验并计算125I-CD90 mAb分别与MCF-7、MSCs的细胞结合率。
-
将乳腺癌MCF-7细胞株进行常规培养扩增,在接种前1天换新鲜培养基,弃去培养瓶中的培养基,用PBS洗2次,加入1 mL含乙二胺四乙酸的0.25%胰酶进行消化,轻拍培养瓶,使细胞脱落,然后加入完全培养基终止消化,800 r/min(离心半径15 cm)离心5 min,将细胞(1×107个/mL)重悬于无血清培养基中。于BALB/c裸鼠的右侧腋下接种乳腺癌MCF-7细胞0.1 mL,待肿瘤长至150~200 mm3时用于实验。采用完全随机法将荷瘤裸鼠分为a、b、c、d组,每组3只荷瘤裸鼠,a组经腹腔注射MSCs(1×106个/0.3 mL);b组经腹腔注射相同体积的生理盐水;c组经瘤内注射MSCs(数量、体积同a组),d组经瘤内注射相同体积的生理盐水,然后每只荷瘤裸鼠经尾静脉注射125I-CD90 mAb(3.7 MBq/0.2 mL),分别于6 h、1 d、2 d、3 d后进行Micro-SPECT/CT显像,参数:矩阵129×129、能峰30 keV、窗宽60%、准直器针孔2.0 mm、重建分辨率< 0.9 mm、灵敏度> 13 000 cps/MBq、电压55 kV、电流615 mA,层厚0.8 mm。采集方式为静态10 min SPECT、中分辨率全身CT,通过仪器自带PMOD软件测定并计算肿瘤及主要器官和组织的放射性摄取值[每克组织百分注射剂量率(percentage activity of injection dose per gram of tissue, %ID/g)]。
-
使用SPSS 17.0软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar x \pm s$ 表示,2组均数之间的比较采用独立样本t检验(方差齐)。P<0.05为差异有统计学意义。 -
合成的125I-CD90 mAb溶液无色、透明,标记率为54.4%,放射化学纯度为98.79%。
-
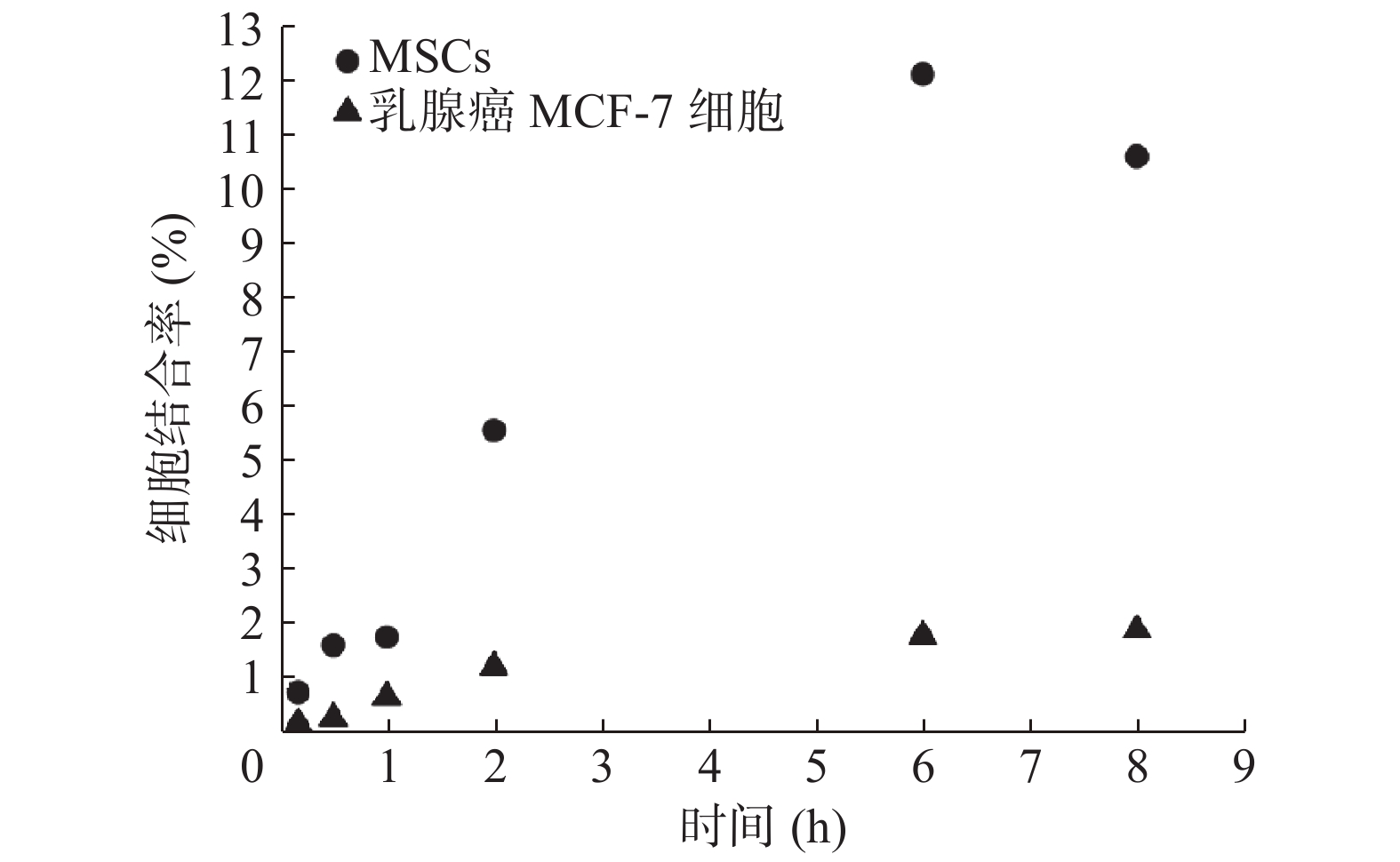
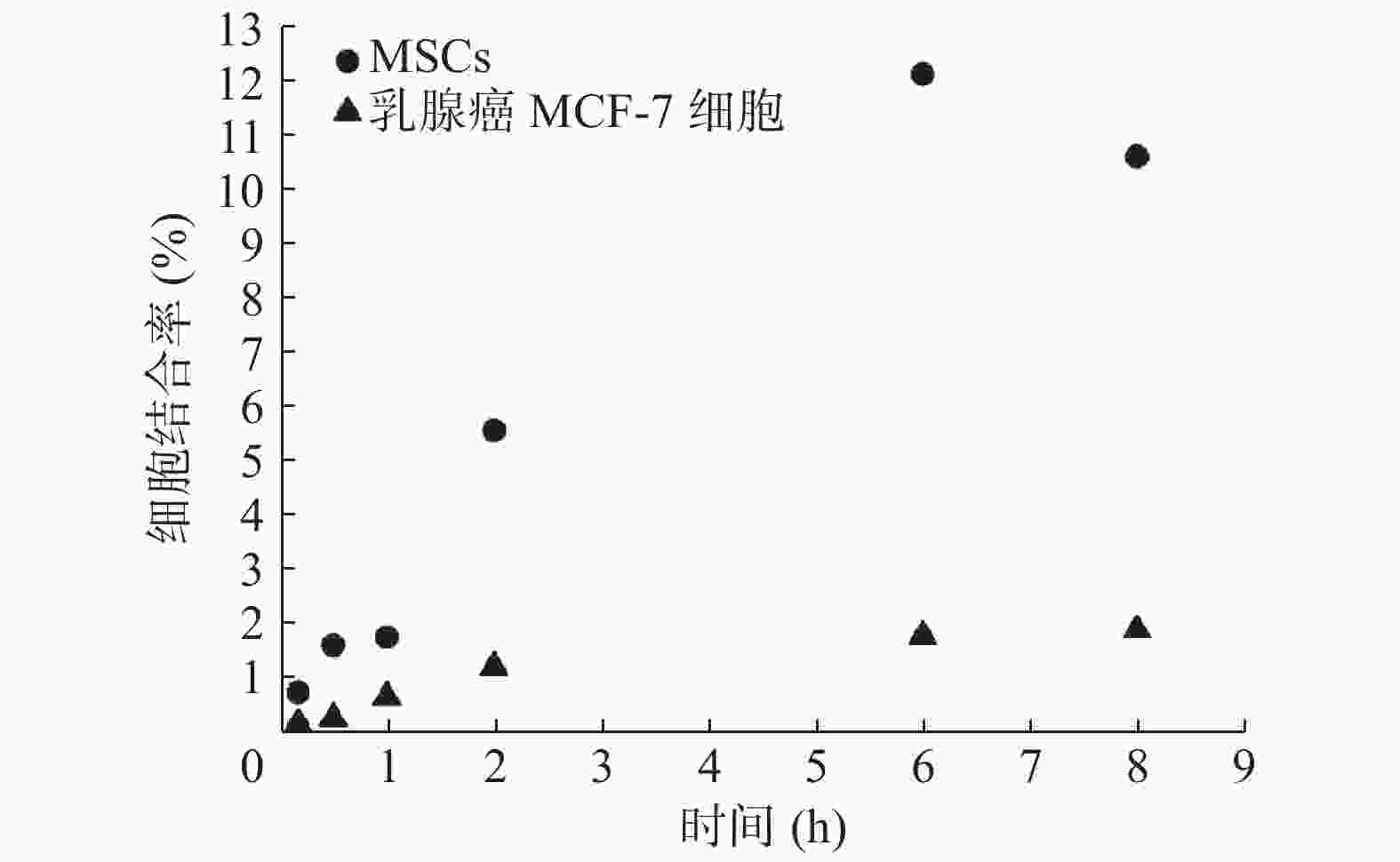
细胞结合实验结果如图1所示,在10、30 min和1、2、6、8 h时,125I-CD90 mAb与MSCs的结合率分别为0.86%、1.73%、1.88%、5.67%、12.20%、10.69%,从10 min到6 h,其结合率逐渐上升,6 h时达到高峰,之后下降。作为对照,125I-CD90 mAb与乳腺癌MCF-7细胞在上述6个时间点的结合率分别为0.30%、0.39%、0.78%、1.34%、1.90%、2.06%。由此可见,125I-CD90 mAb与MSCs在各个时间点的结合率都明显高于与乳腺癌MCF-7细胞的结合率。
-
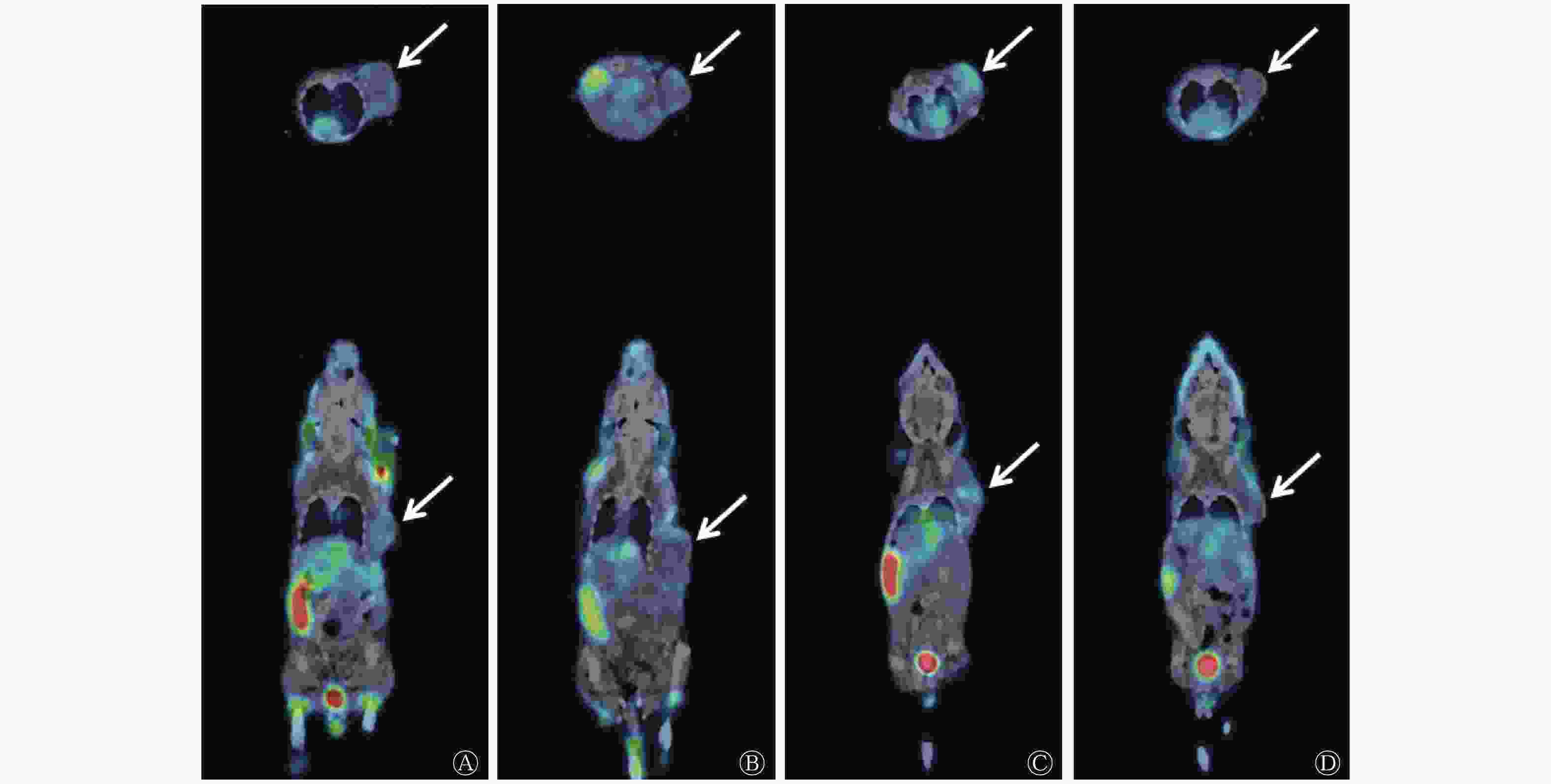
由图2可见,Micro-SPECT/CT显像结果显示,125I-CD90 mAb在荷瘤BALB/c裸鼠的肿瘤及主要器官和组织有着不同程度的分布。a组的125I-CD90 mAb分布多于b组,c组的125I-CD90 mAb分布也多于d组(图3)。由图4可见,在注射后6 h、1 d、2 d、3 d时,a组肿瘤组织的放射性摄取值分别为(3.66±1.69)、(2.35±1.30)、(1.36±0.95)、(1.33±0.84)%ID/g,均高于b组的(2.93±1.74)、(1.92±1.15)、(1.12±0.78)、(1.03±0.72)%ID/g,但差异均无统计学意义(t=0.52、0.43、0.35、0.47,均P>0.05);c组肿瘤组织的放射性摄取值分别为(5.75±1.30)、(3.75±0.77)、(2.70±0.44)、(1.88±0.48)%ID/g,均高于d组的(3.17±0.75)、(2.03±0.54)、(1.44±0.39)、(1.38±0.27)%ID/g,且差异均有统计学意义(t=2.98、3.19、3.70、1.59,均P<0.05)。
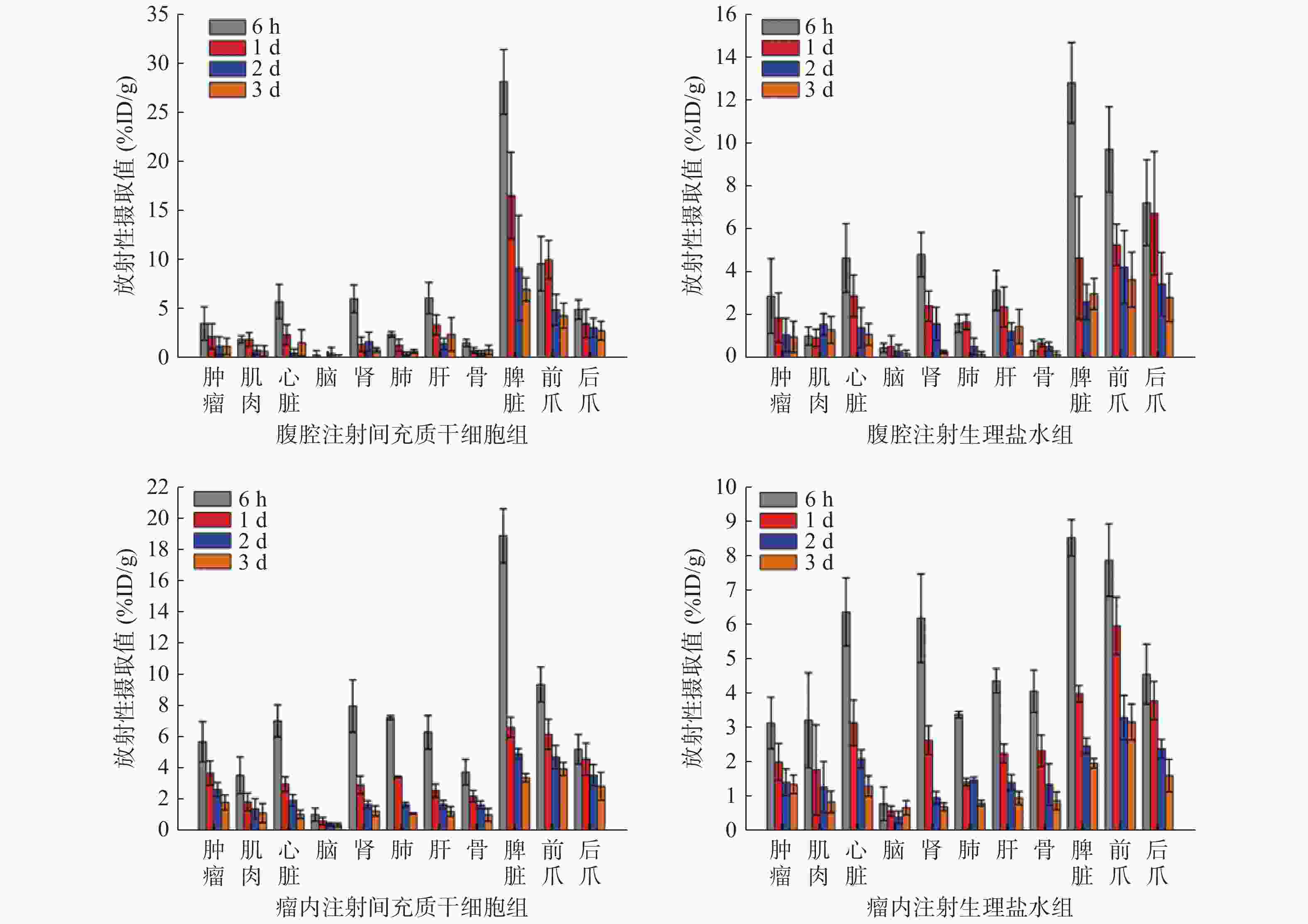
图 2 4组荷瘤BALB/c裸鼠注射后不同时间点 125I-CD90单克隆抗体的生物学分布
Figure 2. 125I-CD90 mocolonal antibody biodistribution in four groups of tumor-bearing BALB/c mice after injection in different times
-
近年来,一些基于生物基质的递送载体因其独特的仿生特性受到越来越多的关注,例如RBC、淋巴细胞和MSCs等,这些天然载体的仿生态特征增加了机体的认同度,避免了被机体清除,有利于提高递送效率[7]。MSCs是一种能自我更新的多能干细胞,最初从骨髓分离出来,脂肪、肌肉等其他组织也含有一定的数量[8]。Zischek等[9]利用MSCs靶向递送基因药物至胰腺癌间质,有效地抑制了胰腺癌的生长。Cao等[10]使用MSCs递送载有光敏剂的介孔二氧化硅,实施光动力治疗明显抑制了乳腺癌的生长。这些研究结果表明,MSCs具有肿瘤归巢特性,是理想的肿瘤靶向递送载体。
然而,利用MSCs靶向递送仍然需要解决MSCs的示踪问题,示踪MSCs可以掌握其进入体内多长时间归巢到肿瘤组织、在肿瘤组织的聚集什么时候达到最大量、在肿瘤组织中的分布情况等。近年来,非侵袭性的分子影像MRI、SPECT和PET等在示踪干细胞方面取得了一些进展,其中核医学分子影像以其独特的优势成为示踪MSCs的首选[11-13]。然而,目前示踪MSCs使用较多的99Tcm、18F和64Cu等核素的半衰期都相对较短,鉴于MSCs在归巢过程中可能会耗时较长,基于这些核素的分子影像不足以示踪作为递送载体的MSCs。放射性核素125I半衰期长,较容易获得,且发射γ射线可用于SPECT显像,此外,放射性碘标记抗体方法成熟,容易实现。因此,本研究使用125I标记CD90 mAb作为MSCs的分子影像探针不仅具有一定的创新性,而且理论和实践均可行。
125I标记的CD90抗体主要通过结合MSCs表面的CD90抗原以识别MSCs。本研究的体外细胞实验结果表明,125I-CD90 mAb能与MSCs结合,且两者的结合率随孵育时间逐渐上升,至孵育6 h时达到高峰,体现了这种结合具有时间依赖性,也表明了两者在体外的最佳结合时间点为6 h左右,从而为后续的体内实验确定了最佳时间点。此外,本研究还开展了125I-CD90 mAb与乳腺癌MCF-7细胞的体外结合实验作为对照,结果表明,125I-CD90 mAb与MSCs的结合率明显高于与乳腺癌MCF-7细胞的结合率,证实了125I-CD90 mAb与MSCs体外特异性结合的优势,也为后续开展体内实验奠定了基础。
基于乳腺癌荷瘤裸鼠的Micro-SPECT/CT显像结果表明,125I-CD90 mAb在体内有着不同程度的分布,尤以脾脏的放射性分布最高,这与以往核素标记抗体在体内分布结果相似,表明脾内的单核吞噬系统对抗体的捕获。然而,本研究还发现125I-CD90 mAb在荷瘤裸鼠的前后爪也有较高的放射性分布,这在以往的动物实验中是未曾见的。由于实验组和对照组的荷瘤裸鼠均存在这种现象,这种分布可能与MSCs不相关;由于131I不会在小鼠爪部聚集,据此类推,同为放射性碘的125I也不会聚集在小鼠爪部。由此推测,荷瘤裸鼠爪部的放射性分布很可能与CD90抗体有关,这种分布有可能是非特异性的,需要通过后续的实验进一步研究这种分布机制。
125I-CD90 mAb在荷瘤裸鼠肿瘤组织的分布结果显示,瘤内注射MSCs组高于瘤内注射生理盐水组,腹腔注射MSCs组也高于腹腔注射生理盐水组,且后者在4个不同时间点的差异均有统计学意义。前者表明,瘤内注射的MSCs能结合肿瘤血管输送的125I-CD90 mAb,使更多的125I-CD90 mAb聚集在肿瘤组织,从而证实了125I-CD90 mAb与MSCs在体内的特异性结合。后者表明,腹腔注射的MSCs通过归巢效应聚集到肿瘤组织,也能结合肿瘤血管中的125I-CD90 mAb,使125I-CD90 mAb较多地滞留在肿瘤组织,这不仅证实了MSCs的肿瘤归巢特性,也从另一方面证实了MSCs与125I-CD90 mAb在体内存在特异性结合。
本研究在进行荷瘤BALB/c裸鼠经尾静脉注射MSCs实验时,部分荷瘤裸鼠死亡,因此未能按计划开展相应的125I-CD90 mAb体内结合MSCs实验,这是本研究的不足之处。死亡的原因可能是MSCs注射量较多,堵塞了荷瘤裸鼠的肺毛细血管。今后的研究需进一步优化MSCs经尾静脉注射实验方案,进行更高水平的125I-CD90 mAb示踪MSCs肿瘤归巢实验。
综上,本研究成功制备了125I-CD90 mAb,并经体外和体内实验证实其可特异性结合MSCs,有望成为示踪MSCs的分子影像探针。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 吴江负责研究过程的实施、数据的分析、论文的起草及最终版本的修订;张晓懿负责研究过程的实施、数据的获取与分析;孙传金负责研究方案的修订;吉蘅山负责数据的分析;朱虹负责研究命题的提出与设计、论文的审阅与修订。
125I标记CD90单克隆抗体靶向结合间充质干细胞的实验研究
Experimental study on 125I labeled CD90 monoclonal antibody for targetedly binding mesenchymal stem cells
-
摘要:
目的 制备125I标记的CD90单克隆抗体(mAb),探讨其示踪间充质干细胞(MSCs)的可能性。 方法 采用氯胺T法对CD90 mAb进行125I标记,测定标记率。(1)体外实验:检测MSCs和125I-CD90 mAb孵育后上清液和沉淀的放射性计数,分别计算6个不同时间点的细胞结合率。(2)体内实验:构建荷瘤BALB/c裸鼠,采用完全随机法分为4组(每组3只),a组经腹腔注射MSCs,b组经腹腔注射生理盐水,c组经瘤内注射MSCs,d组经瘤内注射生理盐水。每只荷瘤裸鼠尾静脉注射125I-CD90 mAb(3.7 MBq/0.2 mL)后行Micro-SPECT/CT显像,测定并计算在4个不同时间点肿瘤及主要器官和组织的放射性摄取值[每克组织百分注射剂量率(%ID/g)]。2组均数之间的比较采用独立样本t检验。 结果 125I-CD90 mAb标记率为54.4%,放射化学纯度为98.79%。(1) 在10 min、30 min、1 h、2 h、6 h、8 h 时,125I-CD90 mAb与MSCs的结合率分别为0.86%、1.73%、1.88%、5.67%、12.20%、10.69%,6 h时最高。(2)荷瘤裸鼠的肿瘤长至150~200 mm3时用于实验。在注射后6 h、1 d、2 d、3 d时,Micro-SPECT/CT显示125I-CD90 mAb在荷瘤裸鼠的肿瘤及主要器官和组织中有着不同程度的分布,其中 a组肿瘤组织的放射性摄取值分别为(3.66±1.69)、(2.35±1.30)、(1.36±0.95)、(1.33±0.84)%ID/g,均高于b组的(2.93±1.74)、(1.92±1.15)、(1.12±0.78)、(1.03±0.72)%ID/g,但差异均无统计学意义(t=0.35~0.52,均P>0.05);c组肿瘤组织的放射性摄取值分别为(5.75±1.30)、(3.75±0.77)、(2.70±0.44)、(1.88±0.48)%ID/g,均高于d组的(3.17±0.75)、(2.03±0.54)、(1.44±0.39)、(1.38±0.27)%ID/g,且差异均有统计学意义(t=1.59~3.70,均P<0.05)。 结论 成功制备的125I-CD90 mAb具有良好的与MSCs结合的能力,有潜力作为核素探针示踪MSCs。 -
关键词:
- 间质干细胞 /
- 抗体,单克隆 /
- Thy-1抗原 /
- 碘放射性同位素 /
- 体层摄影术,发射型计算机,单光子
Abstract:Objective To prepare 125I-CD90 monoclonal antibody (mAb) and evaluate its potential as a molecular imaging agent to trace mesenchymal stem cells (MSCs). Methods 125I-CD90 mAb was prepared by chloramine T method, and labeling rate was tested. (1) In in vitro experiment, the radioactive count of the supernatant and precipitate was measured after incubating 125I-CD90 mAb with MSCs. Binding fraction was calculated at six time points. (2) In in vivo experiment, tumor-bearing BALB/c mice were constructed and divided into four groups (a, b, c and d) by completely random design. MSCs and normal saline were administered by intraperitoneal injection in groups a and b, respectively. MSCs and normal saline were given by intratumoral injection in groups c and d, respectively. 125I-CD90 mAb (3.7 MBq/0.2 mL) was injected via caudal vein in each mouse, and Micro-SPECT/CT analysis was performed. The radioactive uptake values (percentage activity of injection dose per gram of tissue (%ID/g)) in tumor and main organs was calculated at four different time points. The difference between two groups was analyzed by two independent sample t test. Results The labeling rate and radiochemical purity of 125I-CD90 mAb were 54.4% and 98.79%, respectively. (1) After incubation for 10 min, 30 min, 1 h, 2 h, 6 h and 8 h, the binding ratios of 125I-CD90 mAb in MSCs were 0.86%, 1.73%, 1.88%, 5.67%, 12.20% and 10.69%, respectively. The highest binding ratio was detected at 6 h of incubation. (2) Tumors of tumor-bearing mice (150−200 mm3) were used. Micro-SPECT/CT images showed varying degrees of 125I-CD90 mAb distribution in the tumor and main organs of MSCs tumor-bearing mice after 6 h, 1 d, 2 d and 3 d of incubation. The radioactive uptake values in the tumor were (3.66±1.69), (2.35±1.30), (1.36±0.95) and (1.33±0.84)%ID/g in group a, which were higher than those ((2.93±1.74), (1.92±1.15), (1.12±0.78) and (1.03±0.72)%ID/g) in group b, at 6 h, 1 d, 2 d and 3 d, respectively, but the differences were not statistically significant (t=0.35−0.52, all P>0.05). The radioactive uptake values in the tumor were (5.75±1.30), (3.75±0.77), (2.70±0.44) and (1.88±0.48)%ID/g in group c, which were higher than those ((3.17±0.75), (2.03±0.54), (1.44±0.39) and (1.38±0.27)%ID/g) in group d, at 6 h, 1 d, 2 d and 3 d, respectively, and all the differences were statistically significant (t=1.59−3.70, all P<0.05). Conclusion The prepared 125I-CD90 mAb exhibits good binding ability to MSCs and has the potential as a nuclide probe to trace MSCs. -
-
[1] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999, 284(5411): 143−147. DOI: 10.1126/science.284.5411.143. [2] Lin WP, Huang LF, Li Y, et al. Mesenchymal stem cells and cancer: clinical challenges and opportunities[J/OL]. Biomed Res Int, 2019, 2019: 2820853[2019-09-16]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6530243. DOI: 10.1155/2019/2820853. [3] Cheng S, Nethi SK, Rathi S, et al. Engineered mesenchymal stem cells for targeting solid tumors: therapeutic potential beyond regenerative therapy[J]. J Pharmacol Exp Ther, 2019, 370(2): 231−241. DOI: 10.1124/jpet.119.259796. [4] Wu J, Liu Y, Tang YX, et al. Synergistic chemo-photothermal therapy of breast cancer by mesenchymal stem cell-encapsulated yolk-shell GNR@HPMO-PTX nanospheres[J]. ACS Appl Mater Interfaces, 2016, 8(28): 17927−17935. DOI: 10.1021/acsami.6b05677. [5] Suryaprakash S, Lao YH, Cho HY, et al. Engineered mesenchymal stem cell/nanomedicine spheroid as an active drug delivery platform for combinational glioblastoma therapy[J]. Nano Lett, 2019, 19(3): 1701−1705. DOI: 10.1021/acs.nanolett.8b04697. [6] Crisan M, Yap S, Casteilla L, et al. A perivascular origin for mesenchymal stem cells in multiple human organs[J]. Cell Stem Cell, 2008, 3(3): 301−313. DOI: 10.1016/j.stem.2008.07.003. [7] Yoo JW, Irvine DJ, Discher DE, et al. Bio-inspired, bioengineered and biomimetic drug delivery carriers[J]. Nat Rev Drug Discov, 2011, 10(7): 521−535. DOI: 10.1038/nrd3499. [8] Wolfs E, Struys T, Notelaers T, et al. 18F-FDG labeling of mesenchymal stem cells and multipotent adult progenitor cells for PET imaging: effects on ultrastructure and differentiation capacity[J]. J Nucl Med, 2013, 54(3): 447−454. DOI: 10.2967/jnumed.112.108316. [9] Zischek C, Niess H, Ischenko I, et al. Targeting tumor stroma using engineered mesenchymal stem cells reduces the growth of pancreatic carcinoma[J]. Ann Surg, 2009, 250(5): 747−753. DOI: 10.1097/SLA.0b013e3181bd62d0. [10] Cao BR, Yang MY, Zhu Y, et al. Stem cells loaded with nanoparticles as a drug carrier for in vivo breast cancer therapy[J]. Adv Mater, 2014, 26(27): 4627−4631. DOI: 10.1002/adma.201401550. [11] Noorwali A, Faidah M, Ahmed N, et al. Tracking iron oxide labelled mesenchymal stem cells (MSCs) using magnetic resonance imaging (MRI) in a rat model of hepatic cirrhosis[J/OL]. Bioinformation, 2019, 15(1): 1−10[2019-09-16]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6651036. DOI: 10.6026/97320630015001. [12] Tang YH, Zhang CF, Wang JX. MRI/SPECT/fluorescent tri-modal probe for evaluating the homing and therapeutic efficacy of transplanted mesenchymal stem cells in a rat ischemic stroke model[J]. Adv Funct Mater, 2015, 25(7): 1024−1034. DOI: 10.1002/adfm.201402930. [13] Pei ZJ, Zeng J, Song YF, et al. In vivo imaging to monitor differentiation and therapeutic effects of transplanted mesenchymal stem cells in myocardial infarction[J/OL]. Sci Rep, 2017, 7(1): 6296[2019-09-16]. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/28740146. DOI: 10.1038/s41598-017-06571-8. -





 下载:
下载: