-
结直肠癌是常见的消化道恶性肿瘤,发病率呈逐年上升趋势,2013年中国结直肠癌新发病例数占全球的18.6%,结直肠癌已居中国人群恶性肿瘤死因的第5位[1]。中国人群结直肠癌标化发病率总体呈上升趋势,病死率呈缓慢上升趋势[2]。个体化医疗是现代医学的发展方向,而早期诊断和准确分期是制定个体化治疗方案和评估预后的基础,18F-FDG PET/CT实现了功能显像与解剖影像的同机融合,为结直肠癌的诊断和分期提供了新的方法[3]。近年来PET/CT在直肠癌中的应用逐渐增多,本研究探讨PET/CT在直肠癌原发灶浸润深度、淋巴结转移、远处转移、临床分期中的准确率以及原发灶SUVmax与临床病理特征的相关性。
-
回顾性分析2013年1月至2018年12月在福建省肿瘤医院接受手术治疗且术后病理证实为直肠癌的患者117例,其中男性66例、女性51例,年龄29~83岁,中位年龄57岁。纳入标准:患者的临床及影像学资料完整;术前2周内行PET/CT检查;术前未行化疗或放疗等治疗。纳入标准之外均为排除标准。检查前所有患者或家属均签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
采用荷兰Philips公司生产的Gemini TF 64 PET/CT仪,18F-FDG由日本住友公司HM-10医用回旋加速器生产,放射化学纯度>95%。显像前患者禁食6 h 以上,测量空腹血糖<7.5 mmol/L(非糖尿病患者)或<11.1 mmol/L(糖尿病患者),按体重注射18F-FDG 3.70~5.55 MBq/kg,嘱患者平静休息45~60 min后进行PET/CT显像。扫描范围均为颅顶至股骨中上段,PET采集采用三维模式,采集6~7个床位,2 min/床位;CT参数:电压120 kV,电流200 mA,层厚5 mm。采集完成后利用CT数据对PET图像进行衰减校正。在EBW2.0后处理工作站上将PET图像与CT图像进行融合,分别获得横断面、冠状面、矢状面的PET、CT和PET/CT融合图像。
-
由2位有5年以上PET/CT诊断经验的核医学科医师分别阅片并进行图像分析,包括病灶的浸润深度(在可疑病变部位勾画相应的ROI,由计算机自动计算SUVmax)、是否伴随区域淋巴结转移(数目、大小、SUVmax)、是否有非区域淋巴结转移及远处脏器转移等。意见不一致时由科室医师集体讨论得出结论。
-
参照美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)提出的结直肠癌TNM分期系统和其他相关的研究结果[4-8],制订本研究的分期参考标准如下。①T分期。T1~T2期:管腔局限性增厚,但外壁光整,肠周脂肪间隙清晰,病灶SUVmax≥2.5;T3期:管壁明显增厚,形态不规整,管腔明显狭窄,肠周脂肪间隙不清晰,但未见明显邻近器官或结构受侵,病灶SUVmax≥2.5;T4期:肿瘤突破浆膜层,管壁显著增厚,管腔明显狭窄,肠周脂肪间隙密度增高,并侵犯邻近器官或结构,病灶SUVmax≥2.5。②N分期。病灶淋巴结引流区域CT示淋巴结短径≥5.05 mm和SUVmax≥2.0诊断为区域淋巴结转移。N0:无区域淋巴结转移;N1:有1~3枚区域淋巴结转移;N2:有≥4枚区域淋巴结转移。③M分期。M0:无远处转移;M1:有远处转移(原发灶及其伴随淋巴结引流区外出现异常浓聚灶,相应部位CT可见软组织影)。
-
采集患者的影像学资料及各项临床病理相关资料,包括性别、年龄、病灶长径、病理类型、分化程度、淋巴血管侵犯(lymphovascular invasion,LVI)、周围神经侵犯(perineural invasion,PNI)、TNM分期和临床分期等,并基于各项临床病理相关资料进行分组,比较各组间SUVmax的差异。
-
采用SPSS22.0软件进行统计学分析。符合正态分布的计量资料以
$ \bar{x} $ ±s表示,方差齐性的组间均值比较采用独立样本t检验(两组间比较)或单因素方差分析(多组间比较)。一致性检验采用Kappa检验,κ≤0.4表明有较差一致性;0.40<κ≤0.60表明有中度一致性;0.60<κ≤0.80表明有较高度一致性;κ>0.80表明有极好一致性。原发灶SUVmax与临床病理特征之间的相关性采用Pearson或Spearson相关分析。P<0.05为差异有统计学意义。 -
117例直肠癌患者中,普通型腺癌109例、其他类型8例(黏液腺癌6例、恶性黑色素瘤1例、神经内分泌癌1例);中高分化105例、低分化12例;有LVI 78例、无LVI 39例;有PNI 52例、无PNI 65例。
-
117例直肠癌患者中,术后病理结果发现肿瘤侵犯固有肌层(T1~T2期)18例、到达浆膜下层(T3期)63例、穿透腹膜脏层或直接侵犯邻近器官(T4期)36例。PET/CT诊断T分期各期的灵敏度、特异度、准确率、κ值见表1。PET/CT诊断直肠癌原发灶整体浸润深度的准确率为76.1%(89/117),与术后病理结果有中度一致性(κ=0.601,P<0.01)。
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 T1~T2期(例) T3期(例) T4期(例) T1~T2期(例) 13 2 0 72.2 97.9 94.0 0.753 <0.01 T3期(例) 5 46 6 73.0 79.6 76.1 0.522 <0.01 T4期(例) 0 15 30 83.3 81.5 82.1 0.606 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 1 117例直肠癌患者18F-FDG PET/CT T分期与术后病理结果的比较
Table 1. T staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
-
117例直肠癌患者中,术后病理结果发现无区域淋巴结转移(N0期)44例、有区域淋巴结转移73例(N1期39例、N2期34例)。PET/CT判断有无淋巴结转移与术后病理结果一致的95例、假阳性11例、假阴性11例(表2)。PET/CT诊断N分期各期的灵敏度、特异度、准确率、κ值见表3。PET/CT诊断有无淋巴结转移的灵敏度为84.9%(62/73)、特异度为75.0%(33/44)、准确率为81.2%(95/117),与术后病理结果有中度一致性(κ=0.535,P<0.01)。
PET/CT诊断结果 术后病理结果 合计 无淋巴结转移 有淋巴结转移 无淋巴结转移 33 11 44 有淋巴结转移 11 62 73 合计 44 73 117 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 2 117例直肠癌患者18F-FDG PET/CT 淋巴结转移与术后 病理结果的比较(例)
Table 2. Lymph node metastasis comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer (case)
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 N0期(例) N1期(例) N2期(例) N0期(例) 33 10 1 75.0 84.9 81.2 0.599 <0.01 N1期(例) 11 24 9 61.5 74.4 70.0 0.348 <0.01 N2期(例) 0 5 24 70.6 94.0 87.2 0.675 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 3 117例直肠癌患者18F-FDG PET/CT N分期与术后病理结果的比较
Table 3. N staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
-
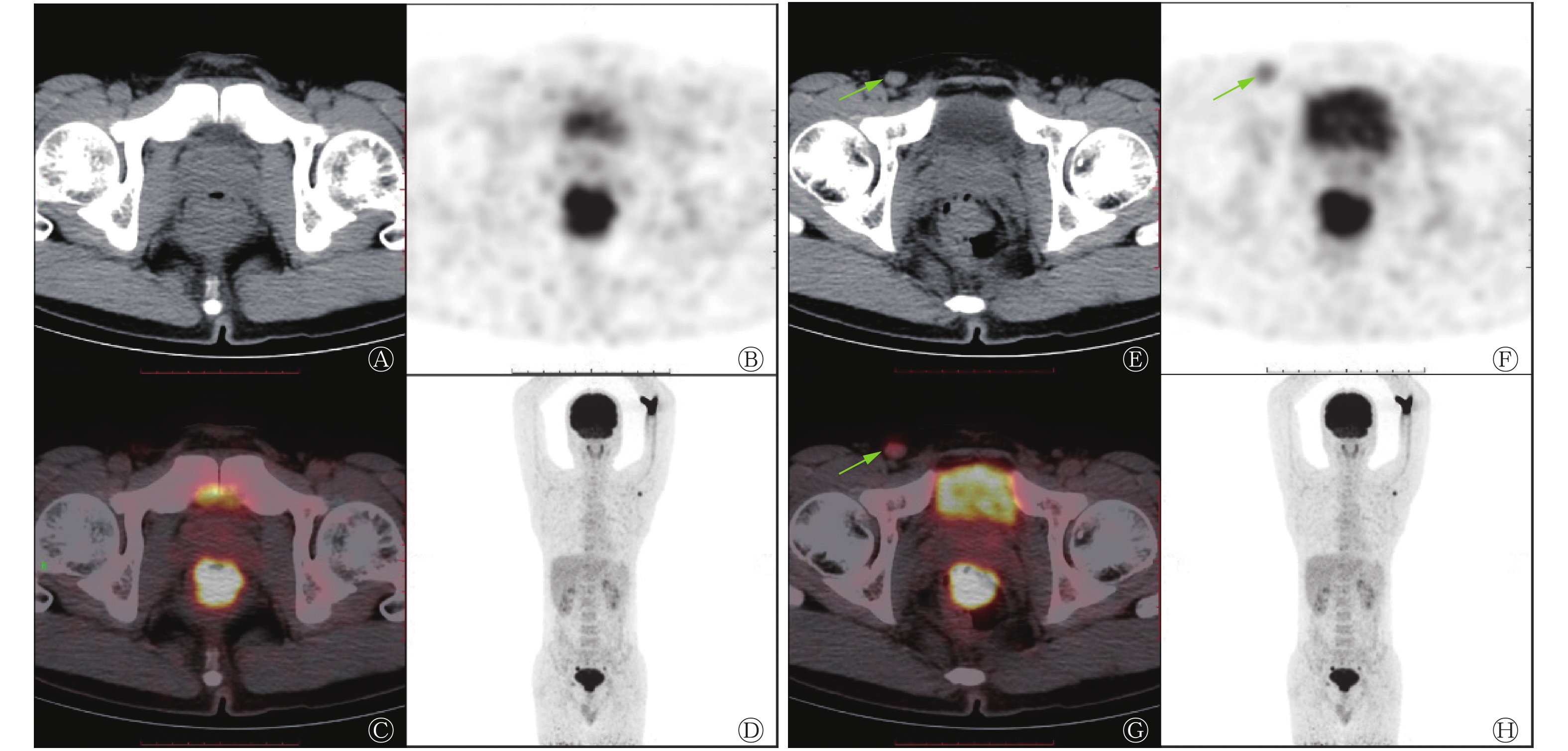
117例直肠癌患者中,远处转移灶均由病理或结合其他影像学检查证实,发现有远处转移24例,其中,肝脏转移13例、肺转移4例、非区域淋巴结转移4例、合并肝和非区域淋巴结转移1例、合并肺和非区域淋巴结转移1例、合并肝肺骨转移1例。PET/CT判断有无远处转移灶与术后病理或结合其他影像学检查结果一致的112例、假阳性2例、假阴性3例(表4)。假阳性2例均为肺部病灶PET/CT判断为转移,但经实验室检查及CT随访证实为肺结核。假阴性其中1例PET/CT判断为腹股沟淋巴结倾向良性,经穿刺病理证实为腹股沟淋巴结转移(图1)。PET/CT诊断有无远处转移的灵敏度为87.5%(21/24)、特异度为97.8%(91/93)、准确率为95.7%(112/117),与术后病理结果有极好的一致性(κ=0.867,P<0.01)。
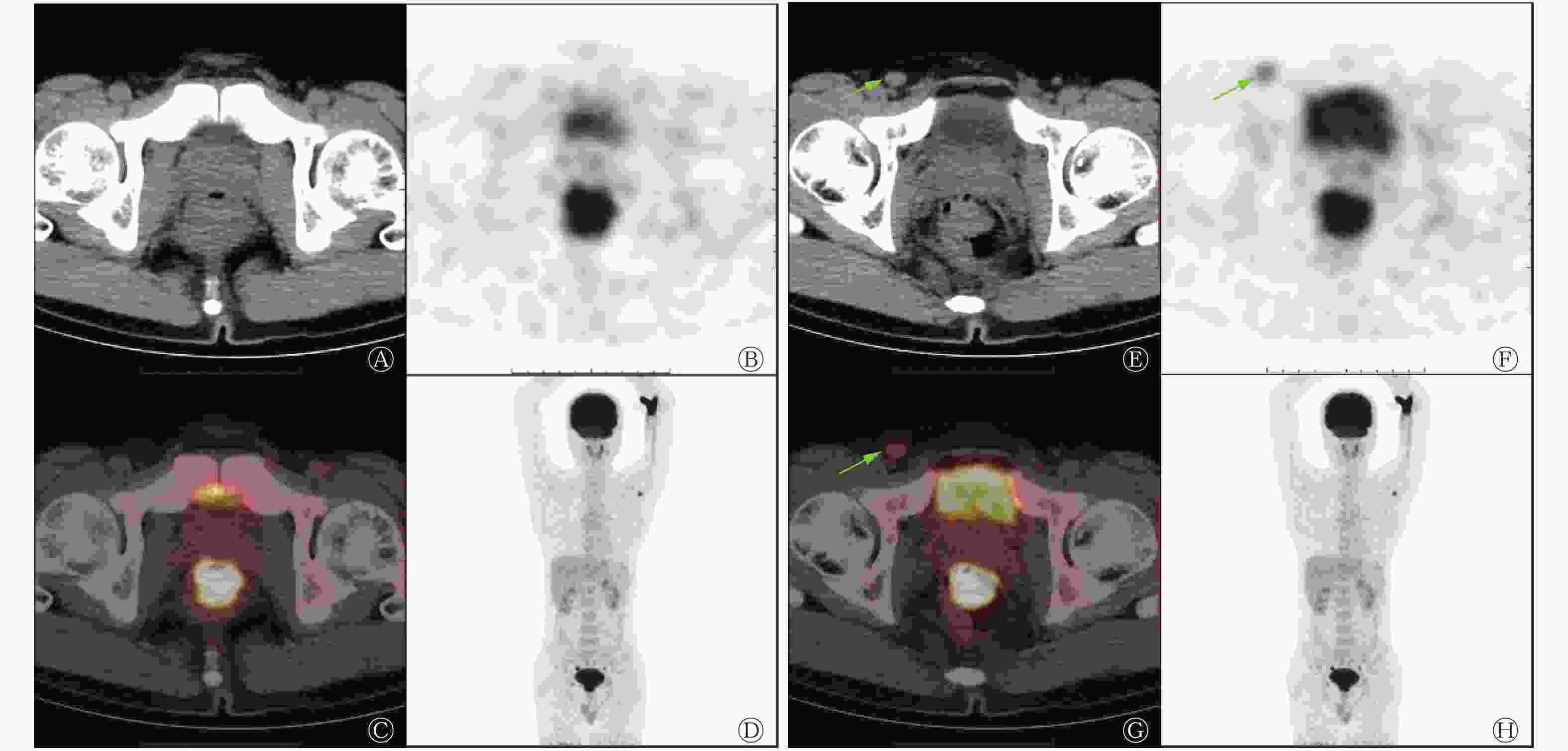
图 1 Ⅳ期直肠癌患者(男性,40岁)的18F-FDG PET/CT显像图。患者病理类型:直肠低分化腺癌,右腹股沟淋巴结穿刺病理结果为转移性低分化癌,TNM分期为T2N0M1
Figure 1. 18F-FDG PET/CT images of stage Ⅳ rectal cancer (male, 40 years old)
PET/CT诊断结果 术后病理或结合其他影像学检查结果 合计 无远处转移 有远处转移 无远处转移 91 3 94 有远处转移 2 21 23 合计 93 24 117 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 4 117例直肠癌患者18F-FDG PET/CT M分期与术后病理 或结合其他影像学检查结果的比较(例)
Table 4. M staging comparison of 18F-FDG PET/CT and pathological results or other imaging examination in 117 patients with rectal cancer (case)
-
PET/CT诊断直肠癌患者术前临床各分期的灵敏度、特异度、准确率、κ值见表5。PET/CT对于Ⅰ期和Ⅳ期的诊断灵敏度和准确率均高于Ⅱ期和Ⅲ期,与术后病理结果一致性检验的κ值Ⅰ期、Ⅳ期亦高于Ⅱ期、Ⅲ期。PET/CT诊断总的临床分期的准确率为76.9%(90/117),与术后病理结果有较高度一致性(κ=0.667,P<0.01)。PET/CT高估分期15例、低估分期12例,主要集中在Ⅱ期和Ⅲ期:术后病理证实28例Ⅱ期患者中有2例被低估、9例被高估;50例Ⅲ期患者中有7例被低估、2例被高估。
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 Ⅰ期(例) Ⅱ期(例) Ⅲ期(例) Ⅳ期(例) Ⅰ期(例) 11 2 0 0 73.3 98.0 94.9 0.757 <0.01 Ⅱ期(例) 3 17 7 0 60.7 88.8 82.1 0.501 <0.01 Ⅲ期(例) 1 9 41 3 82.0 80.6 81.2 0.620 <0.01 Ⅳ期(例) 0 0 2 21 87.5 97.8 95.7 0.867 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 5 117例直肠癌患者18F-FDG PET/CT 临床分期与术后病理结果的比较
Table 5. Clinical staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
-
由表6可知,不同病灶长径、LVI、PNI、N分期、临床分期的原发灶SUVmax的组间差异均有统计学意义(均P<0.05);不同性别、年龄、病理类型、分化程度、T分期、M分期的原发灶SUVmax的组间差异均无统计学意义(均P>0.05)。病灶长径≥3 cm的原发灶SUVmax高于病灶长径<3 cm的SUVmax;有LVI、有PNI及有淋巴结转移的原发灶SUVmax高于无LVI、无PNI及无淋巴结转移的SUVmax。
组别 例数 SUVmax t值或F值 P值 性别 男 66 14.42±5.44 0.688 0.493 女 51 15.13±5.81 年龄(岁) <65 94 14.34±5.47 1.523 0.130 ≥65 23 16.31±5.92 病灶长径(cm) <3 12 9.91±3.23 4.982 <0.001 ≥3 105 15.28±5.55 病理类型 腺癌普通型 109 14.85±5.58 0.886 0.377 其他 8 13.04±5.92 分化程度 中高分化 105 14.74±5.48 0.045 0.964 低分化 12 14.82±6.92 LVI 无 39 12.89±5.54 −2.581 0.011 有 78 15.65±5.42 PNI 无 65 13.34±4.92 −2.873 0.005 有 52 16.20±5.80 T分期 T1期+T2期 18 12.17±4.47 2.323 0.103 T3期 63 15.08±5.47 T4期 36 15.40±6.07 N分期 N0期 44 12.92±5.02 2.792 0.006 N1期+N2期 73 15.82±5.66 M分期 M0期 93 14.35±5.47 −1.502 0.136 M1期 24 16.30±5.92 临床分期 Ⅰ期 15 11.73±4.04 3.072 0.031 Ⅱ期 28 13.49±5.52 Ⅲ期 50 15.54±5.59 Ⅳ期 24 16.35±5.79 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;LVI:淋巴血管侵犯;PNI:周围神经侵犯 表 6 117例不同临床及病理特征的直肠癌原发灶18F-FDG PET/CT SUVmax的结果比较(
$ \bar{x} $ Table 6. Comparison of 18F-FDG PET/CT SUVmax between different clinical and pathological features in 117 patients with rectal cancer (
$ \bar{x} $ -
原发灶SUVmax与病灶长径、LVI、PNI、N分期、临床分期呈正相关(r=0.230~0.308,均P<0.05),与性别、年龄、病理类型、分化程度、T分期、M分期无相关性(r=0.001~0.149,均P>0.05)。
-
近年来PET/CT在结直肠癌中的应用逐渐增多,其可较全面地评估全身情况,准确地分期,为治疗方案的选择提供客观依据。肿瘤细胞代谢活跃,无氧糖酵解水平增高,则18F-FDG摄取增高,SUVmax是PET/CT中广泛应用的判断18F-FDG摄取程度的半定量指标,可用来反映部分病灶的代谢情况。PET/CT在结直肠癌中的应用价值主要是在对肿瘤的诊断、分期、复发转移、疗效评价和预后预测方面[5-7,9-10]。
肿瘤浸润深度对于治疗决策的选择具有重要意义,尤其是对肿瘤突破浆膜层、侵犯邻近组织的患者,对于局部晚期直肠癌,新辅助放化疗后行手术治疗已发展为标准的治疗模式[11]。本研究中原发灶SUVmax与T分期无关,这与以往的研究结果一致[7, 12]。术前PET/CT对于原发灶整体浸润深度有较高的诊断准确率,与术后病理结果有中度一致性,但对于T分期各期的诊断准确率有较大的差异。本研究中18例T1~T2期患者中有5例被高估为T3期,PET/CT对T1~T2期的诊断灵敏度不高,但准确率较高,这可能与本组病例数较少有关。本研究中PET/CT对T3期的诊断灵敏度、特异度、准确率及与术后病理结果的一致性均为最低。T3期中有2例被低估为T1~T2期,15例被高估为T4期。对于T3、T4期病灶,PET/CT与术后病理结果有中度一致性。PET/CT对直肠癌T分期的诊断基本依靠CT检查,但 CT平扫难以清晰显示肠壁各层及肠周的组织结构,无法明确判断肿瘤累及程度,因此会影响T分期的诊断准确率;而肠周炎性病变、肠道生理性摄取等可导致原发灶SUVmax过高,这些均会影响PET/CT对于T分期的诊断效能。
淋巴结转移是直肠癌最重要的转移途径,临床上主要通过超声、CT或MRI来观察淋巴结的形态、大小,以此判断淋巴结转移情况。PET/CT虽然综合了PET与CT的优势,但对于直肠癌N分期各期的灵敏度、特异度、准确率均不高。本研究以SUVmax≥2.0和淋巴结短径≥5.05 mm为临界值诊断淋巴结转移,PET/CT对N分期各期的诊断灵敏度、特异度、准确率一般,尤其是对N1期,PET/CT与术后病理结果的一致性较差,诊断效能不是很理想。但PET/CT对于有无淋巴结转移的诊断有较高的灵敏度、特异度、准确率,与术后病理结果有中度的一致性。蒯玉娴等[5]的研究结果提示,SUVmax≥1.45或淋巴结短径≥5.05 mm作为转移性淋巴结的诊断标准时诊断的准确率最高。Yu等[6]将淋巴结短径>4.85 mm和SUVmax≥2作为诊断标准,其诊断淋巴结转移的灵敏度、特异度和准确率分别为 95.0%、86.96%和89.0%。本研究中淋巴结转移假阴性病例中很大部分为0.5~0.8 mm的淋巴结,表现为18F-FDG低代谢或稍高代谢,无法准确判断其是否转移。据报道,胃肠道肿瘤较易发生小淋巴结转移,而直肠癌相对于其他盆腔肿瘤更易发生淋巴结微转移[13]。由于转移性淋巴结小,18F-FDG摄取低;或者部分淋巴结位于肠旁,原发肿瘤的容积效应或周围本底较高,易被掩盖;或者多个小淋巴结融合,被误认为单个淋巴结,均会导致PET/CT对淋巴结诊断的假阴性或者低估N分期。而反应性增生的淋巴结高摄取18F-FDG,可导致PET/CT诊断的假阳性或高估N分期。
直肠癌常见肝脏、肺转移及非区域淋巴结转移等,PET/CT为全身检查,诊断远处转移具有明显的优势。我们发现,PET/CT诊断有无远处转移的灵敏度、特异度和准确率均较高,与术后病理结果有极好的一致性。117例患者中PET/CT判断有无远处转移灶与术后病理或结合其他影像学检查结果一致的112例,准确率达95.7%。本研究中2例假阳性患者均为肺部病灶的误判,肺转移灶因出现的时间及大小不同,代谢也不同,尤其是肺部多发的低或稍高代谢小结节,很难与肺部非转移性病变区分。本研究中PET/CT诊断远处转移假阳性患者中1例肺转移灶为多发稍高代谢小结节,另外1例为单发的稍高代谢结节,但经实验室检查及CT随访结果均证实为结核。另外,由于肿瘤患者的免疫力低下,肺部容易发生感染性病变,早期的影像学表现有时与转移灶很难区分。
SUVmax是PET/CT判断18F-FDG摄取程度的半定量指标,本研究结果显示直肠癌原发灶SUVmax与病灶长径、LVI、PNI、N分期、临床分期有关,而与性别、年龄、病理类型、分化程度、T分期、M分期均无关。病灶长径≥3 cm的原发灶SUVmax高于病灶长径<3 cm的SUVmax,这说明原发灶体积越大,肿瘤的增殖能力越强,SUVmax越高。多项研究结果表明,LVI是结直肠癌独立的预后不良因素[14-15]。多中心研究结果证实,PNI是结直肠癌重要且独立的预后因素[16-17]。肿瘤侵犯周围的大小脉管或肿瘤淋巴引流区的外周神经,或伴随淋巴结转移,均表明该肿瘤的侵袭性较强。我们发现,有LVI或PNI及发生淋巴结转移的原发灶SUVmax均高于无LVI或PNI及未发生淋巴结转移的原发灶SUVmax。可以认为SUVmax在一定程度上可以反映肿瘤的侵袭性,SUVmax越高,肿瘤的侵袭性也越强。另外,远处转移也反映了肿瘤的侵袭性,虽然有的研究结果表明原发灶SUVmax与远处转移有关[18],但我们发现有远处转移的原发灶SUVmax虽然高于无远处转移的SUVmax,但两者间差异无统计学意义,这可能与临床医师对晚期直肠癌患者手术有选择指征,可根据病理类型、分化程度、肿瘤局部侵犯程度、远处转移部位及转移灶数目来判定可否选择手术治疗有关。另外,我们发现虽然原发灶SUVmax与病灶长径、LVI、PNI、N分期、临床分期呈正相关,但均呈低度线性相关,这可能与PET/CT在消化道肿瘤中的18F-FDG摄取受到的影响因素较多有关,尤其是炎性病变的影响,例如肠道炎性疾病、病变周围炎性病变、肠道生理性摄取和肠道蠕动等。有研究结果表明,中性粒细胞与淋巴细胞比值、淋巴细胞与单核细胞比值与SUVmax、肿瘤代谢体积(MTV)和总糖酵解量(TLG)显著相关[19]。PET/CT的主要定量分析参数包括SUVmax、MTV和TLG等,因SUVmax仅能部分反映肿瘤代谢活性,而MTV能反映肿瘤负荷,TLG也是肿瘤代谢活性的指标,因此,仍需进一步研究MTV、TLG等,或者新型示踪剂,来反映肿瘤的功能代谢情况,有助于患者治疗前的分期,对治疗疗效的评估及治疗后的预测起到重要作用。68Ga-成纤维细胞激活蛋白抑制剂(68Ga-FAPI)是一类新型的放射性示踪剂,成纤维细胞激活蛋白(FAP)在多种恶性肿瘤的成纤维细胞中过度表达,因此其可被特异性地用于识别肿瘤相关的成纤维细胞。68Ga-成纤维细胞激活蛋白抑制剂(68Ga-FAPI)PET/CT在几种常见的肿瘤中具有非常高的摄取和图像对比度;肿瘤高选择性摄取可能为非侵入性肿瘤显像、分期或放射性配体治疗开辟新的应用领域[20]。
一般情况下,肿瘤细胞分化程度越低,恶性程度就会越高,肿瘤细胞代谢越活跃,无氧糖酵解水平越高,18F-FDG摄取也越高。本研究中,原发灶SUVmax与病理类型、分化程度均无关,这可能与本组病例为直肠癌术后患者,中分化腺癌居多,而高分化腺癌、黏液腺癌及低分化癌病例数较少有关,不能全面反映原发灶SUVmax与病理类型、分化程度的关系,尚有待进一步研究。
综上所述,PET/CT显像对于直肠癌原发灶、淋巴结转移及远处转移的诊断均有较高的准确率,但对于淋巴结转移的诊断效能相对较差,尤其是N1期。原发灶SUVmax与病灶长径、LVI、PNI、N分期、临床分期有关,但相关性不高,可部分反映肿瘤的增殖及侵袭能力。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 林小敏负责资料的整理及分析、论文的撰写;潘雪艳负责论文的修改;唐明灯负责论文的选题及审阅。
18F-FDG PET/CT 显像在直肠癌术前分期中的价值及与临床病理特征关系的研究
Preoperative staging of rectal cancer with 18F-FDG PET/CT and its relationship with clinicopathological features
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG)PET/CT显像在直肠癌术前肿瘤、结节、转移(TNM)分期中的价值及原发灶最大标准化摄取值(SUVmax)与临床及病理特征的相关性。 方法 回顾性分析2013年1月至2018年12月在福建省肿瘤医院术前行18F-FDG PET/CT检查且经术后病理证实为直肠癌的117例患者(男性66例、女性51例,年龄29~83岁,中位年龄57岁)的相关资料,评估18F-FDG PET/CT对直肠癌原发灶浸润深度、淋巴结转移、远处转移及临床分期的准确率。一致性检验采用Kappa检验。基于性别、年龄、病灶长径、病理类型、分化程度、淋巴血管侵犯(LVI)、周围神经侵犯(PNI)、TNM分期、临床分期进行分组,采用独立样本t检验和单因素方差分析比较组间原发灶SUVmax的差异;采用Pearson或Spearson相关分析法分析原发灶SUVmax与临床及病理特征之间的相关性。 结果 18F-FDG PET/CT对直肠癌原发灶浸润深度、淋巴结转移、远处转移、临床分期的诊断准确率分别为76.1%、81.2%、95.7%、76.9%,与病理结果的一致性为κ=0.601、0.535、0.867、0.667(均P<0.01)。不同病灶长径(t=4.982,P<0.01)、LVI(t=−2.581,P=0.011)、PNI(t=−2.873,P=0.005、N分期(t=2.792,P=0.006)、临床分期(F=3.072,P=0.031)的原发灶SUVmax的组间差异均有统计学意义;不同性别(t=0.688,P=0.493)、年龄(t=1.523,P=0.130)、病理类型(t=0.886,P=0.377)、分化程度(t=0.045,P=0.964)、T分期(F=2.323,P=0.103)、M分期(t=−1.502,P=0.136)的原发灶SUVmax的组间差异均无统计学意义。原发灶SUVmax与病灶长径、LVI、PNI、N分期、临床分期呈正相关(r=0.230~0.308,均P<0.05)。 结论 18F-FDG PET/CT对于直肠癌原发灶、淋巴结转移及远处转移均有较高的诊断准确率,是直肠癌分期的有效方法。原发灶SUVmax可部分反映肿瘤的增殖及侵袭能力。 -
关键词:
- 直肠肿瘤 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18 /
- 肿瘤分期 /
- 最大标准化摄取值
Abstract:Objective To investigate the clinical value of 18F-fluorodeoxyglucose (FDG) PET/CT imaging in preoperative tumor, node, metastasis (TNM) staging of rectal cancer and the correlation between the maximum standardized uptake value (SUVmax) of primary lesions and clinicopathological features. Methods To evaluate the accuracy of 18F-FDG PET/CT in assessing invasion depth, lymph node metastasis, metastasis, and clinical staging before operation, a retrospective analysis was performed on data collected from 117 rectal cancer patients, including 66 males and 51 females (aged 29–83 years old, median age 57 years), who underwent 18F-FDG PET/CT examination before operation in Fujian Cancer Hospital from January 2013 to December 2018. Kappa test was used for consistency test. The patients were grouped according to gender, age, length of primary lesion, pathological type, differentiated degree, lymphovascular invasion (LVI), perineural invasion (PNI), TNM staging, and clinical staging. Independent sample t-test and one-way ANOVA were used to analyze the difference in SUVmax between groups. Pearson or Spearman correlation was used to analyze the relationship between the SUVmax of primary lesions and clinicopathological features. Results The diagnostic accuracies of 18F-FDG PET/CT on rectal cancer invasion depth, lymph node metastasis, metastasis, and clinical staging were 76.1%, 81.2%, 95.7%, and 76.9%. The consistency with pathological results was as follows (κ=0.601, 0.535, 0.867, 0.667, all P<0.01). Statistically significant differences were observed in the SUVmax of different groups of length of primary lesion (t=4.982, P<0.01), LVI (t=−2.581, P=0.011), PNI (t=−2.873, P=0.005), N staging (t=2.792, P=0.006), and clinical staging (F=3.072, P=0.031), but no statistically significant differences were observed in the SUVmax of different groups of gender (t=0.688, P=0.493), age (t=1.523, P=0.130), pathological type (t=0.886, P=0.377), differentiated degree (t=0.045, P=0.964), T staging (F=2.323, P=0.103), and M staging (t=−1.502, P=0.136). The SUVmax of the primary lesion was positively correlated with the length of the primary lesion, LVI, PNI, N staging, and clinical staging (r=0.230–0.308, all P<0.05). Conclusions 18F-FDG PET/CT has high accuracy in diagnosing rectal cancer primary lesions, lymph nodes, and metastasis and is an effective method for staging rectal cancer. The SUVmax of primary lesions can partially reflect the invasion and proliferation ability of rectal cancer. -
表 1 117例直肠癌患者18F-FDG PET/CT T分期与术后病理结果的比较
Table 1. T staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 T1~T2期(例) T3期(例) T4期(例) T1~T2期(例) 13 2 0 72.2 97.9 94.0 0.753 <0.01 T3期(例) 5 46 6 73.0 79.6 76.1 0.522 <0.01 T4期(例) 0 15 30 83.3 81.5 82.1 0.606 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 2 117例直肠癌患者18F-FDG PET/CT 淋巴结转移与术后 病理结果的比较(例)
Table 2. Lymph node metastasis comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer (case)
PET/CT诊断结果 术后病理结果 合计 无淋巴结转移 有淋巴结转移 无淋巴结转移 33 11 44 有淋巴结转移 11 62 73 合计 44 73 117 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 3 117例直肠癌患者18F-FDG PET/CT N分期与术后病理结果的比较
Table 3. N staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 N0期(例) N1期(例) N2期(例) N0期(例) 33 10 1 75.0 84.9 81.2 0.599 <0.01 N1期(例) 11 24 9 61.5 74.4 70.0 0.348 <0.01 N2期(例) 0 5 24 70.6 94.0 87.2 0.675 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 4 117例直肠癌患者18F-FDG PET/CT M分期与术后病理 或结合其他影像学检查结果的比较(例)
Table 4. M staging comparison of 18F-FDG PET/CT and pathological results or other imaging examination in 117 patients with rectal cancer (case)
PET/CT诊断结果 术后病理或结合其他影像学检查结果 合计 无远处转移 有远处转移 无远处转移 91 3 94 有远处转移 2 21 23 合计 93 24 117 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 5 117例直肠癌患者18F-FDG PET/CT 临床分期与术后病理结果的比较
Table 5. Clinical staging comparison of 18F-FDG PET/CT and pathological results in 117 patients with rectal cancer
PET/CT分期 术后病理分期 灵敏度(%) 特异度(%) 准确率(%) κ值 P值 Ⅰ期(例) Ⅱ期(例) Ⅲ期(例) Ⅳ期(例) Ⅰ期(例) 11 2 0 0 73.3 98.0 94.9 0.757 <0.01 Ⅱ期(例) 3 17 7 0 60.7 88.8 82.1 0.501 <0.01 Ⅲ期(例) 1 9 41 3 82.0 80.6 81.2 0.620 <0.01 Ⅳ期(例) 0 0 2 21 87.5 97.8 95.7 0.867 <0.01 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术 表 6 117例不同临床及病理特征的直肠癌原发灶18F-FDG PET/CT SUVmax的结果比较(
$ \bar{x} $ Table 6. Comparison of 18F-FDG PET/CT SUVmax between different clinical and pathological features in 117 patients with rectal cancer (
$ \bar{x} $ 组别 例数 SUVmax t值或F值 P值 性别 男 66 14.42±5.44 0.688 0.493 女 51 15.13±5.81 年龄(岁) <65 94 14.34±5.47 1.523 0.130 ≥65 23 16.31±5.92 病灶长径(cm) <3 12 9.91±3.23 4.982 <0.001 ≥3 105 15.28±5.55 病理类型 腺癌普通型 109 14.85±5.58 0.886 0.377 其他 8 13.04±5.92 分化程度 中高分化 105 14.74±5.48 0.045 0.964 低分化 12 14.82±6.92 LVI 无 39 12.89±5.54 −2.581 0.011 有 78 15.65±5.42 PNI 无 65 13.34±4.92 −2.873 0.005 有 52 16.20±5.80 T分期 T1期+T2期 18 12.17±4.47 2.323 0.103 T3期 63 15.08±5.47 T4期 36 15.40±6.07 N分期 N0期 44 12.92±5.02 2.792 0.006 N1期+N2期 73 15.82±5.66 M分期 M0期 93 14.35±5.47 −1.502 0.136 M1期 24 16.30±5.92 临床分期 Ⅰ期 15 11.73±4.04 3.072 0.031 Ⅱ期 28 13.49±5.52 Ⅲ期 50 15.54±5.59 Ⅳ期 24 16.35±5.79 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;LVI:淋巴血管侵犯;PNI:周围神经侵犯 -
[1] 中国疾病预防控制中心慢性非传染性疾病预防控制中心, 国家卫生和计划生育委员会统计信息中心. 中国死因监测数据集(2013)[M]. 北京: 科学普及出版社, 2015: 58.
National Center for Chronic and Noncommunicable Disease Control and Prevention of Chinese Center for Disease Control and Prevention, Statistics Information Center of National Health and Family Planning Commission of People's Republic of China. Datasets on cause of death surveillance in China (2013)[M]. Beijing: Popular Science Press, 2015: 58.[2] 冯雅靖, 王宁, 方利文, 等. 1990年与2013年中国人群结直肠癌疾病负担分析[J]. 中华流行病学杂志, 2016, 37(6): 768−772. DOI: 10.3760/cma.j.issn.0254-6450.2016.06.005.
Feng YJ, Wang N, Fang LW, et al. Burden of disease of colorectal cancer in the Chinese populationin, in 1990 and 2013[J]. Chin J Epidemiol, 2016, 37(6): 768−772. DOI: 10.3760/cma.j.issn.0254-6450.2016.06.005.[3] Maffione AM, Lopci E, Bluemel C, et al. Diagnostic accuracy and impact on management of 18F-FDG PET and PET/CT in colorectal liver metastasis: a meta-analysis and systematic review[J]. Eur J Nucl Med Mol Imaging, 2015, 42(1): 152−163. DOI: 10.1007/s00259-014-2930-4. [4] Amin MB, Greene FL, Edge S, et al. AJCC cancer staging manual[M]. 8th ed. New York: Springer, 2017: 252−274. [5] 蒯玉娴, 葛继元, 周围, 等. 18F-FDG PET/CT显像对直肠癌区域淋巴结转移的诊断价值[J]. 中华核医学与分子影像杂志, 2017, 37(2): 70−74. DOI: 10.3760/cma.j.issn.2095-2848.2017.02.002.
Kuai YX, Ge JY, Zhou W, et al. Detection of regional lymph metastasis with 18F-FDG PET/CT imaging in patients with rectal cancer[J]. Chin J Nucl Med Mol Imaging, 2017, 37(2): 70−74. DOI: 10.3760/cma.j.issn.2095-2848.2017.02.002.[6] Yu LJ, Tian MH, Gao X, et al. The method and efficacy of 18F-fluorodeoxyglucose positron emission tomography/computed tomography for diagnosing the lymphatic metastasis of colorectal carcinoma[J]. Acad Radiol, 2012, 19(4): 427−433. DOI: 10.1016/j.acra.2011.12.007. [7] 田蓉蓉, 薄云峰, 张毅勋, 等. 术前 18F-FDG PET-CT显像对结直肠癌分期的临床价值[J]. 肿瘤研究与临床, 2017, 29(12): 809−814. DOI: 10.3760/cma.j.issn.1006-9801.2017.12.004.
Tian RR, Bo YF, Zhang YX, et al. Clinical value of preoperative 18F-FDG PET-CT imaging in staging of colorectal cancer[J]. Cancer Res Clin, 2017, 29(12): 809−814. DOI: 10.3760/cma.j.issn.1006-9801.2017.12.004.[8] 田博, 杨得振, 贾勇, 等. CT、MRI影像诊断对直肠癌临床术前分期价值研究[J]. 中国CT和MRI杂志, 2015, 13(11): 108−110, 114. DOI: 10.3969/j.issn.1672-5131.2015.11.032.
Tian B, Yang DZ, Jia Y, et al. The value of CT and MRI imaging diagnosis in clinical preoperative staging of rectal cancer[J]. Chin J CT MRI, 2015, 13(11): 108−110, 114. DOI: 10.3969/j.issn.1672-5131.2015.11.032.[9] 王晓燕, 彭贵娟, 张祥松, 等. 基于18氟-脱氧葡萄糖正电子发射计算机断层成像术的最大标准化摄取值和放射线基线比值与结直肠癌术后预后的关系[J]. 中华胃肠外科杂志, 2015, 18(3): 232−237. DOI: 10.3760/cma.j.issn.1671-0274.2015.03.008.
Wang XY, Peng GJ, Zhang XS, et al. Correlation of 18F-FDG PET-CT maximum standard uptake value and T/N ratio with the prognosis of postoperative colorectal cancer[J]. Chin J Gastrointest Surg, 2015, 18(3): 232−237. DOI: 10.3760/cma.j.issn.1671-0274.2015.03.008.[10] 丁重阳, 李天女, 郭喆, 等. 18氟-氟代脱氧葡萄糖PET/CT检查判断结直肠癌术后预后的临床价值[J]. 中华消化外科杂志, 2016, 15(10): 1018−1025. DOI: 10.3760/cma.j.issn.1673-9752.2016.10.015.
Ding CY, Li TN, Guo Z, et al. Clinical value of Fluorine-18-fluorodeoxyglucose PET/CT examination to predict the prognosis of patients after colorectal cancer operation[J]. Chin J Dig Surg, 2016, 15(10): 1018−1025. DOI: 10.3760/cma.j.issn.1673-9752.2016.10.015.[11] Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. N Engl J Med, 2004, 351(17): 1731−1740. DOI: 10.1056/NEJMoa040694. [12] Kekelidze M, D'Errico L, Pansini M, et al. Colorectal cancer: current imaging methods and future perspectives for the diagnosis, staging and therapeutic response evaluation[J]. World J Gastroenterol, 2013, 19(46): 8502−8514. DOI: 10.3748/wjg.v19.i46.8502. [13] Kim DJ, Kim JH, Ryu YH, et al. Nodal staging of rectal cancer: high-resolution pelvic MRI versus 18F-FDG PET/CT[J]. J Comput Assist Tomogr, 2011, 35(5): 531−534. DOI: 10.1097/RCT.0b013e318225720f. [14] 陈鹏举, 姚云峰, 赵军, 等. 0~Ⅲ期直肠癌综合治疗856例回顾性研究[J]. 中华外科杂志, 2015, 53(7): 496−500. DOI: 10.3760/cma.j.issn.0529-5815.2015.07.004.
Chen PJ, Yao YF, Zhao J, et al. Retrospective analysis of 856 cases with stage 0 to Ⅲ rectal cancer underwent curative surgery combined modality therapy[J]. Chin J Surg, 2015, 53(7): 496−500. DOI: 10.3760/cma.j.issn.0529-5815.2015.07.004.[15] AI-Sukhni E, Attwood K, Gabriel EM, et al. Lymphovascular and perineural invasion are associated poor prognostic and outcomes in colorectal cancer: a retrospective cohort study[J]. Int J Surg, 2017, 37: 42−49. DOI: 10.1016/j.ijsu.2016.08.528. [16] 韩冬, 魏颖, 王曦迪, 等. 周围神经侵犯与结直肠癌临床病理因素及预后的关系[J]. 中华胃肠外科杂志, 2017, 20(1): 62−66. DOI: 10.3760/cma.j.issn.1671-0274.2017.01.013.
Han D, Wei Y, Wang XD, et al. Association of peripheral nerve invasion with clinicopathological factors and prognosis of colorectal cancer[J]. Chin J Gastrointest Surg, 2017, 20(1): 62−66. DOI: 10.3760/cma.j.issn.1671-0274.2017.01.013.[17] Knijn N, Mogk SC, Teerenstra S, et. al. Perineural invasion is a strong prognostic factor in colorectal cancer: a systematic review[J]. Am J Surg Pathol, 2016, 40(1): 103−112. DOI: 10.1097/PAS.0000000000000518. [18] 田蓉蓉, 薄云峰, 张毅勋, 等. 18F-FDG PET/CT显像与结直肠治疗前分期的相关性研究[J]. 国际放射医学核医学杂志, 2018, 42(1): 9−14. DOI: 10.3760/cma.j.issn.1673-4114.2018.01.002.
Tian RR, Bo YF, Zhang YX, et al. Correlation between 18F-FDG PET/CT and pretreatment staging of colorectal cancer[J]. Int J Radiat Med Nucl Med, 2018, 42(1): 9−14. DOI: 10.3760/cma.j.issn.1673-4114.2018.01.002.[19] Xu JY, Li Y, Hu SL, et al. The significant value of predicting prognosis in patients with colorectal cancer using 18F-FDG PET metabolic parameters of primary tumors and hematological patameters[J]. Ann Nucl Med, 2019, 33(1): 32−38. DOI: 10.1007/s12149-018-1299-z. [20] Kratochwil C, Flechsig P, Lindner T, et, al. 68Ga-FAPI-PET/CT: tracer uptake in 28 different kind of cancer[J]. J Nucl Med, 2019, 60(6): 801−805. DOI: 10.2967/jnumed.119.227967. -





 下载:
下载: