-
胸腺上皮性肿瘤(thymic epithelial tumor,TET)是前纵隔最常见的肿瘤,起源于胸腺上皮细胞,约占前纵隔肿瘤的47%[1]。TET的生物学行为及病理学分型复杂,不同病理类型侵袭性程度不同,所处临床分期也不同。世界卫生组织(world health organization, WHO)于1999年对TET进行了病理分型,并于2015年进一步修订,将TET分为6种肿瘤亚型:A型、AB型、B1型、B2型、B3型和C型(胸腺癌)[2]。18F-FDG PET/CT作为一种新型分子影像技术,在多种恶性肿瘤的诊断和分期中具有重要的价值,但在TET诊断及分期中的价值鲜有报道。本研究回顾性分析经手术病理学结果证实的40例TET患者的临床资料,旨在探讨18F-FDG PET/CT的SUVmax与TET的WHO简化病理分型及Masaoka分期[3]的关系。
-
回顾性分析2007年9月至2019年3月于南京医科大学第一附属医院经手术病理学结果证实的40例TET患者的临床资料,其中男性14例、女性26例,年龄32~79岁,中位年龄57岁。纳入标准:(1)手术病理学结果证实为TET;(2)术前完成PET/CT检查,且与手术的间隔时间<15 d;(3)PET/CT检查前及手术前未接受任何肿瘤相关治疗;(4)无其他恶性肿瘤病史。排除标准:(1)合并糖尿病或严重肝肾功能异常;(2)胸腺瘤术后复发。所有患者均于检查前签署了知情同意书。
-
采用德国西门子公司生产的Biograph 16 HR PET/CT扫描仪。18F-FDG由美国GE公司PET tracer回旋加速器系统生产,放射化学纯度>95%。所有患者检查前至少禁食6 h,测空腹血糖并控制血糖≤7.0 mmol/L,按患者体重经静脉注射18F-FDG 3.70~5.55 MBq/kg后安静休息1 h左右,排空膀胱后行18F-FDG PET/CT扫描,先行CT扫描:采用动态剂量控制模式选择毫安量,随扫描部位不同而动态变化,层厚5.0 mm,准直1.5 mm;再行PET数据采集:三维模式采集6~7个床位,2~3 min/床位;应用CT数据进行衰减校正,迭代法重建后获得图像。
-
由2位具有10年以上工作经验的核医学科医师独立阅片。在TET病灶18F-FDG摄取最高的横断面勾画ROI,获得病灶的SUVmax,意见不一致时由科室集体讨论决定。
-
参照WHO(2015)TET病理分型将TET分为低危型胸腺瘤(A、AB、B1型)、高危型胸腺瘤(B2、B3型)和胸腺癌(C型)3组。临床分期采用Masaoka分期标准进行分期,将TET患者分为Ⅰ期、Ⅱ期和Ⅲ期 3组。将TET分为胸腺瘤(包括低危型胸腺瘤和高危型胸腺瘤)和胸腺癌2组,进行SUVmax的鉴别诊断分析。
-
采用SPSS 17.0软件进行统计学分析。符合偏态分布的计量资料以M(P25,P75)表示,3组间的比较采用Kruskal-Wallis秩和检验,2组间的比较采用Mann-Whitney U检验。采用ROC曲线计算SUVmax和鉴别诊断胸腺瘤与胸腺癌的AUC。P<0.05为差异有统计学意义。
-
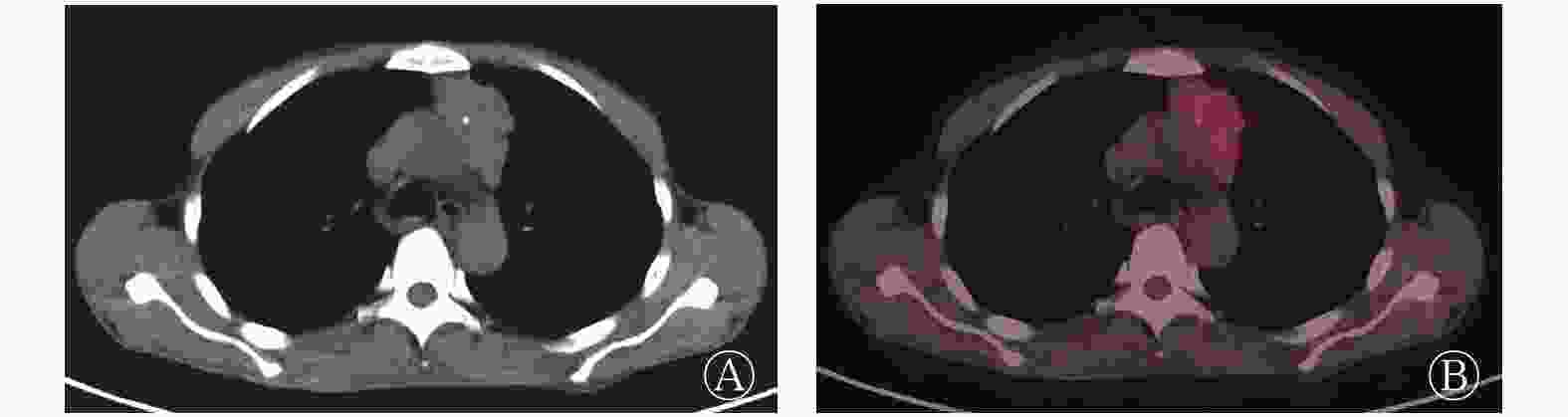
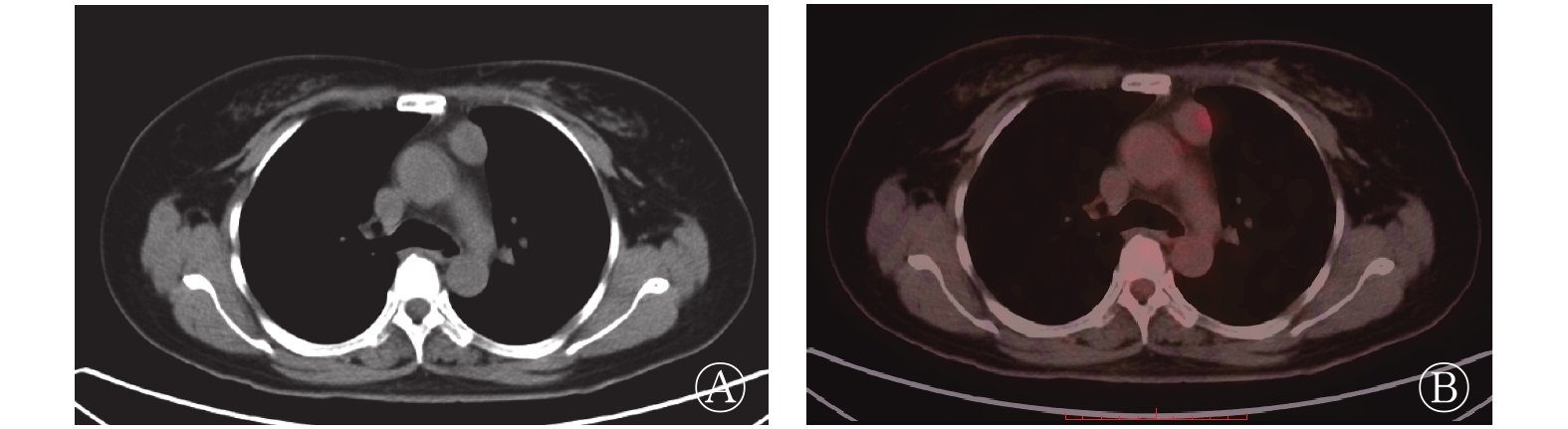
40例患者中,低危型胸腺瘤11例(A型1例、AB型4例、B1型6例),典型病例的PET/CT显像结果见图1;高危型胸腺瘤15例(B2型10例、B3型5例)(图2);胸腺癌14例(图3)。按Masaoka分期标准进行分期的结果:Ⅰ期8例、Ⅱ期17例、Ⅲ期15例。40例TET患者肿瘤病灶的SUVmax为5.58(4.55,8.58)。
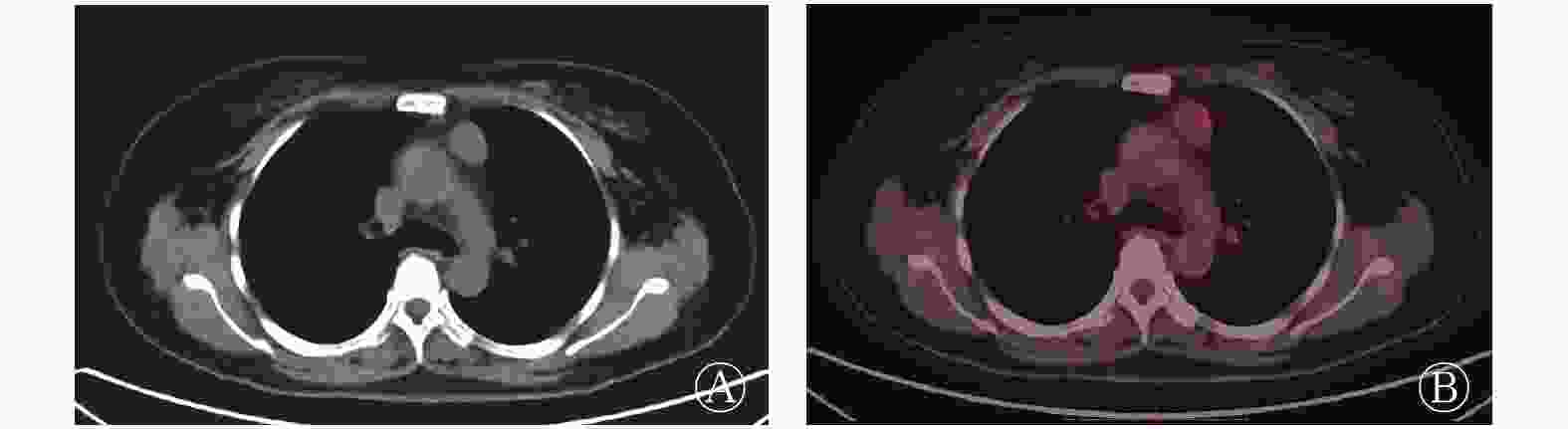
图 1 胸腺瘤AB型患者(女性,57岁)的18F-FDG PET/CT显像图 图中,A:CT横断面图,显示左前纵隔有一长径约3.3 cm的软组织肿块影,边界清晰,密度均匀;B:PET/CT横断面融合图,显示肿块对18F-FDG的代谢轻度增高,SUVmax=2.99。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值
Figure 1. 18F-FDG PET/CT images of type AB thymoma in a 57-year-old woman
-
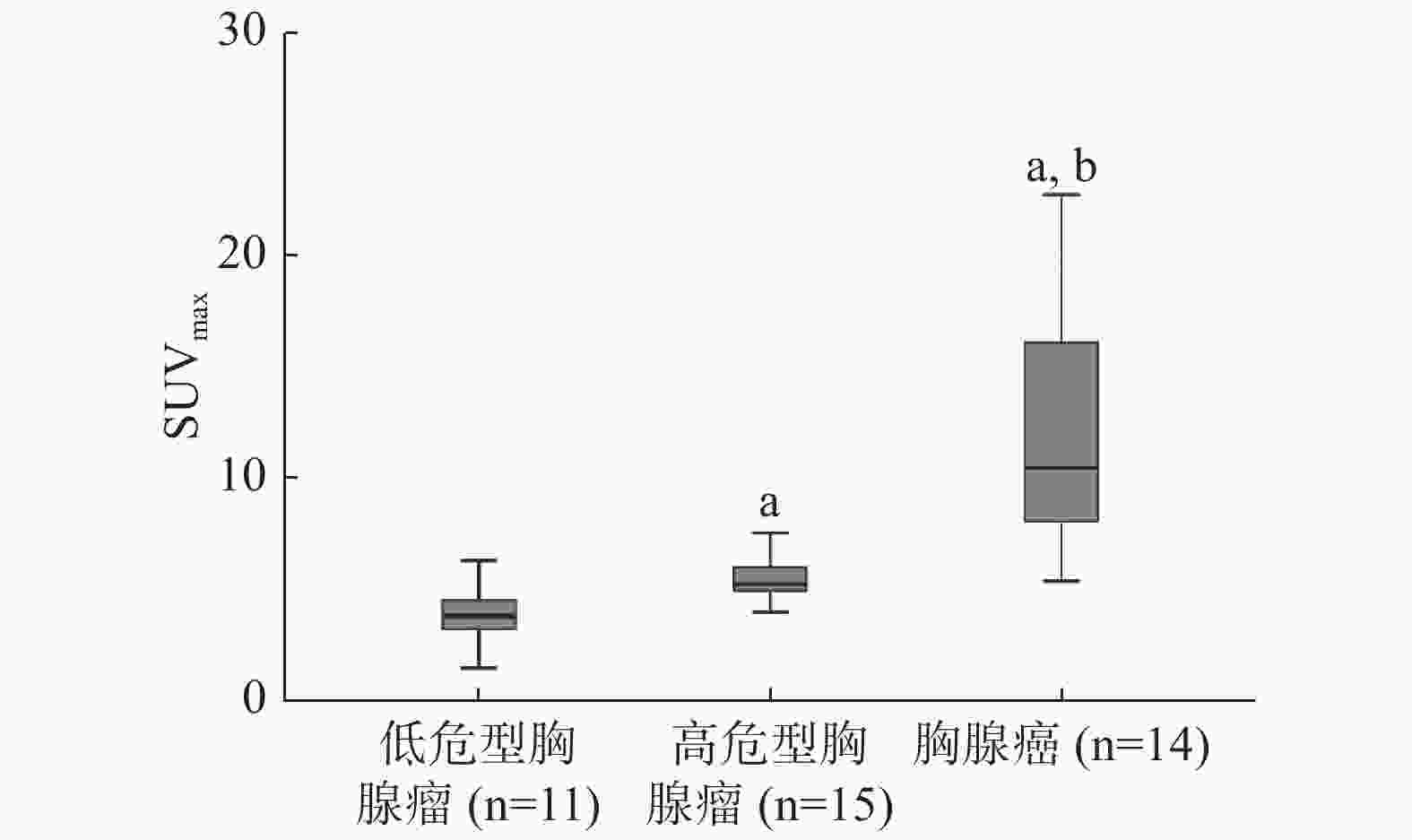
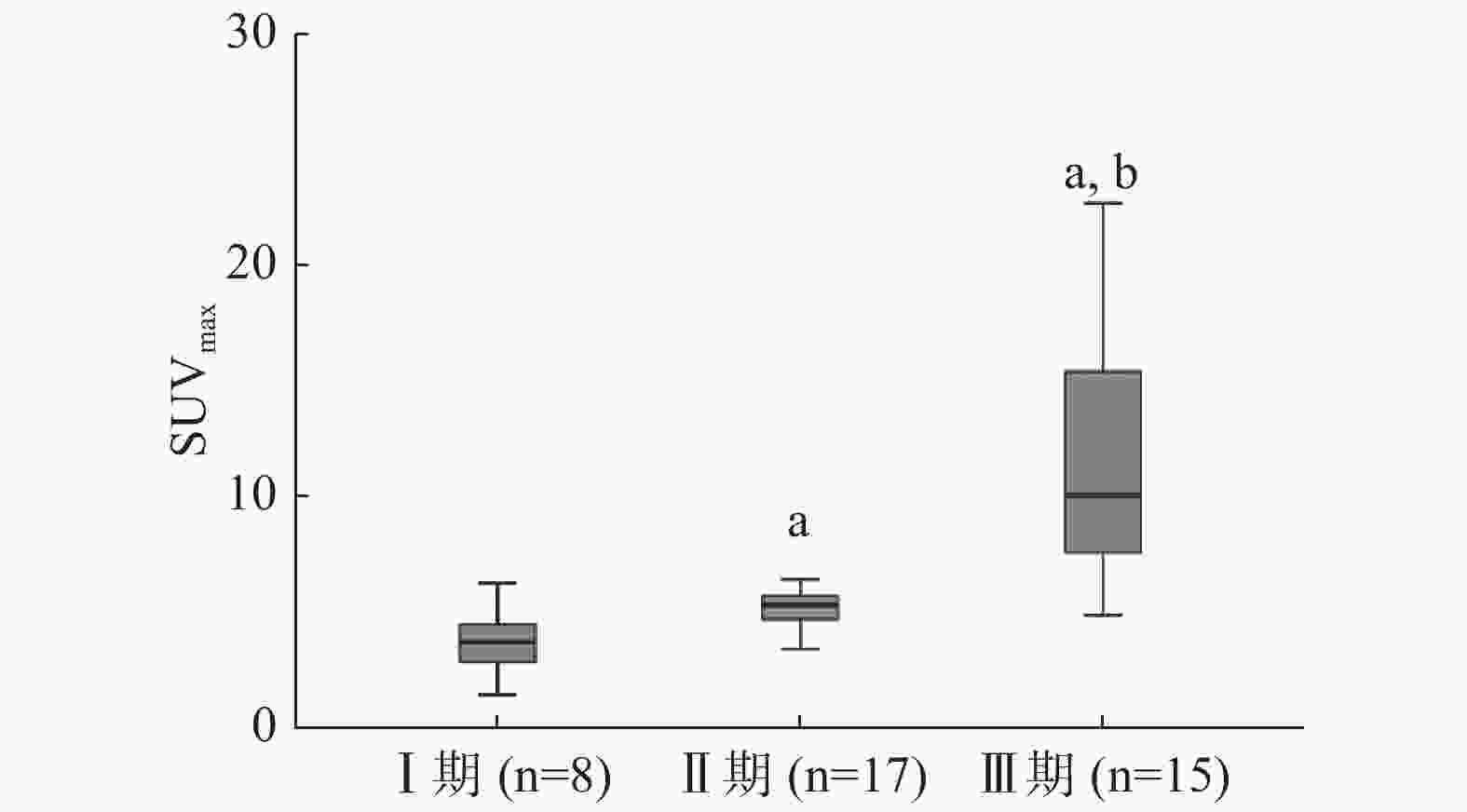
低危型胸腺瘤、高危型胸腺瘤和胸腺癌3组的SUVmax结果见表1。3组间SUVmax的差异有统计学意义(χ2=26.716,P<0.01)。3组间PET代谢参数的比较见图4。Ⅰ期、Ⅱ期、Ⅲ期3组间SUVmax差异有统计学意义(χ2=22.295,P<0.01),各组间PET代谢参数的比较见图5。
分型与分期 例数 SUVmax[M(P25,P75)] 低危型胸腺瘤 11 3.78(2.99,4.53) A型 1 1.45 AB型 4 3.34(2.82,3.78) B1型 6 4.49(4.09,5.56) 高危型胸腺瘤 15 5.21(4.89,6.24) B2型 10 5.18(4.69,5.67) B3型 5 6.24(4.94,7.19) 胸腺癌(C型) 14 10.44(7.82,16.61) Masaoka分期 Ⅰ期 8 3.74(3.11,4.51) Ⅱ期 17 5.14(4.66,5.69) Ⅲ期 15 10.08(7.52,16.07) 注:表中,A型、AB型、B1型、B2型、B3型和C型为WHO(2015)胸腺上皮性肿瘤的病理分型。低危型胸腺瘤、高危型胸腺瘤和胸腺癌3组间SUVmax的差异有统计学意义(χ2=26.716,P<0.01);Ⅰ期、Ⅱ期、Ⅲ期3组间SUVmax的差异有统计学意义(χ2=22.295,P<0.01)。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;WHO:世界卫生组织 表 1 40例胸腺上皮性肿瘤患者18F-FDG PET/CT的SUVmax
Table 1. Maximum standardized uptake value of 18F-FDG PET/CT in 40 patients with thymic epithelial tumor
-
胸腺瘤和胸腺癌2组的ROC曲线分析结果:SUVmax鉴别诊断2组的AUC为0.953(95%CI:0.891~1.000,P<0.01);SUVmax=6.81是鉴别诊断胸腺瘤与胸腺癌的最佳临界值,其灵敏度为85.7%、特异度为92.3%。
-
TET是前纵隔最常见的肿瘤,其生物学及形态学表现多样,临床表现和预后差别较大。WHO病理分型可反映肿瘤的生物学行为、临床特征和预后,胸腺癌预后明显差于胸腺瘤,且胸腺癌和胸腺瘤的治疗方案也不一致。18F-FDG PET/CT在肺癌、淋巴瘤等多种肿瘤的诊断、分期及疗效评价中的作用已得到临床的认可[4-5];但是关于18F-FDG PET/CT在TET诊断及分期中的作用,研究报道少见。有学者认为,TET的18F-FDG摄取与WHO病理分型及预后有一定的相关性[6~7]。Eguchi等[8]回顾性分析了20例TET患者的18F-FDG PET/CT显像资料,根据WHO病理分型,将患者分为低危组(A、AB和B1型)和高危组(B2、B3和C型),低危组SUVmax=3.09±0.51,高危组SUVmax=6.19±3.13,2组的SUVmax差异有统计学意义(P=0.019);以SUVmax=3.5作为临界值,PET/CT鉴别诊断低危组TET与高危组TET的灵敏度为92.3%、特异度为83.3%。Fukumoto等[9]将TET患者分为低危组(A、AB和B1型)、高危组(B2和B3型)和胸腺癌组(C型),结果显示,3组的中位SUVmax分别为3.6、4.1和7.2,胸腺癌组的SUVmax明显高于低危组和高危组(均P<0.01),而低危组和高危组的SUVmax无明显差别(P=0.204)。Park等[10]也将TET患者分为低危组(A、AB和B1型)、高危组(B2和B3型)和胸腺癌组(C型),3组的中位SUVmax分别为3.43、4.42和8.23,胸腺癌组的SUVmax明显高于高危组和低危组胸腺瘤(均P<0.001),且高危组的SUVmax也明显高于低危组(P=0.030)。本研究结果显示,低危组、高危组和胸腺癌组的中位SUVmax分别3.78、5.21和10.44,两两比较差异均有统计学意义(均P<0.01),ROC曲线分析结果显示,以SUVmax=6.81为临界值,PET/CT鉴别诊断胸腺瘤与胸腺癌的灵敏度为85.7%、特异度为92.3%。这与Park等[10]的研究结果相似,而与Fukumoto等[9]的研究结果不一致。分析认为:①可能与胸腺瘤的异质性较强有关,同一病理类型的TET,SUVmax差别较大,Fukumoto等[9]的研究中,同为B1型胸腺瘤,SUVmax范围为1.1~5.8,因此纳入的研究对象不一致,可能会导致研究结果不完全一致。② SUVmax受多种因素的影响,如患者的体重、血糖水平、注射显像剂与数据采集的时间间隔及图像衰减校正等,也可能会导致研究结果不完全一致。
目前,TET的分期临床上广泛使用Masaoka分期方法。研究结果表明,Masaoka分期与TET的预后相关,所以Masaoka分期一直被视为制定治疗计划和判断预后的临床关键性指标[11~12];而Masaoka分期方法是根据术后结果来确定的,因此,如何于术前对患者的Masaoka分期进行预判,从而给患者制定个体化治疗计划提供参考依据,是目前研究的热点。本研究结果显示,SUVmax与Masaoka分期具有较好的相关性,Ⅲ期的SUVmax最高,其次是Ⅱ期,最低是Ⅰ期。因此,可根据病灶的SUVmax对患者的Masaoka分期进行预判。这与Eguchi等[8]的研究结果相似。
本研究的不足之处:①本研究为回顾性研究,且样本量较少;②由于胸腺瘤术后较少发生复发或转移,患者的生存期较长,因此本研究未能分析SUVmax与预后的关系,将来随着随访时间的延长,有望进一步研究SUVmax与预后的关系;③由于影响SUVmax的因素较多,还需多中心的大宗临床研究来明确SUVmax鉴别胸腺瘤与胸腺癌的临界值。
总之,18F-FDG PET/CT的参数SUVmax与TET的WHO病理分型具有较好的相关性,可作为初步判断低危型胸腺瘤、高危型胸腺瘤及胸腺癌的指标之一。SUVmax与Masaoka分期相关性较好,可为临床制定治疗计划和判断预后提供参考。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 周倩茹负责病例的收集、数据的采集与分析、论文的撰写;丁重阳负责研究命题的提出与设计、论文的审阅与修订。
胸腺上皮性肿瘤18F-FDG PET/CT显像最大标准化摄取值与WHO病理分型及Masaoka分期的关系
Relationship between the maximum standardized uptake value of 18F-FDG PET/CT and WHO pathological classification and Masaoka stage of thymic epithelial tumors
-
摘要:
目的 探讨胸腺上皮性肿瘤(TET)术前18F-FDG PET/CT显像最大标准化摄取值(SUVmax)与世界卫生组织(WHO)病理分型及Masaoka分期的关系。 方法 回顾性分析2007年9月至2019年3月于南京医科大学第一附属医院经手术病理学结果证实的40例TET患者的临床资料,其中男性14例、女性26例,年龄32~79岁。分析所有患者的术前18F-FDG PET/CT显像资料,测定病灶的SUVmax。参照WHO(2015) TET病理分型将TET患者分为低危型胸腺瘤(A、AB、B1型)、高危型胸腺瘤(B2、B3型)和胸腺癌(C型)3组;采用Masaoka分期标准将TET患者分为Ⅰ期、Ⅱ期和Ⅲ期 3组;将TET患者分为胸腺瘤(包括低危型胸腺瘤和高危型胸腺瘤)和胸腺癌2组,采用受试者工作特征(ROC)曲线计算SUVmax和曲线下面积(AUC)。3组间的比较采用Kruskal-Wallis秩和检验,2组间的比较采用 Mann-Whitney U检验。 结果 低危型胸腺瘤11例(A型1例、AB型4例、B1型6例),高危型胸腺瘤15例(B2型10例、B3型5例),胸腺癌14例。Masaoka分期:Ⅰ期8例,Ⅱ期17例,Ⅲ期15例。低危型胸腺瘤、高危型胸腺瘤和胸腺癌的中位SUVmax分别为3.78、5.21和10.44,3组间SUVmax的差异有统计学意义(χ2=26.716,P<0.01);组间的两两比较差异均有统计学意义(Z=3.088、−3.928、4.106,均P<0.01)。Ⅰ期、Ⅱ期、Ⅲ期的中位SUVmax分别为3.74、5.14、10.08,3组间SUVmax的差异有统计学意义(χ2=22.295,P<0.01),组间的两两比较差异均有统计学意义(Z=2.680、3.679、−3.644,均P<0.01)。ROC曲线分析结果:AUC为0.953(95%可变区间:0.891~1.000,P<0.01);SUVmax=6.81是鉴别诊断胸腺瘤与胸腺癌的最佳临界值。 结论 18F-FDG PET/CT 的参数SUVmax与TET的WHO病理分型及Masaoka分期具有较好的相关性,可为临床制定治疗计划提供参考。 -
关键词:
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 胸腺上皮性肿瘤 /
- 氟脱氧葡萄糖F18 /
- 最大标准化摄取值
Abstract:Objective To investigate the relationship between the maximum standardized uptake value (SUVmax) of preoperative 18F-FDG PET/CT and the World Health Organization (WHO) pathological classification and Masaoka stage of thymic epithelial tumors. Methods A total of 40 patients (14 males and 26 females ranging in age from 32 years to 79 years) was retrospectively reviewed with histologically proven thymic epithelial tumors who underwent 18F-FDG PET/CT before surgical resection at the First Affiliated Hospital of Nanjing Medical University from September 2007 to March 2019. SUVmax was measured. The patients were divided into three groups in accordance with a simplified pathological classification scheme WHO (2015): low-risk thymomas (types A, AB, and B1), high-risk thymomas (types B2 and B3), and thymic carcinomas (type C). In addition, all tumors were divided into three groups on the basis of the Masaoka stage: stages Ⅰ, Ⅱ, and Ⅲ. The area under the curve (AUC) calculated via receiver operating characteristic (ROC) curve analysis was used to estimate the best value of SUVmax that was capable of discriminating thymomas from thymic carcinomas. Groups were compared by using the Mann-Whitney test or Kruskal-Wallis test. Results A total of 11 low-risk thymomas (1 type A, 4 type AB, and 6 type B1), 15 high-risk thymomas (10 type B2 and 5 type B3), and 14 thymic carcinomas were identified. Eight, 17, and 15 patients were in Masaoka stages Ⅰ, Ⅱ, and Ⅲ, respectively. The median SUVmax value was 3.78 for low-risk thymomas, 5.21 for high-risk thymomas, and 10.44 for thymic carcinomas and was significantly different among groups (Z=3.088, −3.928, 4.106; all P<0.01), the difference in SUVmax between the 3 groups is statistically significant (χ2=26.716, P<0.01). The values for Masaoka stages Ⅰ, Ⅱ, and Ⅲ were 3.74, 5.14, and 10.08, respectively, and showed significant differences when compared with each other (Z=2.680, 3.679, −3.644; all P<0.01), the difference in SUVmax between the 3 groups is statistically significant (χ2=22.295, P<0.01) . The results of ROC curve analysis showed that the AUC of SUVmax was 0.953 (95% confidence interval: 0.891–1.000, P<0.01). SUVmax=6.81 was the best threshold for the differential diagnosis of thymomas and thymic carcinomas. Conclusions SUVmax measured by 18F-FDG PET/CT had a good correlation with the pathological classification and Masaoka stage of thymic epithelial tumors. Therefore, it can provide reference value for planning clinical treatment. -
表 1 40例胸腺上皮性肿瘤患者18F-FDG PET/CT的SUVmax
Table 1. Maximum standardized uptake value of 18F-FDG PET/CT in 40 patients with thymic epithelial tumor
分型与分期 例数 SUVmax[M(P25,P75)] 低危型胸腺瘤 11 3.78(2.99,4.53) A型 1 1.45 AB型 4 3.34(2.82,3.78) B1型 6 4.49(4.09,5.56) 高危型胸腺瘤 15 5.21(4.89,6.24) B2型 10 5.18(4.69,5.67) B3型 5 6.24(4.94,7.19) 胸腺癌(C型) 14 10.44(7.82,16.61) Masaoka分期 Ⅰ期 8 3.74(3.11,4.51) Ⅱ期 17 5.14(4.66,5.69) Ⅲ期 15 10.08(7.52,16.07) 注:表中,A型、AB型、B1型、B2型、B3型和C型为WHO(2015)胸腺上皮性肿瘤的病理分型。低危型胸腺瘤、高危型胸腺瘤和胸腺癌3组间SUVmax的差异有统计学意义(χ2=26.716,P<0.01);Ⅰ期、Ⅱ期、Ⅲ期3组间SUVmax的差异有统计学意义(χ2=22.295,P<0.01)。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;WHO:世界卫生组织 -
[1] Oselin K, Girard N, Lepik K, et al. Pathological discrepancies in the diagnosis of thymic epithelial tumors: the Tallinn-Lyon experience[J]. J Thorac Dis, 2019, 11(2): 456−464. DOI: 10.21037/jtd.2018.12.123. [2] Marx A, Chan JKC, Coindre JM, et al. The 2015 World Health Organization classification of tumors of the thymus: continuity and changes[J]. J Thorac Oncol, 2015, 10(10): 1383−1395. DOI: 10.1097/JTO.0000000000000654. [3] Ishibashi M, Tanabe Y, Yunaga H, et al. Usefulness of preoperative 18F-FDG PET/CT for patients with thymic epithelial tumors[J]. Yonago Acta Med, 2019, 62(1): 146−152. DOI: 10.33160/yam.2019.03.020. [4] 高珂梦, 丁重阳, 孙晋, 等. 原发性肺黏膜相关淋巴组织淋巴瘤的18F-FDG PET/CT影像学表现[J]. 国际放射医学核医学杂志, 2019, 43(2): 140−144. DOI: 10.3760/cma.j.issn.1673-4114.2019.02.008.
Gao KM, Ding CY, Sun J, et al. 18F-FDG PET/CT manifestation of primary pulmonary mucosa-associated lymphoid tissue lymphoma[J]. Int J Radiat Med Nucl Med, 2019, 43(2): 140−144. DOI: 10.3760/cma.j.issn.1673-4114.2019.02.008.[5] 丁辉, 胡传贤, 黄苏, 等. 基于CT和18F-FDG PET/CT的肺癌风险预测模型对肺结节恶性风险的验证研究[J]. 国际放射医学核医学杂志, 2019, 43(1): 17−21. DOI: 10.3760/cma.j.issn.1673-4114.2019.01.004.
Ding H, Hu CX, Huang S, et al. Verification of malignant risk of pulmonary nodules based on CT and 18F-FDG PET/CT prediction model[J]. Int J Radiat Med Nucl Med, 2019, 43(1): 17−21. DOI: 10.3760/cma.j.issn.1673-4114.2019.01.004.[6] Lococo F. The role of 18F-FDG PET/CT scan in predicting histological type of thymic epithelial tumors: indications and practical clinical considerations[J]. Thorac Cardiovasc Surg, 2018, 66(4): 350−351. DOI: 10.1055/s-0037-1604209. [7] Lee HS, Oh JS, Park YS, et al. Differentiating the grades of thymic epithelial tumor malignancy using textural features of intratumoral heterogeneity via 18F-FDG PET/CT[J]. Ann Nucl Med, 2016, 30(4): 309−319. DOI: 10.1007/s12149-016-1062-2. [8] Eguchi T, Yoshida K, Hamanaka K, et al. Utility of 18F-fluorodeoxyglucose positron emission tomography for distinguishing between the histological types of early stage thymic epithelial tumours[J]. Eur J Cardiothorac Surg, 2012, 41(5): 1059−1062. DOI: 10.1093/ejcts/ezr144. [9] Fukumoto K, Taniguchi T, Ishikawa Y, et al. The utility of [18F]-fluorodeoxyglucose positron emission tomography-computed tomography in thymic epithelial tumours[J]. Eur J Cardiothorac Surg, 2012, 42(6): e152−e156. DOI: 10.1093/ejcts/ezs527. [10] Park SY, Cho A, Bae MK, et al. Value of 18F-FDG PET/CT for predicting the World Health Organization malignant grade of thymic epithelial tumors: focused in volume-dependent parameters[J]. Clin Nucl Med, 2016, 41(1): 15−20. DOI: 10.1097/RLU.0000000000001032. [11] Gong J, Jin S, Pan X, et al. Identification of long non-coding RNAs for predicting prognosis among patients with thymoma[J]. Clin Lab, 2018, 64(7): 1193−1198. DOI: 10.7754/Clin.Lab.2018.180136. [12] Tomita M, Ayabe T, Tsuchiya K, et al. Fluorodeoxyglucose positron emission tomography can provide useful information for differentiating thymic epithelial tumors[J]. Thorac Cardiovasc Surg, 2018, 66(4): 345−349. DOI: 10.1055/s-0037-1604208. -





 下载:
下载: