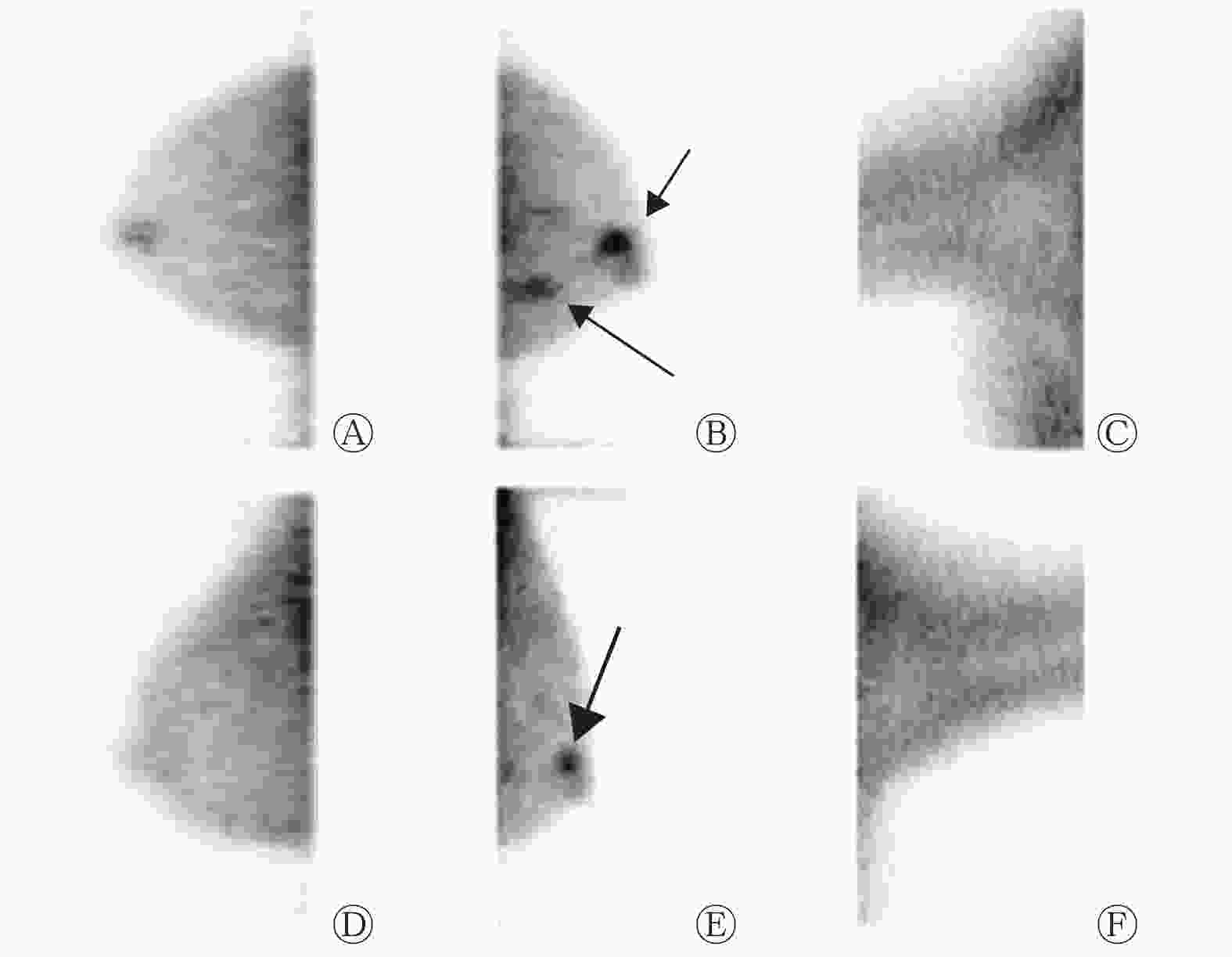
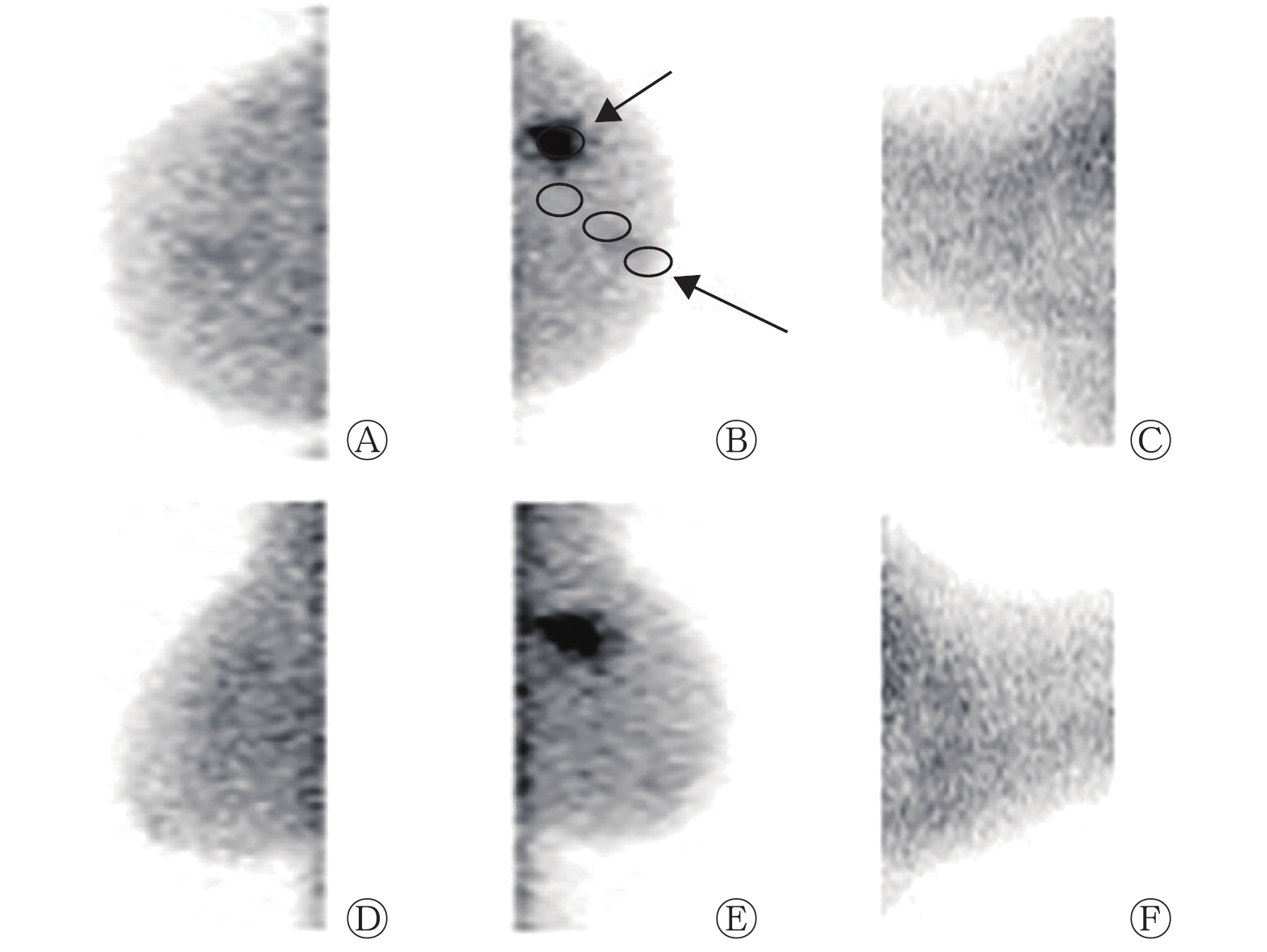
-
乳腺癌是一种具有多种病理类型和分子分型的异质性疾病,早期诊断和治疗能够提高乳腺癌患者的生存率[1]。乳腺专用γ显像(breast-specific gamma imaging,BSGI)是近年来一种新的核医学分子功能显像方法。与乳腺X线摄影相比,BSGI对乳腺致密型、有瘢痕组织或植入物的患者有更高的诊断灵敏度和特异度[2-3]。研究结果显示,肿瘤与正常组织放射性比值(tumor to normal tissue ratio,TNR)与肿瘤大小和病理学分型等因素相关[4-6]。国内BSGI半定量分析TNR与乳腺癌病理学对比的研究相对较少,且目前TNR的测量方法不同,使得研究结果不一致[5-7],因此值得进一步探讨。本研究中,我们探讨BSGI的TNR与乳腺浸润性导管癌(invasive ductal breast carcinoma,IDC)临床病理学的对比研究价值。
-
回顾性分析2016年4月至2017年8月贵州省人民医院符合纳入标准的女性患者84例,年龄30~76(53.2±13.1)岁。纳入标准:(1)病理学结果证实为IDC;(2)BSGI前未接受过任何治疗,显像后进行手术治疗,且有完整的组织病理学分型资料;(3)BSGI的图像质量及拍摄体位符合诊断标准。排除标准:(1)术前接受新辅助化疗、放疗或穿刺者;(2)乳腺影像学检查(乳腺X线摄影、超声及MRI)初始分期已发生远处转移(排除乳腺腋窝前哨淋巴结转移)。纳入本研究的患者均为单侧乳腺癌患者,其中75例为单侧单发肿瘤,9例为单侧多灶性肿瘤,单侧多灶性肿瘤只纳入一个经病理学结果确诊的肿瘤大小及病理学资料。所有患者均于检查前签署了知情同意书。
-
BSGI仪由美国Dilon Technologies公司生产(型号SN 11-0164);99Mo-99Tcm发生器、99Tcm-MIBI由中国原子能科学研究院同位素研究所提供,99Tcm-MIBI放射化学纯度>95%;薄层色谱分析仪为美国Bioscan公司APIMSI-00174型。
-
在患者患乳对侧肘静脉或手背静脉注射99Tcm-MIBI(740 MBq),注射后5 min采用低能通用型准直器采集,窗口能量(140±14) keV。分别采集双侧乳房头尾位、内外侧斜位和双侧腋窝切线位图像,采集时间 6 min/体位。
-
由2位核医学科医师(分别有核医学诊断工作经验4年和6年)独立判断分析图像,意见不一致时协商达成一致。根据2010年美国核医学会(SNM)乳腺影像报告和数据系统(breast imaging reporting and data system,BIRADS)指南[8],将BSGI结果分为5级,其中,1级:未见明显局灶性摄取或弥漫性放射性分布;2级:正常乳腺实质小片状或斑片状放射性摄取;3级:可见片状或斑片状放射性异常摄取灶;4级:可见异常并伴少量斑片状和局灶性摄取;5级:明显异常并局灶性放射性高浓聚灶伴腋窝显像剂浓聚。1、2、3级定义为阴性,4、5级为阳性。
在BSGI上勾画摄取99Tcm-MIBI肿瘤病灶的ROI,测量ROI的最大像素值作为肿瘤摄取值。正常组织放射性的测量方法:选取头尾位和内外斜位从乳头至乳腺实质深部基底勾画3个 ROI,每个长径2.0 cm。TNR=肿瘤病灶的最大像素值/正常组织的平均像素值(图1中B)。
-
BSGI与外科手术的间隔时间为(8±3) d。根据患者电子病历系统回顾性分析肿瘤病理学参数:肿瘤大小、腋窝淋巴结转移、核分级、组织学分级、细胞增殖核抗原Ki-67(简称Ki-67)指数、雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达。将病变的最大径作为肿瘤大小。核分级和组织学分级采用Bloom-Scarff-Richardson分级法[9]测定。根据美国临床肿瘤学会和美国病理学会临床实践指南[10]对乳腺癌ER、PR、HER2的表达进行解释。根据Allred评分系统[11]确定ER和PR的阳性结果。Ki-67指数采用免疫组化法测定。免疫组化评分3+定义为HER2阳性。
乳腺癌分为4种分子亚型[12]:Luminal A型[ER阳性和(或)PR阳性、HER2阴性、Ki-67指数<14%],Luminal B型 [ER阳性和(或)PR阳性、HER2阴性、Ki-67指数≥14%,或ER阳性和(或)PR阳性、HER2阳性、与Ki-67表达无关],ERBB2(酪氨酸激酶受体2)+型(ER阴性、PR阴性和HER2阳性)和Basal-like型(ER阴性、PR阴性和HER2阴性)。
-
采用SPSS 20.0软件进行统计学分析。符合正态分布的数据用
$ \bar x$ ±s表示。单因素分析时,符合方差齐性的两组计量资料的比较采用t检验,计数资料的比较采用卡方检验,多组病理亚型之间的比较采用方差分析(ANOVA)。多因素分析时, 根据单因素分析结果及临床意义来确定有意义的独立危险因素 ,再行多因素分析乳腺癌病理的危险因素,TNR与连续变量的分析采用多元线性回归,对TNR与非连续变量进行多元分析时,将TNR转换为二分量后运用多元Logistic回归分析。TNR与组织病理学因素之间的相关性采用Pearson积差相关分析,相关系数r在0.6~0.8之间为高度相关,r在0.40~0.59之间为中度正相关,r<0.4为弱正相关,r为负值为负相关。P<0.05为差异有统计学意义。 -
84例IDC患者中,BSGI诊断出75例为阳性,灵敏度为89.3%(75/84)(典型病例显像结果见图1~2),9例为阴性。其中右乳病变46例,左乳病变38例,肿瘤大小为0.5~10.0(2.4±1.3) cm。长径<1 cm的患者有15例,肿瘤大小为0.5~0.9(0.7±0.1) cm,其中BSGI诊断出12例为阳性(80%,12/15)。BSGI诊断出20例患者有腋窝淋巴结转移。
-
BSGI诊断结果为阳性与阴性的患者比较:患者年龄的差异无统计学意义(t=8.45,P=0.326)。BSGI显像诊断阳性肿瘤大小为0.5~10.0(2.4±1.8) cm、阴性肿瘤大小为0.7~3.3(1.7±0.9) cm。BSGI诊断阳性与阴性病灶正常组织平均摄取值(每像素计数)的差异无统计学意义(92.3±15.4对94.5±28.6,t=12.54,P=0.475)。
-
BSGI诊断为阳性的75例乳腺癌患者中,单因素分析结果显示,肿瘤大小(t=4.13,P<0.01)、腋窝淋巴结是否转移(χ2=5.04,P=0.005)、不同病理组织学分级(F=11.05,P=0.034)、PR表达(χ2=3.12,P=0.041)和Ki-67指数(χ2=16.20,P=0.008)的TNR差异有统计学意义。多因素分析结果显示,乳腺癌的病理危险因素分别为肿瘤长径≥2 cm(OR=2.186,P=0.004)、腋窝淋巴结转移(OR=1.673,P=0.047)和PR阴性(OR=0.420,P=0.032)(表1)。
参数 例数 TNR ( $\bar x \pm s $ 

单因素分析 多因素分析 t/χ2/F值 P值 OR值 P值 肿瘤大小 4.13 <0.01 2.186 0.004 ≥2 cm 35 4.9±2.3 <2 cm 40 3.2±1.3 腋窝淋巴结转移 5.04 0.005 1.673 0.047 是 19 4.7±1.6 否 56 3.5±1.7 病理亚型 23.14 0.170 − Luminal A型 28 3.3±1.2 Luminal B型 21 4.2±1.8 ERBB2+型 11 4.8±2.7 Basal-like型 15 3.6±2.0 是否为Luminal A型 6.13 0.009 − Luminal A型 31 3.2±1.1 非Luminal A型 44 4.3±1.1 ERBB2+型 2.06 0.301 − 阳性 22 4.3±2.2 阴性 53 3.8±1.3 Basal-like型 3.17 0.462 − 阳性 18 4.3±1.2 阴性 57 3.8±1.6 核分级 8.21 0.126 − 1级 27 2.5±1.1 2级 32 3.7±1.4 3级 16 4.0±1.5 组织学分级 11.05 0.034 − 1级 21 3.1±1.1 2级 25 3.9±1.7 3级 29 4.5±1.8 雌激素受体 2.15 0.072 − 阳性 47 3.6±1.4 阴性 28 4.3±2.2 孕激素受体 3.12 0.041 0.420 0.032 阳性 46 3.6±1.5 阴性 29 4.6±2.3 Ki-67指数 16.20 0.008 − 低(<14%) 40 3.4±1.2 高(≥14%) 35 4.4±1.9 注:表中,ERBB2:酪氨酸激酶受体2;Ki-67:细胞增殖核抗原Ki-67;TNR:肿瘤与正常组织放射性比值;−:单因素分析无统计学差异时,没有进一步行多因素分析 表 1 肿瘤与正常组织放射性比值与乳腺癌临床病理结果的相关性分析(n=75)
Table 1. Correlations between tumor to normal tissue radiation ratio and breast cancer pathology (n=75)
由表1可知,乳腺癌4种病理亚型的TNR之间的差异无统计学意义(F=23.14,P=0.170);而Luminal A型的TNR(3.2±1.1)和非Luminal A型的TNR(4.3±1.1)之间的差异有统计学意义(χ2=6.13,P=0.009)。
Pearson相关性分析结果显示,TNR与肿瘤大小呈弱正相关(r=0.353,P=0.004);与Ki-67指数呈中度正相关(r=0.452,P=0.014);与PR Allred评分呈负相关(r=−0.364,P=0.026)(图3)。
-
乳腺分子功能成像(包括99Tcm-MIBI BSGI和18F-FDG乳腺专用PET显像)被广泛用于肿瘤诊断、疗效监测和预后评估[13],SUVmax是临床肿瘤常用的有效预测因子[14-15]。传统的全身大视野SPECT/CT和PET/CT空间分辨率低且对小病灶检测的灵敏度也较低。近年来,由于探测器性能的提高,具有高分辨率、小视野的BSGI仪能够检测到毫米级病变,BSGI 的TNR逐渐成为一种有前景的乳腺癌临床评价指标,并且成为评估乳腺癌预后和肿瘤增殖的有效指标之一[16-17]。BSGI对乳腺癌的诊断特异度比MRI高[18],并且BSGI能够减少乳腺MRI中不必要的有创乳腺活检。
本研究结果中,BSGI诊断出75例阳性患者和9例阴性患者。其中9例假阴性的可能原因:(1)部分肿瘤位置较深,有一小部分定位超出γ显像的视野;(2)肿瘤长径<1 cm,9例阴性患者中,6例病灶位于与胸壁相邻的较深区域,3例病灶为长径<1 cm的小结节(分别为0.6、0.7、0.8 cm)。
本研究探讨BSGI的TNR与IDC临床病理学的对比研究,结果表明,IDC的不同肿瘤大小、腋窝淋巴结是否转移、不同病理组织学分级、PR表达和Ki-67指数的TNR差异有统计学意义,且TNR越大,与上述病理特征越相关。多因素分析结果显示,TNR与乳腺癌肿瘤大小、腋窝淋巴结是否转移和PR表达相关。本研究结果显示,IDC TNR仅与乳腺癌PR表达有相关性,与ER表达无相关性,与文献研究结果一致[9]。Cwikla等[19]研究结果显示,TNR与肿瘤大小、腋窝淋巴结转移、肿瘤分级和PR表达有关,这一结果与本研究结果一致。
Tadwalkar等[20]和Yoon等[7]研究结果显示,BSGI诊断乳腺癌的效能与其分化程度有关。然而本研究结果显示,核分级、ER和HER2表达的差异对TNR的影响无统计学意义。其原因之一可能是不同研究的样本量不同,文献[20]和文献[7]的样本量分别为139例和162例,大于本研究的样本量;其次,Yoon等[7]排除了长径<1 cm的肿瘤,而本研究包括了长径<1 cm的肿瘤,本研究的目的在于评估BSGI的诊断能力,因为无论肿瘤大小如何,都需要进一步研究解决临床肿瘤大小的分布差异。
文献[5]及本研究结果均显示,BSGI的TNR是IDC Luminal A型和 非Luminal A型的潜在预测指标。Luminal A型是乳腺癌最常见的亚型,约占乳腺癌的50%~60%。Luminal A型的乳腺癌患者主要采用内分泌激素治疗,其复发率明显低于其他分子亚型且预后良好[21]。
Tan等[6]研究结果表明,ER、PR、HER2和Ki-67不同表达的TNR的差异有统计学意义。本研究的结果与其结果不同是因为两个研究的乳腺癌病理类型和TNR的测量方法不同。(1)Tan等[6]的研究中,乳腺癌包括多个病理学类型(恶性分叶状肿瘤、浸润性小叶癌和IDC等);(2)TNR的测量方法不同,在本研究中,我们发现在勾画ROI时应考虑以下影响因素:虽然正常乳腺组织的放射性基本均匀,但乳腺各个深度的放射性计数存在差异,近乳头区域放射性较低,近胸壁(由于心脏、胸壁、肝脏等的影响)放射性较高,而非肿瘤部位的放射性计数高低(包括肿瘤浸润周边)对小肿瘤的TNR有较大的影响,因此在勾画非肿瘤ROI时应尽可能从乳头右下方到乳腺基底部的纵轴连续获得3个ROI的正常乳腺背景计数的平均值(图1),这种乳腺正常组织计数的测量方法能够反映不同密度的正常乳腺组织和肿瘤浸润的情况。但到目前为止,国内外还没有标准化的TNR测量方法。
本研究的局限性:(1)本研究属于回顾性研究,部分患者的月经周期变化可能会对结果有一定影响,需要前瞻性队列研究的验证。(2)本研究仅纳入了IDC患者,尽管它是乳腺癌最常见的组织病理学类型,但是由于肿瘤的进展是动态变化的,其TNR与病理的对比研究不一定可以广泛地运用到其他病理类型的乳腺癌中,因此需要进一步的大样本前瞻性队列研究的证实。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 马海彦负责研究命题的提出和设计、数据的获取和分析、论文的撰写及最终版本的修订;谢光友、张莎莎负责病理数据的获取;郑兴菊、刘江勇负责数据的提供、协助统计结果的核对;王荣品负责研究命题的提出、论文的审阅。
乳腺专用γ显像的肿瘤/正常组织比值与乳腺浸润性导管癌病理学的对比研究
Compared study of tumor uptake target to normal tissue ratio on breast-specific gamma imaging with clinical pathology in invasive ductal breast carcinoma
-
摘要:
目的 探讨乳腺专用γ显像(BSGI)的肿瘤摄取半定量方法与乳腺浸润性导管癌(IDC)临床病理学的对比研究。 方法 回顾性分析2016年4月至2017年8月贵州省人民医院符合纳入标准的84例女性IDC患者,年龄30~76(53.2±13.1)岁。患者术前均行BSGI检查,通过乳腺影像报告和数据系统(BIRADS)对BSGI图像进行视觉评分。根据BSGI的阳性结果,将肿瘤与正常组织放射性比值(TNR)与病理学结果进行比较,阳性与阴性结果的比较采用t检验和χ2检验,多组病理亚型的比较采用方差分析;采用单因素分析、多因素分析和Pearson积差相关性分析明确TNR与组织病理学因素之间的相关性。 结果 84例IDC患者BSGI诊断为阳性75例,灵敏度为89.3%(75/84)。单因素分析结果显示,肿瘤大小(t=4.13,P<0.01)、腋窝淋巴结是否转移(χ2=5.04,P=0.005)、病理组织学分级(F=11.05,P=0.034)、孕激素受体(PR)表达(χ2=3.12,P=0.041)和细胞增殖核抗原Ki-67(简称Ki-67)指数(χ2=16.20,P=0.008)的差异对TNR的影响有统计学意义。多因素分析结果显示,乳腺癌的病理危险因素有肿瘤长径≥2 cm、腋窝淋巴结转移和PR阴性(OR=2.186、1.673、0.420,P=0.004、0.047、0.032)。Pearson相关性分析结果显示,TNR与肿瘤大小的相关性较差(r=0.353,P=0.004);与Ki-67指数呈中度正相关(r=0.452,P=0.014);与PR Allred评分呈负相关(r=−0.364,P=0.026)。 结论 BSGI的高TNR与乳腺癌病理不良因素相关,TNR可作为乳腺癌预后评估的有价值的预测指标。 -
关键词:
- 乳腺肿瘤 /
- 乳腺专用γ显像 /
- 病理学 /
- 肿瘤与正常组织放射性比值
Abstract:Objective To investigate the correlation between tumor uptake target to normal tissue ratio (TNR) obtained from breast-specific gamma imaging (BSGI) and the pathology of breast cancer. Methods A total of 84 female patients aged 30−76(53.2±13.1) years who had visited Guizhou Provincial People's Hospital with a diagnosis of invasive ductal carcinoma and who underwent preoperative BSGI were retrospectively enrolled from April 2016 to August 2017. The BSGI images of these patients were visually scored from 1 to 5 according to a breast imaging reporting and data system (BIRADS). The TNR results obtained from positive BSGI images were compared in terms of breast cancer pathology. T test and chi-square test were used for the comparison of positive and negative results, and analysis of variance was used for the comparison of pathological subtypes among multiple groups.Multiple regression analysis was performed using histologic factors; significant, independent factors were determined by P values less than 0.05 in the univariate analysis. The correlations between TNR and histopathologic factors were analyzed by Pearson’s correlation coefficient. Results Among 84 images, 75 were classified with positive findings (sensitivity 89.3%, 75/84). A higher TNR value was significantly correlated with tumor size (t=4.13, P<0.01), axillary lymph node metastasis (χ2=5.04, P=0.005), histologic grade(HG) (F=11.05, P=0.034), progestrone receptor(PR) status (χ2=3.12, P=0.041), and Ki-67 (χ2=16.20, P=0.008). Multivariate analysis revealed that the pathological risk factors of breast cancer are related to tumor size tumor size≥2 cm, axillary lymph node metastasis, and negative PR status ( OR=2.186, 1.673, 0.420; P=0.004, 0.047, 0.032). Pearson correlation analysis showed that TNR is weakly correlation with tumor size (r=0.353, P=0.004), moderately positively correlated with Ki-67 (r=0.452, P=0.014), a weak negative correlation with the Allred score of PR status (r=−0.364, P=0.026). Conclusion High TNRs in BSGI imaging may be associated with the adverse pathological factors of breast cancer.This parameter may could be a valuable prognostic indicator of breast cancer. -
表 1 肿瘤与正常组织放射性比值与乳腺癌临床病理结果的相关性分析(n=75)
Table 1. Correlations between tumor to normal tissue radiation ratio and breast cancer pathology (n=75)
参数 例数 TNR ( $\bar x \pm s $ 

单因素分析 多因素分析 t/χ2/F值 P值 OR值 P值 肿瘤大小 4.13 <0.01 2.186 0.004 ≥2 cm 35 4.9±2.3 <2 cm 40 3.2±1.3 腋窝淋巴结转移 5.04 0.005 1.673 0.047 是 19 4.7±1.6 否 56 3.5±1.7 病理亚型 23.14 0.170 − Luminal A型 28 3.3±1.2 Luminal B型 21 4.2±1.8 ERBB2+型 11 4.8±2.7 Basal-like型 15 3.6±2.0 是否为Luminal A型 6.13 0.009 − Luminal A型 31 3.2±1.1 非Luminal A型 44 4.3±1.1 ERBB2+型 2.06 0.301 − 阳性 22 4.3±2.2 阴性 53 3.8±1.3 Basal-like型 3.17 0.462 − 阳性 18 4.3±1.2 阴性 57 3.8±1.6 核分级 8.21 0.126 − 1级 27 2.5±1.1 2级 32 3.7±1.4 3级 16 4.0±1.5 组织学分级 11.05 0.034 − 1级 21 3.1±1.1 2级 25 3.9±1.7 3级 29 4.5±1.8 雌激素受体 2.15 0.072 − 阳性 47 3.6±1.4 阴性 28 4.3±2.2 孕激素受体 3.12 0.041 0.420 0.032 阳性 46 3.6±1.5 阴性 29 4.6±2.3 Ki-67指数 16.20 0.008 − 低(<14%) 40 3.4±1.2 高(≥14%) 35 4.4±1.9 注:表中,ERBB2:酪氨酸激酶受体2;Ki-67:细胞增殖核抗原Ki-67;TNR:肿瘤与正常组织放射性比值;−:单因素分析无统计学差异时,没有进一步行多因素分析 -
[1] Ding YN, Chen XG, Zhang QJ, et al. Historical trends in breast cancer among women in China from age-period-cohort modeling of the 1990−2015 breast cancer mortality data[J/OL]. BMC Public Health, 2020, 20(1): 1280[2019-06-08]. https://www.ncbi.nlm.nih.gov/pmc/journals/63. DOI: 10.1186/s12889-020-09375-0. [2] Sun Y, Wei W, Yang HW, et al. Clinical usefulness of breast-specific gamma imaging as an adjunct modality to mammography for diagnosis of breast cancer: a systemic review and meta-analysis[J]. Eur J Nucl Med Mol Imaging, 2013, 40(3): 450−463. DOI: 10.1007/s00259-012-2279-5. [3] Huppe AI, Mehta AK, Brem RF. Molecular breast imaging: A comprehensive review[J]. Semin Ultrasound CT MR, 2018, 39(1): 60−69. DOI: 10.1053/j.sult.2017.10.001. [4] Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies-improving the management of early breast cancer: St Gallen international expert consensus on the primary therapy of early breast cancer 2015[J]. Ann Oncol, 2015, 26(8): 1533−1546. DOI: 10.1093/annonc/mdv221. [5] Meissnitzer T, Meissnitzer MW, Seymer A, et al. Relative uptake factor of invasive ductal breast cancer in breast-specific gamma imaging as a surrogate parameter for sub-typing[J]. Anticancer Res, 2015, 35(10): 5671−5677. [6] Tan H, Zhang HW, Yang WG, et al. Breast-specific gamma imaging with Tc-99m-sestamibi in the diagnosis of breast cancer and its semiquantitative index correlation with tumor biologic markers, subtypes, and clinicopathologic characteristics[J]. Nucl Med Commun, 2016, 37(8): 792−799. DOI: 10.1097/MNM.0000000000000518. [7] Yoon HJ, Kim Y, Chang KT, et al. Prognostic value of semi-quantitative tumor uptake on Tc-99m sestamibi breast-specific gamma imaging in invasive ductal breast cancer[J]. Ann Nucl Med, 2015, 29(7): 553−560. DOI: 10.1007/s12149-015-0977-3. [8] Goldsmith SJ, Parsons W, Guiberteau MJ, et al. SNM practice guideline for breast scintigraphy with breast-specific gamma-cameras 1.0[J]. J Nucl Med Technol, 2010, 38(4): 219−224. DOI: 10.2967/jnmt.110.082271. [9] Lee SJ, Choi YY, Kim C, et al. Correlations between tumor to background ratio on breast-specific gamma imaging and prognostic factors in breast cancer[J]. J Korean Med Sci, 2017, 32(6): 1031−1037. DOI: 10.3346/jkms.2017.32.6.1031. [10] Hammond ME, Hayes DF, Dowsett M, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. J Clin Oncol, 2010, 28(16): 2784−2795. DOI: 10.1200/JCO.2009.25.6529. [11] Inda MA, Blok EJ, Kuppen PJK, et al. Estrogen receptor pathway activity score to predict clinical response or resistance to neoadjuvant endocrine therapy in primary breast cancer[J]. Mol Cancer Ther, 2020, 19(2): 680−689. DOI: 10.1158/1535-7163.MCT-19-0318. [12] Gradishar WJ, Anderson BO, Balassanian R, et al. NCCN guidelines insights: breast cancer, version 1.2017[J]. J Natl Compr Canc Netw, 2017, 15(4): 433−451. DOI: 10.6004/jnccn.2017.0044. [13] Narayanan D, Berg WA. Dedicated breast gamma camera imaging and breast PET: current status and future directions[J]. PET Clin, 2018, 13(3): 363−381. DOI: 10.1016/j.cpet.2018.02.008. [14] Sanli Y, Kuyumcu S, Ozkan ZG, et al. Increased FDG uptake in breast cancer is associated with prognostic factors[J]. Ann Nucl Med, 2012, 26(4): 345−350. DOI: 10.1007/s12149-012-0579-2. [15] Kim J, Yoo SW, Kang SR, et al. Prognostic significance of metabolic tumor volume measured by 18F-FDG PET/CT in operable primary breast cancer[J]. Nucl Med Mol Imaging, 2012, 46(4): 278−285. DOI: 10.1007/s13139-012-0161-9. [16] Papantoniou V, Christodoulidou J, Papadaki E, et al. Uptake and washout of 99mTcV-dimercaptosuccinic acid and 99mTc-sestamibi in the assessment of histological type and grade in breast cancer[J]. Nucl Med Commun, 2002, 23(5): 461−467. DOI: 10.1097/00006231-200205000-00006. [17] Papantoniou VJ, Souvatzoglou MA, Valotassiou VJ, et al. Relationship of cell proliferation (Ki-67) to 99mTc-(V)DMSA uptake in breast cancer[J]. Breast Cancer Res, 2004, 6(2): R56−R62. DOI: 10.1186/bcr751. [18] Kim S, Plemmons J, Hoang K, et al. Breast-Specific gamma imaging versus MRI: comparing the diagnostic performance in assessing treatment response after neoadjuvant chemotherapy in patients with breast cancer[J]. AJR Am J Roentgenol, 2019, 212(3): 696−705. DOI: 10.2214/AJR.17.18930. [19] Cwikla JB, Buscombe JR, Kolasinska AD, et al. Correlation between uptake of Tc-99m sestaMIBI and prognostic factors of breast cancer[J]. Anticancer Res, 1999, 19(3B): 2299−2304. [20] Tadwalkar RV, Rapelyea JA, Torrente J, et al. Breast-specific gamma imaging as an adjunct modality for the diagnosis of invasive breast cancer with correlation to tumour size and grade[J]. Br J Radiol, 2012, 85(1014): e212−e216. DOI: 10.1259/bjr/34392802. [21] Senkus E, Kyriakides S, Ohno S, et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2015, 26(Suppl 5): Sv8−30. DOI: 10.1093/annonc/mdv298. -





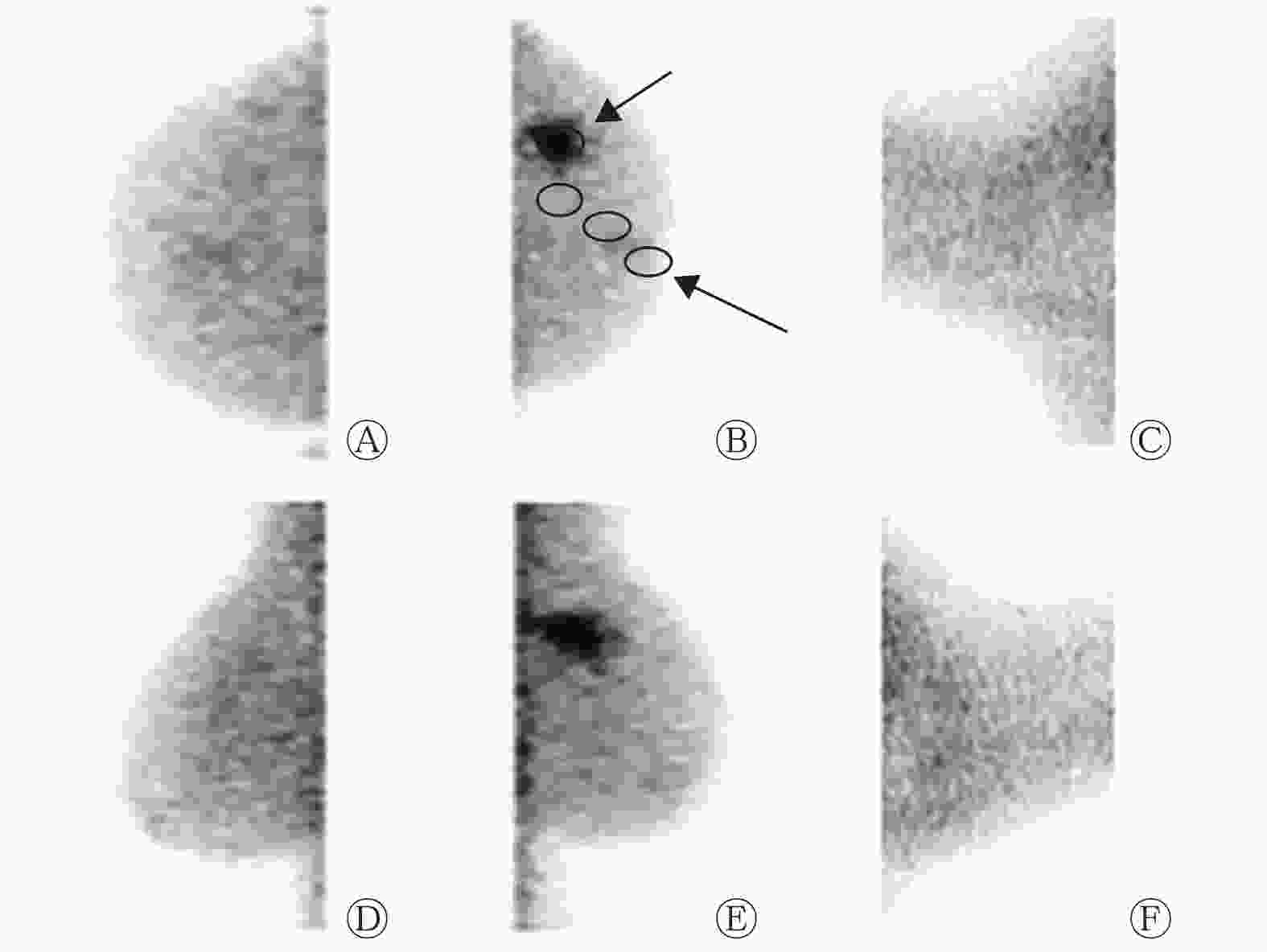
 下载:
下载: