-
DTC一般恶性程度低、预后好,但临床中此类患者发生骨转移的现象却并不少见,而不摄碘患者预后更差,是致死的主要原因。研究结果表明,转移灶摄碘但影像学检查持续异常患者的10年生存率为29%,而不摄碘患者的10年生存率仅为10%[1]。甲状腺乳头状癌(papillary thyroid carcinoma,PTC)骨转移患者有着较其他恶性肿瘤骨转移相对长的带瘤存活时间,因此,其早期诊治非常重要,有助于延缓并发症的发生、改善患者的生活质量及预后。对此类患者需考虑其一般状态、合并疾病和既往对治疗的反应,选择针对性的个体化治疗方案。每一例患者的病情、诉求均不同,临床诊治时需有一定的灵活性。笔者回顾性分析了一例以肱骨转移为先发症状的隐匿性PTC患者的治疗过程,依据不断更新的临床资料追根溯源,不断修正其临床诊断及治疗方案,最终患者得到了有效的治疗。现将具体情况报道如下。
-
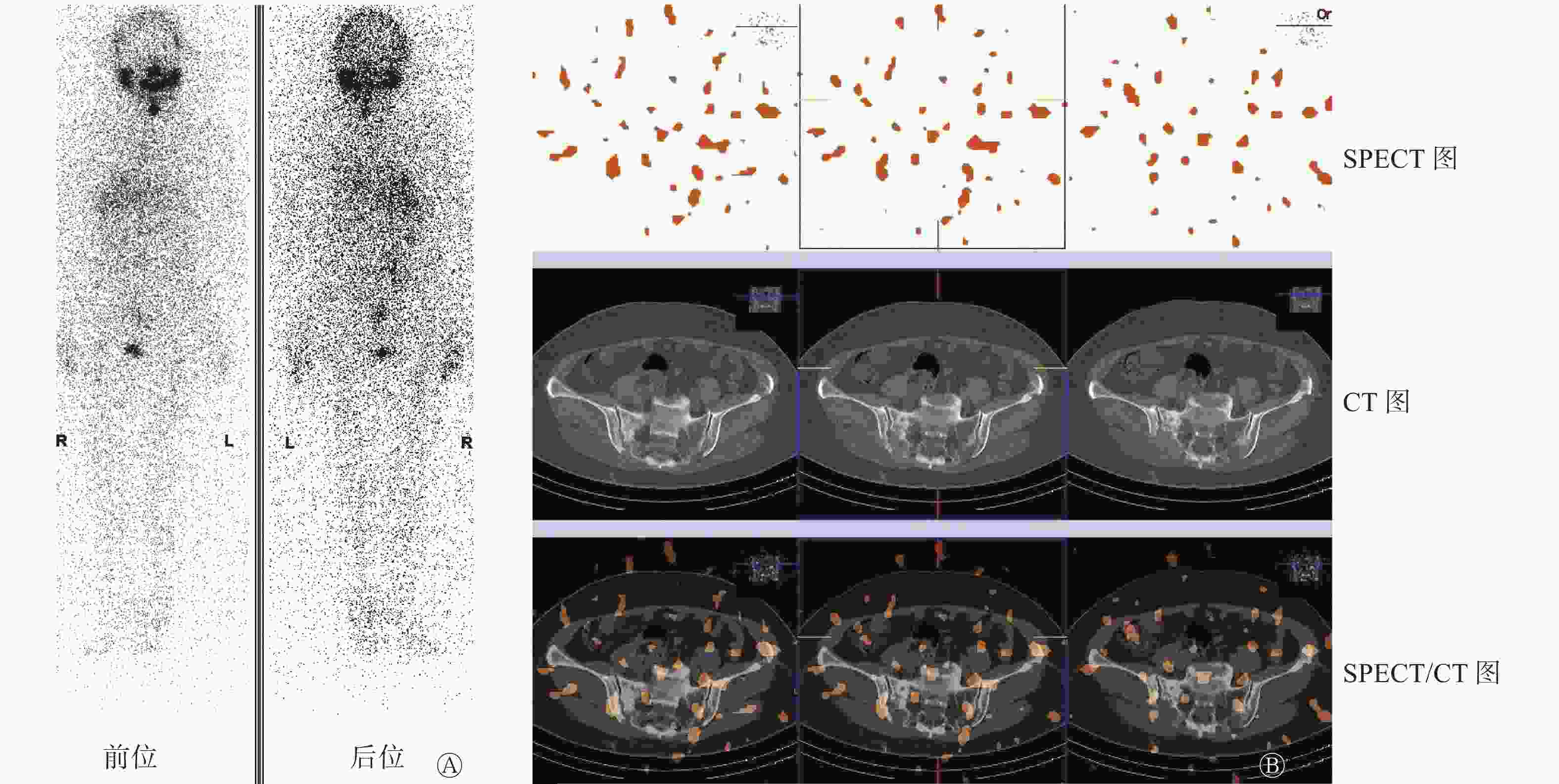
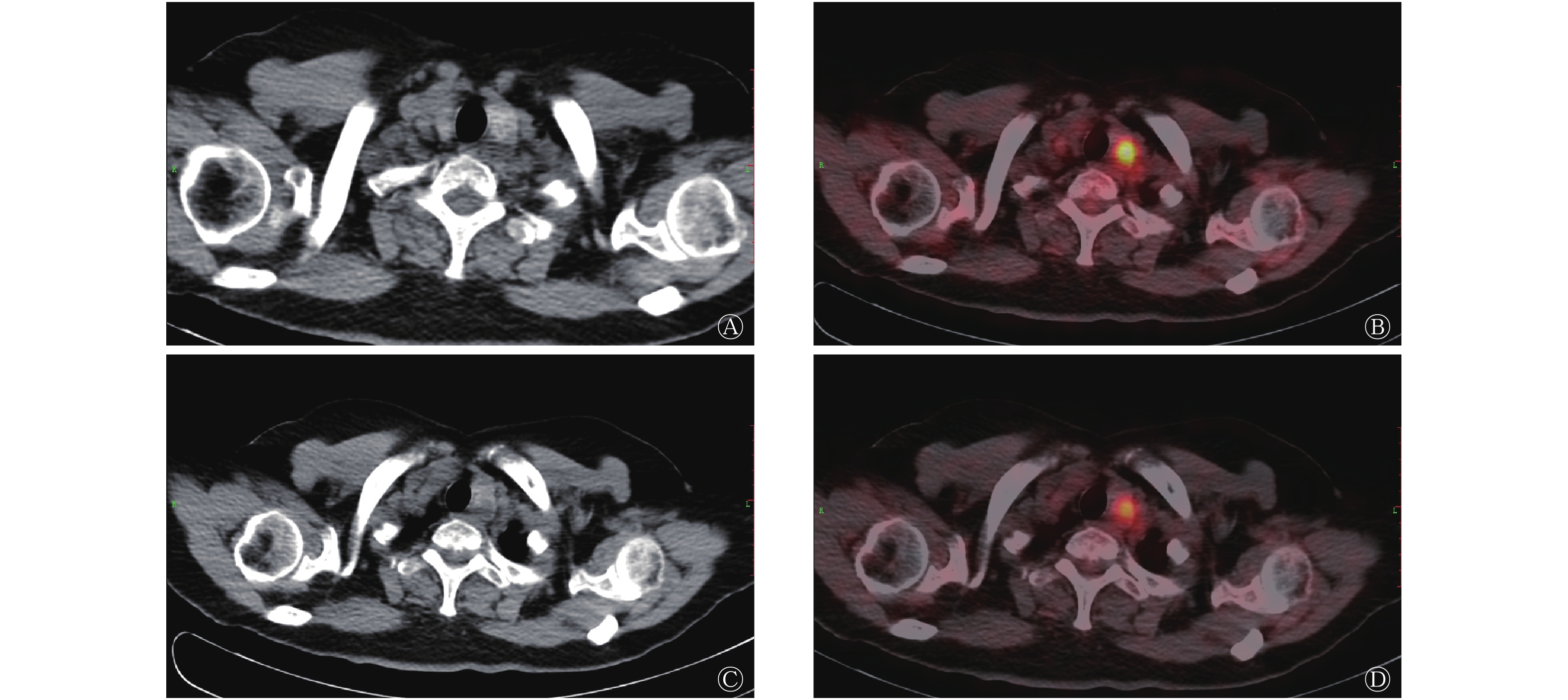
患者女性,66岁,因“左侧上臂包块”于外院行“左侧肱骨病灶刮除+取髂骨植骨+钢板螺钉内固定术”治疗,术后病理结果显示:骨转移性乳头状癌,倾向来源于甲状腺。患者出院后于我院行18F-FDG PTE/CT检查,结果显示:甲状腺左侧叶有2个结节,代谢活跃,考虑为甲状腺癌;右叶可见小囊状低密度影伴钙化灶,代谢未见增高,倾向良性病变(图1);右侧髂骨骨质破坏,代谢异常活跃,考虑转移,左侧肱骨下端及左侧髂骨术后改变,术区代谢增高(图2)。遂行“甲状腺全切+颈部淋巴结清扫”手术治疗,术后病理结果和苏木精-伊红染色及免疫组化结果均提示“甲状腺右叶及左叶组织”为结节性甲状腺肿伴腺瘤样结节形成,部分细胞增生活跃,颈部多区取材淋巴结未见异常。借外院左侧肱骨病灶组织蜡块病理会诊结果:切片内可见较多甲状腺组织,上皮细胞具有异型性,部分显示为PTC,可见少量骨组织。
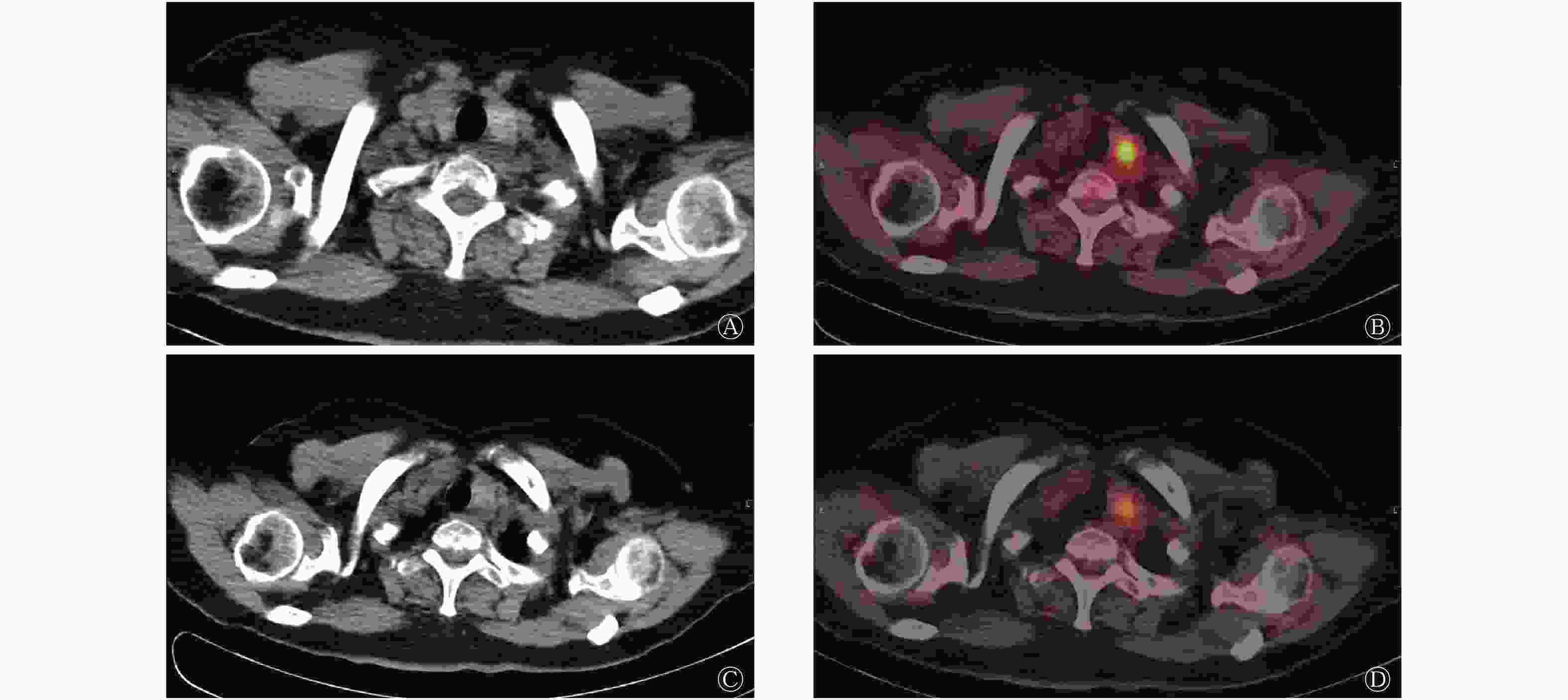
图 1 甲状腺乳头状癌患者(女性,66岁)的甲状腺18F-FDG PET/CT图
Figure 1. 18F-FDG PET / CT of thyroid in patients with papillary thyroid carcinoma(female,66 years old)
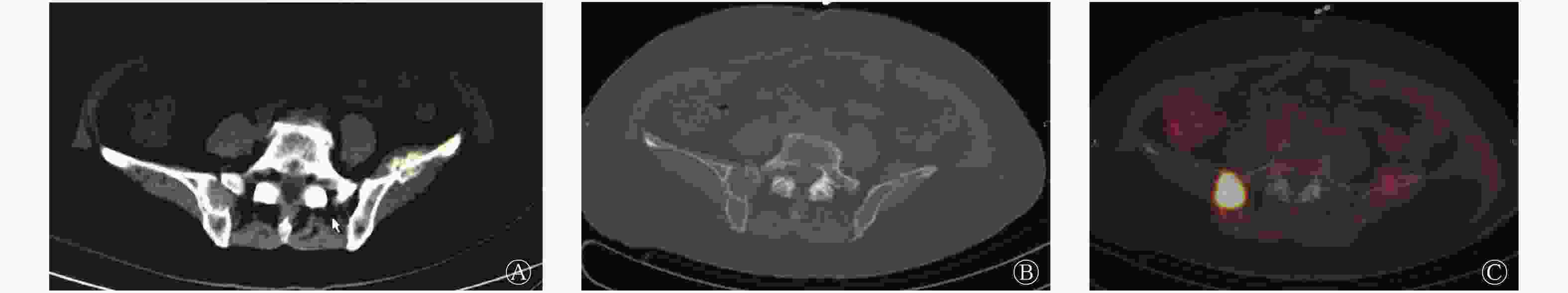
图 2 甲状腺乳头状癌患者(女性,66岁)的骨盆18F-FDG PET/CT图
Figure 2. 18F-FDG PET / CT of pelvis in patients with papillary thyroid carcinoma(female,66 years old)
出院后患者停服左甲状腺素钠片3周后到我院行131I治疗(因术后甲状腺残留,口服剂量2.22×109 Bq),入院检查:甲状腺球蛋白(thyroglobulin,Tg)>500.00 ng/mL,甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)为19.95 IU/mL,TSH为74.39 mIU/L。自诉右侧臀部骶髂关节区轻度隐痛不适5年余,无明显加重,曾自认为骨退行性相关症状,未予重视,查体右侧骶髂关节区轻度叩击痛,活动无不适。患者治疗期间出现右侧髋部疼痛且逐渐加重。口服131I治疗5 d后行全身显像(posttreatment whole body scan,Rx-WBS),颈部及骨盆右侧区可见131I显像剂异常聚集(图3)。综合患者临床资料分析,患者有确切的甲状腺癌远处转移病灶,但甲状腺根治术后病理却未见甲状腺癌原发病灶,结合18F-FDG PTE/CT检查所见右侧髂骨规则类圆形异常高代谢病灶,及Rx-WBS见骨盆右侧区131I显像剂明显异常聚集,考虑“右侧髂骨异位甲状腺恶变合并左侧肱骨转移”或“隐匿型PTC合并骨(左侧肱骨及右侧髂骨)转移”的可能诊断。与患者沟通后于骨科行“右侧骶髂关节病灶切除+同种异体骨植骨重建+筋膜组织瓣形成术”手术,术后病理结果显示:右侧骶髂关节病灶组织骨组织内见PTC累及。
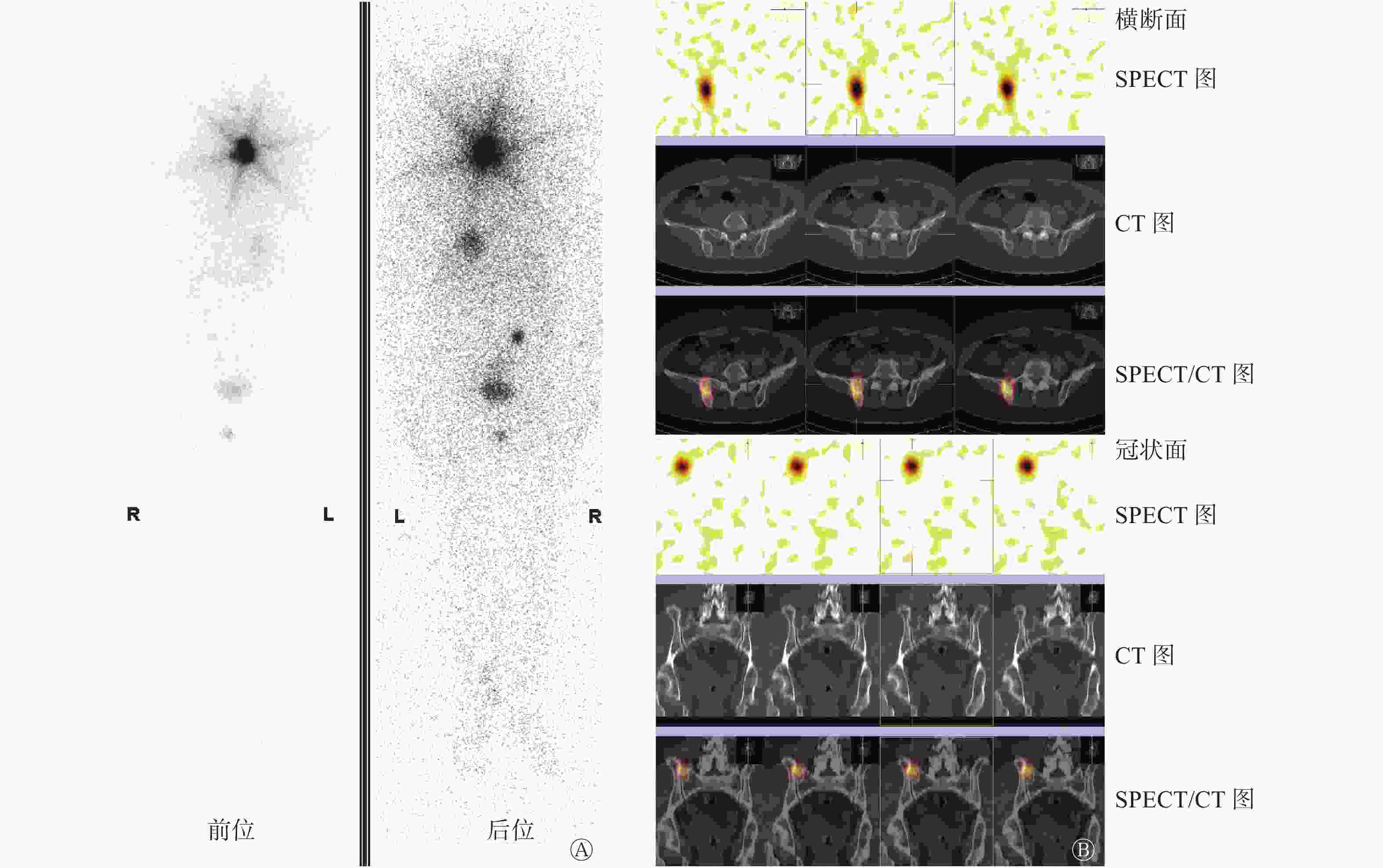
图 3 甲状腺乳头状癌患者(女性,66岁)第1次口服131I治疗5 d后行全身碘扫描及骨盆SPECT/CT融合显像图
Figure 3. Posttreatment whole body scan and SPECT/CT of pelvis 5 days after the first oral administration of 131I in patients with papillary thyroid carcinoma(female,66 years old)
患者出院再次停服左甲状腺素钠片3周后于我科再次行131I治疗(口服剂量7.4×109 Bq),患者入院主诉既往右侧髋部疼痛较之前明显缓解,辅助检查:Tg为112.70 ng/mL、TgAb为19.24 IU/mL、TSH为83.02 mIU/L,其余检查未发现明显异常。口服131I 5 d后,Rx-WBS结果显示原骨盆右侧区未见显像剂摄取(图4)。这说明患者右侧骶髂关节的病灶已完全切除。治疗期间患者未再出现右侧髋部疼痛症状。结合患者上述临床资料及咨询病理科意见,最终确诊为隐匿型PTC合并骨(左侧肱骨及右侧髂骨)转移TxN0M1 IVc期。出院后严格行TSH抑制治疗,6个月后复查:TSH为0.26 mIU/L、Tg<0.04 ng/mL、TgAb为16.33 IU/mL,该结果提示治疗效果较好,患者无其他不适症状,恢复良好。
-
PTC进展缓慢,但部分PTC仍具有侵袭性和转移的潜力。据报道,PTC患者发生远处转移的概率<5%[2]。远处转移主要至肺和骨,而PTC骨转移好发部位依次为脊柱、肋骨和骨盆等[3]。本例患者较特殊,患者以左侧肱骨包块为先发症状,综合术后病理学及PET/CT结果为下一步治疗指明了方向,更特殊之处在于甲状腺全切及颈部淋巴结清扫均未发现确切的原发病灶。再次回顾PET/CT检查右侧髂骨的高代谢病灶,并结合Rx-WBS检查对应部位的病灶摄碘情况,曾考虑为“右侧髂骨异位甲状腺合并PTC恶变、左侧肱骨转移TxN0M1 IVc期”或“隐匿型PTC合并骨(左侧肱骨及右测髂骨)转移”的可能诊断,于是建议患者行右侧骶髂关节区病灶切除,术后病理结果证明了正确的治疗方案及最终的诊断即“隐匿型PTC合并骨(左侧肱骨及右侧髂骨)转移TxN0M1 IVc期”。再次行131I治疗后,患者症状明显缓解,定期监测甲状腺功能、Tg、TgAb等血液学及相关影像学检查指标,均提示治疗效果良好。该患者仍需要长期的血液学及影像学随访,监测病情,并做出个体化的治疗方案。
以肱骨转移包块为先发症状的PTC在临床中并不少见,但隐匿型甲状腺癌合并PTC恶变或右侧髂骨近骶髂关节区异位甲状腺合并PTC恶变均较少见。有文献报道,以骨转移为首发症状者占所有甲状腺癌骨转移患者的28%,而转移一般先累及中轴骨(颅骨、脊柱、肋骨和骨盆),其次为肱骨、股骨,极少累及远端肢体骨[4]。绝大部分以骨转移为首发症状的患者初次就诊时很难考虑到肿瘤来源于甲状腺,容易误诊,尤其是隐匿型甲状腺癌患者,多数为术后病理学检查结果发现。本例患者也属于此类情况,但该病例经甲状腺全切除、颈部淋巴结清扫、病理科全取材,并经多次复查,最终仍未找见原发病灶。
本病例在右侧髂骨病灶切除前曾考虑的另一种可疑诊断:“右侧髂骨异位甲状腺合并PTC恶变、左侧肱骨转移TxN0M1 IVc期”,其依据为:①患者有多年的右侧臀部骶髂关节区隐痛病史,无明显加重,均未予重视,直到PET/CT检查发现异常。②PET/CT检查可见右侧髂骨病灶代谢明显均匀性增高,病灶的影像学特征并不十分支持骨转移瘤表现。③远处骨病灶有较高的131I摄取率,仅口服2.22×109 Bq131I的第1次131I扫描(且在甲状腺区明显的放射性碘摄取的情况下)即可见明显的右侧髂骨病灶的131I摄取。④甲状腺全切除、颈部淋巴结清扫术后,多次与病理科医师沟通,标本全取材及多次复查,均未找到确切的甲状腺癌原发病灶。但右侧髂骨病灶切除术后的病理学结果并不支持“异位甲状腺”的存在,并且髂骨上的异位甲状腺合并恶变,并未见文献报道,排除了此诊断。该病例的诊断经过了一个“立足证据,大胆假设,小心求证”的过程。See等[5]报道过19例类似罕见病例,术后病理证实为DTC骨转移,甲状腺原发病灶却表现为无明显侵袭性,且未发现颈区淋巴结转移。有研究者甚至发现甲状腺内没有可识别的原发癌灶的转移性甲状腺癌,这可能与肿瘤的退分化有关[6]。
有文献报道,以远处转移为首发症状诊断为DTC的患者的预后要优于甲状腺癌术后诊断为远处转移的DTC患者[7]。在治疗方面,DTC患者发生骨转移后,若病灶单一,手术治疗是最佳选择,术后行131I、放化疗等个体化治疗;但若病灶为多发,或者无法切除,仍需联合多学科诊疗模式,行全面评估病情、细化治疗指征和制定个体化诊疗的策略。转移病灶碘亲合力对初始治疗后远处转移患者的总生存率和疾病特异生存率均有显著影响,但仅显著影响初发远处转移患者的疾病特异生存率[8]。本研究中患者以左侧肱骨包块为首发症状,转移灶良好的摄碘特征,甚至术后未找见确切的甲状腺及颈部淋巴结原发转移病灶等疾病特征,均可能与患者有着良好的治疗效果有关。2015版美国甲状腺协会的《甲状腺结节与分化型甲状腺癌诊治指南》[9]指出,骨转移病灶患者接受放射性碘治疗的同时,可考虑对解剖影像上肉眼可见的病灶进行直接治疗,包括手术切除、外照射治疗(立体定向放疗)以及其他局部治疗,例如热消融(射频消融或冷冻消融)和(或)骨水泥成形术;这些患者也可以考虑联合全身治疗即全身性的骨靶向和(或)导向药物治疗(包括二磷酸盐和狄诺塞麦等)或者化疗,能够通过减轻疼痛、推迟骨骼事件发生、延迟首次全身治疗甚至提高患者生存率来提高患者的生活质量[10]。董曦文等[11]发现,131I联合唑来膦酸相比于单独131I治疗甲状腺癌骨转移能更有效地控制患者的骨性疼痛,进一步提高患者的生活质量,且不良反应更少。最近,孙健雯等[12]报道了骨水泥联合131I治疗此类DTC骨转移能有效降低患者血清中的Tg和缓解DTC骨转移引起的骨痛,改善患者的生活质量。联合多学科诊疗模式个体化治疗后,应以患者骨痛缓解程度、Tg下降程度(排除TgAb干扰)以及影像学检查骨转移病灶变化情况进行疗效评价。而对于放射性碘治疗很难治愈的骨转移患者,骨转移摄取碘的部分病灶仍可从中受益[13-14]。但是,对于放射性碘摄取差或者不摄取的碘难治性甲状腺癌骨多发转移灶,通常预后较差,一些文献中提及了采用手术切除、外照射、唑来膦酸、放射性核素89Sr或153Sm-EDTMPD、骨水泥、热消融(射频消融或冷冻消融)、诱导分化治疗、化疗及抑制肿瘤生长和(或)抗血管生成的靶向药物等局部及全身治疗等方案[9, 15-16],期望能进一步提高患者的生活质量。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 高峰负责文章的撰写;谢莉、王明华负责文章的审阅与修改。
以肱骨转移为先发症状的隐匿型甲状腺乳头状癌临床分析一例
Clinical analysis of a case of concealed papillary thyroid carcinoma having humeral metastasis as the first symptom
-
摘要: 以肱骨转移包块为先发症状的甲状腺乳头状癌转移病例在临床中并非罕见,笔者报道的这例病例特殊之处在于行甲状腺全切除及颈部淋巴结清扫手术后,术后病理结果未发现确切的原发病灶,再次行PET/CT检查及131I治疗后的全身碘扫描中发现了左侧髂骨病灶,行髂骨病灶手术切除术后,病理结果证实为另一处甲状腺乳头状癌骨转移灶,再次行131I治疗、规范TSH抑制治疗,诊治过程中不断更新诊断标准,制定出针对性的治疗方案,最终患者得到了有效的治疗。Abstract: A special feature of the case reported in this paper is that no definite primary lesion was found by pathology after total thyroidectomy and neck lymph-node dissection. PET/CT examination and whole-body 131I scan after radioiodine therapy revealed a left iliac bone lesion, which was resected accordingly. In addition to the pathological confirmation of another bone metastasis of papillary thyroid carcinoma, 131I therapy and regular thyroid-stimulating hormone-suppression therapy were performed again. Regarding the diagnosis and treatment process, the diagnosis was constantly updated and the targeted treatment plan was prepared. Finally, effectively treatment on the patients was achieved.
-
Key words:
-
-
[1] Durante C, Haddy N, Baudin E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy[J]. J Clin Endocrinol Metab, 2006, 91(8): 2892−2899. DOI: 10.1210/jc.2005-2838. [2] Schmid KW. Lymph node and distant metastases of thyroid gland cancer. Metastases in the thyroid glands[J]. Pathologe, 2015, 36(Suppl 2): S171−S175. DOI: 10.1007/s00292-015-0071-6. [3] 熊延新, 张晓. 131I治疗分化型甲状腺癌骨转移疗效观察[J]. 吉林医学, 2008, 29(11): 904−906. DOI: 10.3969/j.issn.1004-0412.2008.11.014.
Xiong YX, Zhang X. Observation on the effects of radioactive iodine treatment in bone metastsis from differentiated thyroid cancer[J]. Jilin Med J, 2008, 29(11): 904−906. DOI: 10.3969/j.issn.1004-0412.2008.11.014.[4] Pittas AG, Adler M, Fazzari M, et al. Bone metastases from thyroid carcinoma: clinical characteristics and prognostic variables in one hundred forty-six patients[J]. Thyroid, 2000, 10(3): 261−268. DOI: 10.1089/thy.2000.10.261. [5] See A, Iyer NG, Tan NC, et al. Distant metastasis as the sole initial manifestation of well-differentiated thyroid carcinoma[J]. Eur Arch Otorhinolaryngol, 2017, 274(7): 2877−2882. DOI: 10.1007/s00405-017-4532-9. [6] Xu B, Scognamiglio T, Cohen PR, et al. Metastatic thyroid carcinoma without identifiable primary tumor within the thyroid gland: a retrospective study of a rare phenomenon[J]. Hum Pathol, 2017, 65: 133−139. DOI: 10.1016/j.humpath.2017.05.013. [7] 许艳红, 宋红俊, 邱忠领, 等. 以骨转移为首发症状的分化型甲状腺癌的临床特征与生存分析[J]. 肿瘤, 2011, 31(6): 538−541. DOI: 10.3781/j.issn.1000-7431.2011.06.012.
Xu YH, Song HJ, Qiu ZL, et al. Differentiated thyroid carcinoma patients with bone metastasis as the initial presentation: clinical characteristics and survival analysis[J]. Tumor, 2011, 31(6): 538−541. DOI: 10.3781/j.issn.1000-7431.2011.06.012.[8] Lee J, Soh EY. Differentiated thyroid carcinoma presenting with distant metastasis at initial diagnosis clinical outcomes and prognostic factors[J]. Ann Surg, 2010, 251(1): 114−119. DOI: 10.1097/SLA.0b013e3181b7faf6. [9] Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J]. Thyroid, 2016, 26(1): 1−133. DOI: 10.1089/thy.2015.0020. [10] Quan GMY, Pointillart V, Palussière J, et al. Multidisciplinary treatment and survival of patients with vertebral metastases from thyroid carcinoma[J]. Thyroid, 2012, 22(2): 125−130. DOI: 10.1089/thy.2010.0248. [11] 董曦文, 赵戈, 王廷. 131I联合唑来膦酸治疗甲状腺癌骨转移临床研究[J/OL]. 中国医学前沿杂志(电子版), 2015, 7(4): 102−105[2019-05-21]. http://d.wanfangdata.com.cn/periodical/zgyxqyzz201504034. DOI: 10.3969/j.issn.1674-7372.2015.04.034.
Dong XW, Zhao G, Wang T. Clinical research on 131I combined zoledronic acid in treating thyroid cancer bone metastasis[J/OL]. Chinese Journal of the Frontiers of Medical Science (Electronic Version), 2015, 7(4): 102−105[2019-05-21]. http://d.wanfangdata.com.cn/periodical/zgyxqyzz201504034. DOI: 10.3969/j.issn.1674-7372.2015.04.034.[12] 孙健雯, 宋红俊, 席闯, 等. 经皮骨水泥成形术联合131I治疗分化型甲状腺癌骨转移的疗效评价与生存分析[J]. 中华核医学与分子影像杂志, 2020, 40(6): 339−342. DOI: 10.3760/cma.j.cn321828-20200302-00082.
Sun JW, Song HJ, Xi C, et al. Efficacy evaluation of percutaneous osteoplasty combined with 131I therapy and survival analysis in patients with bone metastasis from differentiated thyroid carcinoma[J]. Chin J Nucl Med Mol Imaging, 2020, 40(6): 339−342. DOI: 10.3760/cma.j.cn321828-20200302-00082.[13] Bernier MO, Leenhardt L, Hoang C, et al. Survival and therapeutic modalities in patients with bone metastases of differentiated thyroid carcinomas[J]. J Clin Endocrinol Metab, 2001, 86(4): 1568−1573. DOI: 10.1210/jcem.86.4.7390. [14] Schlumberger M, Challeton C, De Vathaire F, et al. Radioactive iodine treatment and external radiotherapy for lung and bone metastases from thyroid carcinoma[J]. J Nucl Med, 1996, 37(4): 598−605. DOI: 10.1097/00004424-199604000-00009. [15] Muresan MM, Olivier P, Leclère J, et al. Bone metastases from differentiated thyroid carcinoma[J]. Endocr Relat Cancer, 2018, 15(1): 37−49. DOI: 10.1677/ERC-07-0229. [16] 中国临床肿瘤学会(CSCO)甲状腺癌专家委员会, 中国研究型医院学会甲状腺疾病专业委员会, 中国医师协会外科医师分会甲状腺外科医师委员会, 等. 碘难治性分化型甲状腺癌的诊治管理共识(2019年版)[J]. 中国癌症杂志, 2019, 29(6): 476−480. DOI: 10.19401/j.cnki.1007-3639.2019.06.013.
Thyroid cancer expert committee of Chinese society of Clinical Oncology (CSCO), Thyroid Disease Committee of China Research Hospital Association, Thyroid surgeons Committee of surgeons branch of Chinese Medical Doctor Association, et al. Consensus on diagnosis and management of iodine refractory differentiated thyroid cancer (2019 Edition)[J]. Chin Oncol, 2019, 29(6): 476−480. DOI: 10.19401/j.cnki.1007-3639.2019.06.013. -





 下载:
下载: