-
阿尔茨海默病(Alzheimer disease,AD)病因不清,但可以明确是多因素、多条病理途径参与下的复杂神经退行性脑疾病。其中,大脑神经元细胞外β淀粉样蛋白(amyloid-β protein,Aβ)聚集形成的老年斑和神经元突触内Tau蛋白过磷酸化引起的神经原纤维缠结(neurofibrillary tangles,NFTs)是AD最为突出的病理学特征,因此成为AD分子影像诊断的生物学标志物和治疗干预的有效靶点[1]。近年来,随着以Aβ为靶点的多种药物不断应用于临床试验,以及多因素分析结果显示Aβ沉积与认知障碍无明显相关性,越来越多的研究者将目光投向了Tau蛋白[2]。有证据表明,磷酸化的Tau蛋白与神经元变性、死亡和记忆障碍密切相关,因此,以Tau蛋白为靶点的PET特异性分子探针极有可能成为有效探测AD患者认知功能下降和疾病进展的标志物,从而在AD的早期诊断、疗效监测和发病机制研究中发挥独特优势[3]。7-(6-[18F]氟-吡啶-3-基)-5H-吡啶并[4,3-b]吲哚(18F-AV1451,18F-T807或18F-Flortaucipir)是目前研究最多、临床应用最广的Tau蛋白分子探针[4]。我们以18F-AV1451为代表,对Tau蛋白PET脑显像在AD临床研究中的进展进行综述。
-
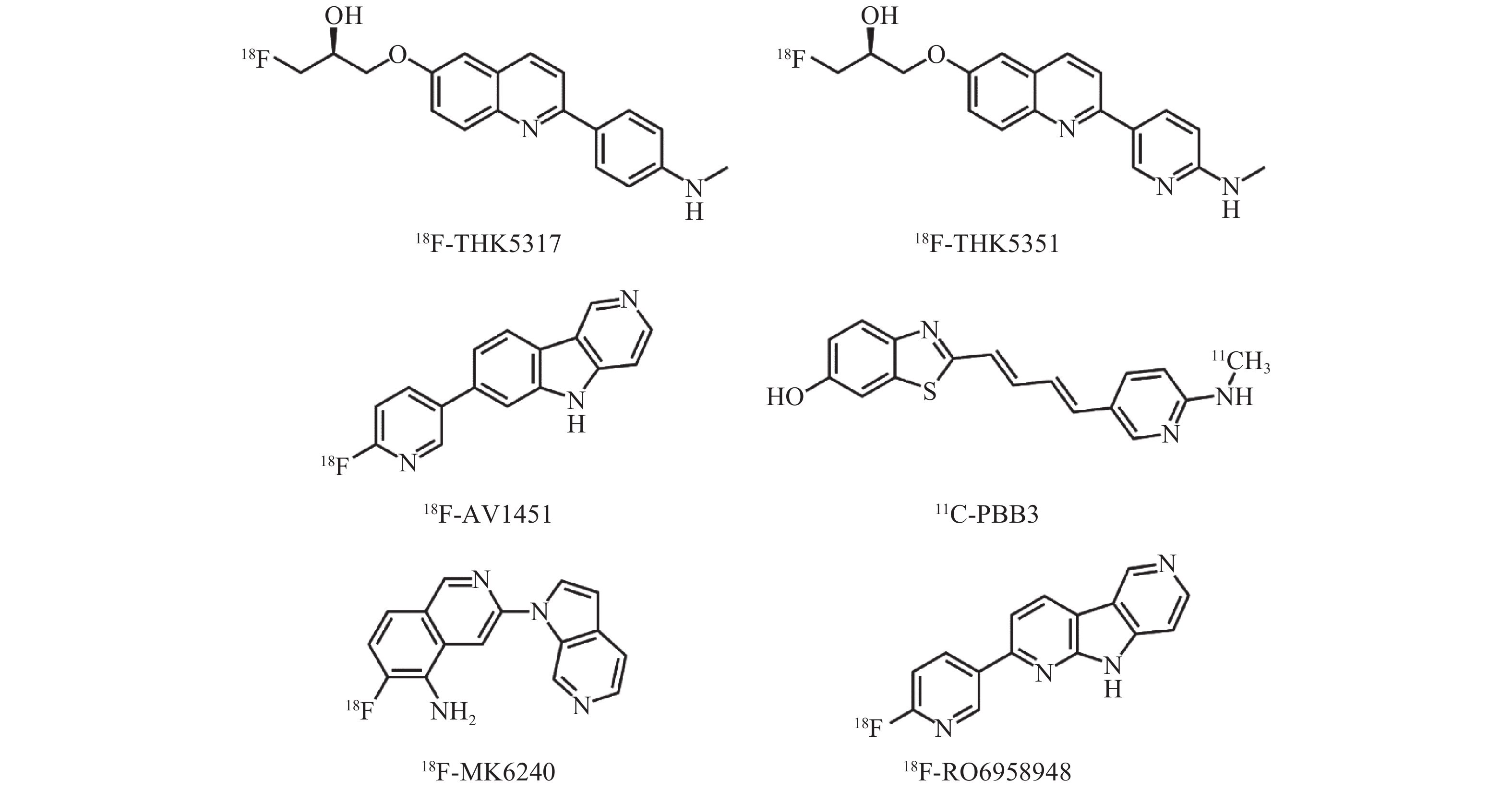
迄今为止,已有5种类型的Tau蛋白分子探针被相继研发并成功应用于临床(表1、图1)。18F-AV1451是第一代Tau蛋白分子探针。临床前研究数据显示,18F-AV1451对Tau蛋白有很高的亲和力、选择性和特异性,同时具有合适的体内药代动力学特性[5]。人体PET显像结果表明,18F-AV1451在人脑中具有较好的动力学特征,穿透性佳且能被快速洗脱[6]。临床试验结果证实,通过18F-AV1451检测脑内Tau蛋白沉积能有效地区分认知功能受损的患者与认知正常的受试者,并能追踪病情发展[7-8]。与其他Tau蛋白相关神经退行性病变,如进行性核上性麻痹和皮质基底节变性相比,该探针对AD引起的NFTs更具特异性[9-11]。
Tau蛋白分子探针类型 代表探针 特点 喹啉类衍生物 (S)-6-[(3-[18F]氟-2-羟基)丙氧基]-2-(4-甲氨基苯基)喹啉,即18F-THK5317; (S)-6-[(3-[18F]氟-2-羟基)丙氧基]-2-(2-甲氨吡啶-5-基)喹啉,即18F-THK5351 与AD型、非AD型痴呆患者脑内病理性Tau蛋白亲和力均较强,存在“脱靶”非特异性摄取 苯并咪唑嘧啶类衍生物 7-(6-[18F]氟-吡啶-3-基)-5H-吡啶并[4,3-b]吲哚,即18F-AV1451 与AD型痴呆患者脑内病理性Tau蛋白亲和力强,存在“脱靶”非特异性摄取,临床应用较多 苯并噻唑类衍生物 {4-[3-(6-[11C]甲氨基)-吡啶基]-顺丁二烯基}-6-羟基-苯并噻唑,即11C-PBB3 与AD型、非AD型痴呆患者脑内病理性Tau蛋白亲和力均较强,但半衰期短,生物稳定性不佳,存在“脱靶”非特异性摄取 氮杂吲哚类衍生物 6-[18F]氟-3-(1H-吡咯并[2,3-c]吡啶-1-基)-异喹啉-5-胺,即18F-MK6240 与病理性Tau蛋白亲和力较高,不存在“脱靶”现象,临床应用较少 罗氏系列-二吡啶并吡咯类衍生物 2-(6-[18F]氟-吡啶-3-基)-9H-二吡啶并[2,3-b; 3′,4′-d]吡咯,即18F-RO6958948 与病理性Tau蛋白亲和力高,不存在“脱靶”现象,刚刚进入临床阶段 注:表中,AD:阿尔茨海默病 表 1 各类型Tau蛋白分子探针及其特点
Table 1. Characteristics of Tau protein PET molecular probes
-
众所周知,脑内AD特异性病理改变先于认知损害出现,即在出现临床症状之前存在至少长达20年的AD临床前期。在此期间,给予有效的干预会延缓甚至阻止痴呆症状的发生,因此需要一个可以监测疾病进展的可靠临床指标。1991年,两位Braak[12]首次在83例脑组织活检样本中明确了AD病程中NFTs在大脑区域中遵循一组有规律的路径传播,据此可将疾病分为6个不同的阶段(Ⅰ~Ⅵ期)。Ⅰ~Ⅱ期:NFTs分布于经内嗅区和内嗅区皮质,此时患者处于无症状期;Ⅲ~Ⅳ期:经嗅区和内嗅区皮质严重受累,病变累及海马区,此时患者有轻度认知障碍(mild cognitive impairment,MCI);Ⅴ~Ⅵ期:NFTs明显累及颞叶及其他新皮质,患者则相继出现不同程度的记忆障碍,即痴呆期。此后,Tau蛋白PET示踪剂的研发使得NFTs分布可视化,相应PET显像研究进展迅速。2013年,Chien等[6]首先对3例正常对照者、1例MCI患者和2例不同程度AD患者进行了18F-AV1451 PET扫描,结果证实,该示踪剂在脑内的滞留模式与两位Braak[12]的病理发现基本相符:正常对照者的简易智力状态检查(mini-mental state examination,MMSE)=30分,示踪剂在标准化摄取值比值(standardized uptake value ratio,SUVR)=1.16的颞叶内侧、海马区(SUVR=1.17)和颞叶外侧(SUVR=1.14)等主要脑区无沉积;MCI患者的MMSE=26分,18F-AV1451在颞叶内侧(SUVR=1.26)、海马区(SUVR=1.23)、颞叶外侧(SUVR=1.38)及顶叶(SUVR=1.21)等脑区轻度滞留,符合Braak病理分期中的Ⅲ~Ⅳ期;轻度AD患者的MMSE=21分,18F-AV1451在颞叶内侧(SUVR=1.60)、海马区(SUVR=1.60)及颞叶外侧(SUVR=1.74)沉积较多,在额叶(SUVR=1.30)和顶叶(SUVR=1.34)有少量沉积,而在枕叶(SUVR=1.01)无显著沉积;重度AD患者的MMSE=7分,18F-AV1451分布于外颞叶(SUVR=1.80)、顶叶(SUVR=1.80)和额叶(SUVR=1.46),枕叶(SUVR=1.13)也有轻度的显像剂摄取,符合Braak病理分期中的Ⅴ~Ⅵ期,但内颞叶(SUVR=1.47)和海马区(SUVR=1.44)的显像剂摄取下降。当时研究者认为,这可能是由于新皮质的广泛受累阻碍了内侧颞叶和海马区对18F-AV1451的摄取,但目前分析该病例很可能是一例非典型AD患者。
2016年,Schwarz等[13]通过18F-AV1451 PET显像在一项173例多样本人体试验中证实了Braak分期法,受试者包括42例认知正常者(MMSE≥29分)、87例临床诊断MCI患者(MMSE≥24分)和44例AD患者(MMSE≥10分)。其中,有149例(86%)受试者18F-AV1451的沉积模式与Braak分期相对应,即随着病情加重,示踪剂沉积从无到有,路径为从内嗅区皮层至整个内侧颞叶,随后逐渐向外侧颞叶、大脑后侧延伸至视觉皮质和整个新皮层。但是该研究结果也显示,有16例AD患者Braak分期较低,这提示18F-AV1451 PET的灵敏度较低。然而,同年Lowe等[9]的一项放射自显影联合免疫组化技术研究结果显示,18F-AV1451更倾向于与细胞内成熟的NFTs结合,而在MCI或早期AD的细胞内更多的是非成熟NFTs或细胞外游离NFTs,因此可能会造成与18F-AV1451的结合力降低。而非典型AD,即使在Braak Ⅵ期,海马体中也只有很少的18F-AV1451滞留,但在枕颞叶和颞下回皮层中表现出强烈的18F-AV1451滞留,与免疫阳性的成熟NFTs定位一致。由此可见,18F-AV1451在AD中结合的变化确实是由Tau蛋白沉积的部位和形式的变化所致,但18F-AV1451 PET并不能完全反映Braak病理分期中早期Tau蛋白的进展。
另有研究结果表明,Tau蛋白也可广泛沉积在认知正常者的大脑中。来自梅奥医学中心的一项迄今为止样本最大的、对601例认知正常者进行的18F-AV1451 PET研究发现,Tau蛋白广泛沉积在无认知障碍的正常老年人的新皮层区域,包括眶额上回、眶额中回、颞下回、内嗅区皮层、海马旁回、颞上回、岛叶、顶下小叶、角回、枕下回和楔前叶等,尤其是杏仁核区(40%)[14]。研究者对与Braak分期相关的10个区域进行了分析,结果发现,Tau蛋白沉积率由高至低的部位依次为杏仁核(Braak Ⅲ期)、内侧颞极(Braak Ⅲ~Ⅳ期)、颞下回(Braak Ⅳ期)、海马(Braak Ⅲ期)、内嗅皮层(Braak Ⅰ~Ⅱ期)、内侧颞叶(Braak Ⅳ期)、眶额上回(Braak Ⅴ期)、直回(Braak分期未确定)、枕下回(Braak Ⅴ期)和梭回(Braak Ⅲ~Ⅳ期)。在认知正常组中,Tau蛋白可以局灶性或弥漫性沉积,同时与年轻认知正常者(30~49岁)相比,老年认知正常者(≥50岁)在颞叶内外侧结构及基底节区Tau蛋白的沉积更多,但认知正常者大脑Tau蛋白沉积率明显低于遗忘性MCI患者和AD患者,特别是在颞叶、顶叶、后扣带和额叶[15]。然而,另有研究结果显示,颞叶内侧,特别是内嗅区皮层18F-AV1451的沉积与认知正常者的情景记忆损伤和主观认知下降存在相关性[16-17]。因此,认知正常者的颞叶内侧中早期Tau蛋白的沉积也许并非是一个良性事件,有可能预示着向AD的发展,这还需要大样本的纵向深入研究。
-
越来越多的研究结果显示,虽然AD患者脑中同时存在Aβ蛋白和Tau蛋白,但是与认知功能障碍关系更加密切的是Tau蛋白的沉积,两种病理性蛋白的分布与认知及神经变性的关系十分复杂[18]。在疾病早期,Aβ的沉积速率和Tau蛋白的传播存在一个相互作用机制。Roberson等[19]将Tau基因敲除的小鼠和淀粉样前体蛋白转基因的小鼠杂交后发现,降低Tau蛋白水平可以保护神经元细胞抵抗过量Aβ产生的细胞毒性,这提示AD的病理机制中Aβ神经元毒性可能需要Tau蛋白来介导,两者的协同作用增强对细胞的毒性作用。此外,AD患者出现症状的年龄也会明显影响18F-AV1451的摄取模式。散发型早发性AD患者表现出明显更多的颞顶叶和额叶示踪剂沉积,而晚发性AD患者的示踪剂沉积则局限于颞叶。为了明确深入地了解Aβ蛋白、Tau蛋白与认知变化的关系,Tosun等[20]对42例正常老年人和40例AD-MCI患者行18F-AV1451 PET和18F-Florbetapir PET,并进行2年的追踪检查,结果发现:(1)18F-AV1451的结合力(SUVR)与受检者的教育年限、性别及载脂蛋白E(ApoE)基因型无关,但是与Aβ和年龄存在变化的相关性,在基底节、颞叶、内侧眶额回、海马及杏仁核,18F-AV1451的SUVR与年龄呈正相关(r=0.16,P=0.004);在内侧额叶,18F-AV1451的SUVR与年龄呈负相关。(2)在颞顶联合区和楔前叶,Aβ的聚集变化与18F-AV1451的沉积明显相关,特别是在颞下回和顶下小叶区域。(3)Aβ年度变化不能独立解释任何认知或临床症状的变化,但在Aβ阴性(Aβ−)组内,18F-AV1451的沉积模式能够解释48%的MMSE变化(P<10−4)和23%的复合记忆分数变化(P=0.02);在Aβ阳性(Aβ+)组内,18F-AV1451的沉积模式能够解释32%的复合记忆分数变化(P=0.002)。Pontecorvo等[21]也发现,18F-AV1451分布的范围和程度在Aβ+的受试者中有很大的差异。虽然新皮层Tau蛋白的滞留始终与Aβ+一致,但不是所有的Aβ+受试者18F-AV1451的SUVR都增高,而且Aβ+组内18F-AV1451结合增加也与认知损伤相关。这些结果印证了是Tau蛋白缠结,而不是Aβ聚集率与认知和临床症状相关,同时增加的Aβ聚集率和Tau蛋白沉积并非局灶性关联,这提示Aβ沉积对AD的病理性发展可能是一种远隔效应。
另一项对50~85岁早期AD患者(MMSE>20分)进行Aβ(18F-AV45)和Tau(18F-AV1451)PET联合显像的多中心研究结果显示,年龄与Tau蛋白沉积在内嗅皮层、丘脑、海马、海马旁回、枕叶、顶叶和额叶等多个脑区呈显著负相关:年轻的轻度AD患者Tau蛋白沉积相对多,而老年轻度AD患者虽然皮层中Tau蛋白沉积较少,但6个月内认知恶化速度较年轻AD患者更快。因此,研究者认为年轻患者患病可能始于Tau蛋白病理性沉积,之后的病情进展则依赖于多种病理学机制[22]。但是,Iaccarino等[23]对30例Aβ+的中度AD患者行18F-AV1451、11C-匹兹堡化合物B(11C-Pittsburg compound B,11C-PIB )PET和MRI对照显像发现,18F-AV1451的摄取水平与大脑灰质峰值在枕叶内侧回和枕下回在体素水平上呈负相关,而11C-PIB的摄取水平与减少的灰质体积无相关性,这说明在中度AD中,同样是Tau蛋白的进展导致了局部神经退行性病变。
对以遗忘为核心症状的典型AD的大量研究结果证实,认知损伤的进展与来自内侧颞叶(内嗅皮层、海马旁回和海马结构)的Tau蛋白的病理性扩展一致,并导致早期情景性记忆障碍进展,伴随失语、失用和失认。除此之外,还有一些患者被尸检证实为非典型AD,如逻辑变异型原发性进行性失语(logopenic variant of primary progressive aphasia,LvPPA)、后部皮层萎缩(posterior cortical atrophy,PCA)和额叶变异型AD[24]。目前认为,病理性Tau蛋白沉积部位的不同可能会导致临床症状的不同[25]。为了印证该论点,Ossenkoppele等[26]对5例典型AD患者以及12例非典型AD患者(包括7例PCA和5例LvPPA患者)分别行18F-AV1451 PET和11C-PIB PET,结果证实,18F-AV1451 PET显示出与临床表型一致的局部沉积:在典型遗忘型AD中,18F-AV1451明显沉积在内侧颞叶和外侧颞顶叶;PCA的沉积在后部区域;LvPPA的沉积在左侧脑半球的语言中枢,1例表型为执行功能、视空间和语言功能障碍但情景记忆保留的患者,Tau蛋白弥漫分布于除内侧颞叶外的大脑皮层。而11C-PIB则全脑弥漫沉积,典型AD和非典型AD间的差异无统计学意义。这充分证明了Tau蛋白的病理性沉积与神经退化的模式及AD的临床表型密切相关。Xia等[27]的研究也得出了类似结论。
在18F-AV1451 PET的横向研究结果显示Tau蛋白沉积反映疾病严重程度和临床表型变化的基础上,Cho等[28]对AD患者脑皮质Tau蛋白沉积的长程变化及其与认知功能减退的关系进行了纵向研究。该研究纳入了31例MCI患者和24例AD患者,每例均完成Tau和Aβ的基线PET扫描(18F-AV1451 PET和18F-Florbetaben PET)、MRI和神经生理测验,对所有受试者在2年后进行了相同的评估。结果显示,MCI 组和AD组在2年间整体大脑皮质18F-Florbetaben的SUVR无明显变化,而18F-AV1451的SUVR分别增加了0.06(2.9%)和0.19(8.0%)。MCI 与增加的中下颞叶皮质中Tau蛋白优势聚集有关,而AD显示外侧颞叶皮质中Tau蛋白聚集增多。MCI组中向AD进展的、整体认知功能恶化的患者存在广泛皮质区的进展性Tau蛋白聚集,而认知功能未恶化者外侧颞叶皮质中仅有轻微的Tau蛋白的SUVR升高,这说明整体认知功能和语言功能的恶化与新皮质中Tau蛋白聚集进展有关。由此可见,18F-AV1451 PET可用于监测AD进展。
-
目前,有很多假说试图解释Aβ和Tau蛋白在脑部的传播及分布,最突出的即网络退变假说[29-30]。该假说认为,神经退行性疾病病理性蛋白的播散沿着功能网络进行,相关功能网络的崩塌反过来又会加剧临床症状。过去10年来,多模态影像研究结果已经提供了确凿的证据支持网络退变假说:Aβ沉积区域和神经功能网络,特别是默认模式网络(default mode network, DMN)存在一定的空间重叠,并且DMN区域Aβ沉积量的增加,在无症状个体中可以作为早期AD的标志[31-32]。那么Tau蛋白是否同样按照功能网络来传播?AD啮齿类动物模型实验结果证实,细胞外的Tau蛋白磷酸化可通过刺激M1/M3毒蕈碱受体导致细胞内钙离子受体活性增强,进一步使细胞外Tau蛋白发生胞吞现象,继而按照类似朊蛋白的传播方式,通过神经元轴突将Tau蛋白错误折叠的能力传播至其他神经元,影响连接的脑区,最终导致严重的神经退行性病变[33-34]。Hoenig等[35]对22例遗忘型AD患者的18F-AV1451 PET数据进行独立成分分析,结果探测到10个独立的Tau蛋白病理网络,分别为左侧颞叶外侧脑回网络、左侧前中央脑回网络、右侧楔前叶网络、右侧枕上回网络、左侧梭状回网络、左侧后扣带回皮层网络、右侧楔叶网络、右侧额叶内侧和眶回网络、右侧颞上回网络和左侧海马旁回网络。它们与高功能连接区域相吻合,空间上类似于已经确立的语言网络、额叶控制网络、DMN、视空间网络和海马网络。Tau蛋白病理网络与相应的Tau蛋白依赖性种子功能网络有一定的重叠(Dice相似系数:0.13~0.57),后者与静息态功能网络,特别是DMN也有重叠(Dice相似系数:0.42~0.56)。有趣的是,这种空间相似性在腹侧和背侧DMN最高,在语言、初级和高级视觉网络以及海马网络相似性也很显著。Hansson等[36]的研究结果亦显示,AD患者的Tau蛋白病理性沉积模式与多个认知相关网络有关,Tau蛋白显著沉积的区域与背侧注意网络重叠,同时具有较高的视觉、边缘和DMN网络成分。以上结果表明,Tau蛋白并非只分布在某个特定网络,而是遵循着几个独立的网络路径,在大脑不同区域内连续发展。另有研究结果显示,Tau蛋白相关网络的局部(如颞叶)破坏会导致代偿性Tau负荷转移至后部DMN以及与Aβ和网络崩塌有关的其他网络节点[37]。因此,未来纵向研究功能连接网络和Tau蛋白病理网络之间的关联对阐明Tau蛋白病理传播模式,明确Aβ和Tau蛋白沉积的先后顺序和相互作用形式,以及在网络水平深入探求AD发生发展的机制非常重要。
-
18F-AV1451是第一代Tau蛋白探针,存在不足。多项体内实验结果显示,18F-AV1451在一些脑区有“脱靶”现象,特别是在基底节、中脑黑质和脉络丛区域有明显的非特异性摄取[9, 38]。虽然体外研究结果显示,18F-AV1451对大脑高表达的单胺氧化酶B(monoamine oxidase-B,MAO-B)有着与Tau蛋白相似的亲和力[39],并且可能是造成“脱靶”的原因,但是Hansen等[40]在使用和不使用MAO-B抑制剂的非痴呆帕金森病患者PET扫描之间没有观察到18F-AV1451沉积的显著差异,这说明人体内18F-AV1451与MAO-B的结合并不明显。而铁敏感的MRI证实,AD患者和正常对照组受试者的尾状核、壳核和苍白球对18F-AV1451的非特异性摄取与这些部位的铁沉积有关[41]。中脑黑质对18F-AV1451的非特异性摄取可能与多巴胺能神经元黑色素聚集有关[38]。此外,18F-AV1451在脉络丛的浓集会严重影响邻近海马结构的定量分析[9]。因此,关于18F-AV1451的争议一直不断,临床和科学研究需要更灵敏、更特异的示踪剂来反映Tau蛋白在脑内的病理性聚集。第二代Tau示踪剂(如18F-MK6420、18F-RO69558948和18F-PI2620)的体外实验结果显示,它们很少或不受“脱靶”影响,目前已初步应用于临床,具有良好的发展潜力和应用前景[42-44]。
-
利用Tau蛋白分子探针,通过先进的PET影像技术,以非侵入性方式显示病理性Tau蛋白的产生、分布与变化,对于临床诊断和研究各类型Tau蛋白相关的痴呆疾病,特别是对于AD具有重要的作用。2018年4月,美国国家老年化研究所(老年痴呆症协会)提出了新的AD研究框架。该框架建议,通过神经病理学或生物标志物对AD进行生物学定义,提出只有同时具备Aβ沉积和Tau蛋白沉积两项特征才能称之为AD,而不再仅依赖于临床症状,从而将生物标志物的重要性提高到前所未有的高度[45]。研发更为特异的Tau蛋白分子探针,有助于深入理解Tau蛋白病变的进展与认知损害之间的关系及其在各类型AD中的发病机制,还可以有效监测AD的进展、评估靶向疗效和预后,因而具有巨大的临床和科研潜力。鉴于AD的复杂性,多种PET分子影像探针联合应用,或将PET与其他诊断手段,如脑脊液检测和功能MRI相结合,将成为未来AD早期诊断及机制研究的重要趋势,并对AD治疗药物的研发起到积极的推动作用。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 蔡莉负责命题的提出、综述的撰写;王颖、杨海磊负责综述的修订;李彦生负责综述的审阅。
18F-AV1451 PET在阿尔茨海默病中的临床研究进展
Clinical research progress of 18F-AV1451 PET imaging in Alzheimer disease
-
摘要: 阿尔茨海默病(AD)是一种起病隐匿的神经退行性疾病,其主要病理学特征为β淀粉样蛋白沉积形成的老年斑和Tau蛋白异常聚集形成的神经原纤维缠结。使用特异性靶向Tau蛋白的PET分子探针可完成AD的无创精准检测,为AD的早期诊断、疾病进展监测、发病机制和认知功能研究等提供一种有效的检测手段。笔者以18F-AV1451为代表,对Tau蛋白PET显像在AD中的临床研究进展进行综述。
-
关键词:
- 阿尔茨海默病 /
- Tau蛋白质类 /
- 分子探针 /
- 正电子发射断层显像术 /
- 18F-AV1451
Abstract: Alzheimer disease (AD) is a neurodegenerative disease with insidious onset. The pathological features of AD are senile plaques formed by the deposition of amyloid-β protein and neurofibrillary tangles formed by abnormal aggregation of Tau protein. Through the use of PET molecular probes specifically targeting Tau protein, noninvasive and accurate detection of AD can be completed, which provides an effective method for early diagnosis, disease progression monitoring, pathogenesis and cognitive function evaluation of AD. Represented by 18F-AV1451, this review summarizes the clinical research progress of Tau protein PET imaging in AD.-
Key words:
- Alzheimer disease /
- Tau proteins /
- Molecular probes /
- Positron-emission tomography /
- 18F-AV1451
-
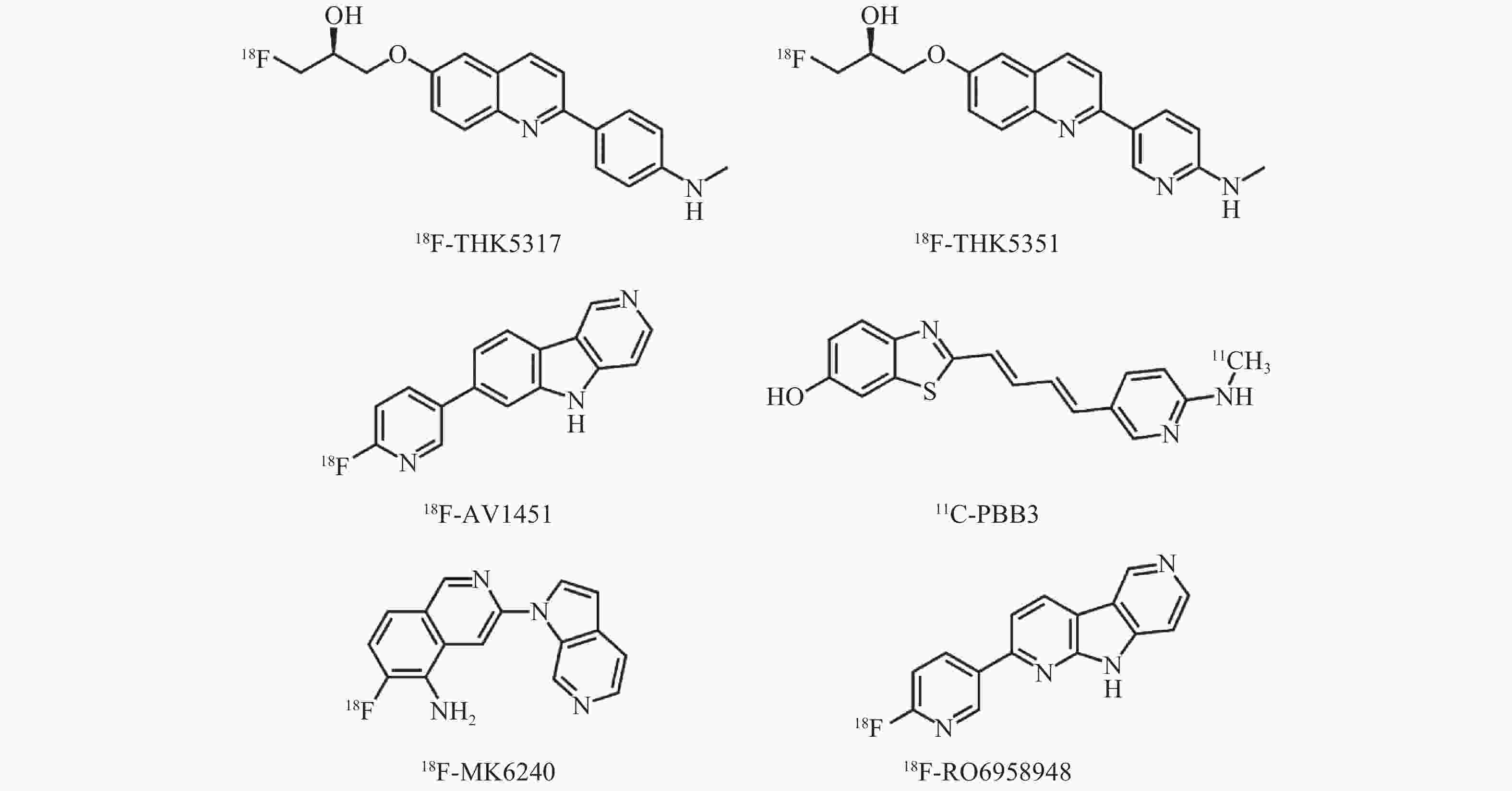
表 1 各类型Tau蛋白分子探针及其特点
Table 1. Characteristics of Tau protein PET molecular probes
Tau蛋白分子探针类型 代表探针 特点 喹啉类衍生物 (S)-6-[(3-[18F]氟-2-羟基)丙氧基]-2-(4-甲氨基苯基)喹啉,即18F-THK5317; (S)-6-[(3-[18F]氟-2-羟基)丙氧基]-2-(2-甲氨吡啶-5-基)喹啉,即18F-THK5351 与AD型、非AD型痴呆患者脑内病理性Tau蛋白亲和力均较强,存在“脱靶”非特异性摄取 苯并咪唑嘧啶类衍生物 7-(6-[18F]氟-吡啶-3-基)-5H-吡啶并[4,3-b]吲哚,即18F-AV1451 与AD型痴呆患者脑内病理性Tau蛋白亲和力强,存在“脱靶”非特异性摄取,临床应用较多 苯并噻唑类衍生物 {4-[3-(6-[11C]甲氨基)-吡啶基]-顺丁二烯基}-6-羟基-苯并噻唑,即11C-PBB3 与AD型、非AD型痴呆患者脑内病理性Tau蛋白亲和力均较强,但半衰期短,生物稳定性不佳,存在“脱靶”非特异性摄取 氮杂吲哚类衍生物 6-[18F]氟-3-(1H-吡咯并[2,3-c]吡啶-1-基)-异喹啉-5-胺,即18F-MK6240 与病理性Tau蛋白亲和力较高,不存在“脱靶”现象,临床应用较少 罗氏系列-二吡啶并吡咯类衍生物 2-(6-[18F]氟-吡啶-3-基)-9H-二吡啶并[2,3-b; 3′,4′-d]吡咯,即18F-RO6958948 与病理性Tau蛋白亲和力高,不存在“脱靶”现象,刚刚进入临床阶段 注:表中,AD:阿尔茨海默病 -
[1] Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease[J]. Nat Rev Neurosci, 2018, 19(11): 687−700. DOI: 10.1038/s41583-018-0067-3. [2] Jagust W. Time for tau[J]. Brain, 2014, 137(6): 1570−1571. DOI: 10.1093/brain/awu093. [3] Villemagne VL, Fodero-Tavoletti MT, Masters CL, et al. Tau imaging: early progress and future directions[J]. Lancet Neurol, 2015, 14(1): 114−124. DOI: 10.1016/S1474-4422(14)70252-2. [4] Kolb HC, Andrés JI. Tau positron emission tomography imaging[J/OL]. Cold Spring Harb Perspect Biol, 2017, 9(5): a023721[2019-05-07]. http://cshperspectives.cshlp.org. DOI: 10.1101/cshperspect.a023721. [5] Xia CF, Arteaga J, Chen G, et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer′s disease[J]. Alzheimers Dement, 2013, 9(6): 666−676. DOI: 10.1016/j.jalz.2012.11.008. [6] Chien DT, Bahri S, Szardenings AK, et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F-18]-T807[J]. J Alzheimers Dis, 2013, 34(2): 457−468. DOI: 10.3233/JAD-122059. [7] Thal DR, Vandenberghe R. Monitoring the progression of Alzheimer's disease with τ-PET[J]. Brain, 2016, 139(5): 1318−1320. DOI: 10.1093/brain/aww057. [8] Shcherbinin S, Schwarz AJ, Joshi A, et al. Kinetics of the tau PET tracer 18F-AV-1451 (T807) in subjects with normal cognitive function, mild cognitive impairment, and Alzheimer disease[J]. J Nucl Med, 2016, 57(10): 1535−1542. DOI: 10.2967/jnumed.115.170027. [9] Lowe VJ, Curran G, Fang P, et al. An autoradiographic evaluation of AV-1451 tau PET in dementia[J/OL]. Acta Neuropathol Commun, 2016, 4(1): 58[2019-05-07]. https://actaneurocomms.biomedcentral.com. DOI: 10.1186/s40478-016-0315-6. [10] Marquié M, Normandin MD, Meltzer AC, et al. Pathological correlations of [F-18]-AV-1451 imaging in non-alzheimer tauopathies[J]. Ann Neurol, 2017, 81(1): 117−128. DOI: 10.1002/ana.24844. [11] Schöll M, Maass A, Mattsson N, et al. Biomarkers for tau pathology[J]. Mol Cell Neurosci, 2019, 97: 18−33. DOI: 10.1016/j.mcn.2018.12.001. [12] Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes[J]. Acta Neuropathol, 1991, 82(4): 239−259. DOI: 10.1007/BF00308809. [13] Schwarz AJ, Yu P, Miller BB, et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages[J]. Brain, 2016, 139(5): 1539−1550. DOI: 10.1093/brain/aww023. [14] Lowe VJ, Wiste HJ, Senjem ML, et al. Widespread brain tau and its association with ageing, Braak stage and Alzheimer's dementia[J]. Brain, 2018, 141(1): 271−287. DOI: 10.1093/brain/awx320. [15] Lockhart SN, Schöll M, Baker SL, et al. Amyloid and tau PET demonstrate region-specific associations in normal older people[J]. Neuroimage, 2017, 150: 191−199. DOI: 10.1016/j.neuroimage.2017.02.051. [16] Maass, A, Lockhart SN, Harrison TM, et al. Entorhinal tau pathology, episodic memory decline, and neurodegeneration in aging[J]. J Neurosci, 2018, 38(3): 530−543. DOI: 10.1523/JNEUROSCI.2028-17.2017. [17] Buckley RF, Hanseeuw B, Schultz AP, et al. Region-specific association of subjective cognitive decline with tauopathy independent of global β-amyloid burden[J]. JAMA Neurol, 2017, 74(12): 1455−1463. DOI: 10.1001/jamaneurol.2017.2216. [18] Polanco JC, Li CZ, Bodea LG, et al. Amyloid-β and tau complexity-towards improved biomarkers and targeted therapies[J]. Nat Rev Neurol, 2018, 14(1): 22−39. DOI: 10.1038/nrneurol.2017.162. [19] Roberson ED, Scearce-Levie K, Palop JJ, et al. Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer's disease mouse model[J]. Science, 2007, 316(5825): 750−754. DOI: 10.1126/science.1141736. [20] Tosun D, Landau S, Aisen PS, et al. Association between tau deposition and antecedent amyloid-β accumulation rates in normal and early symptomatic individuals[J]. Brain, 2017, 140(5): 1499−1512. DOI: 10.1093/brain/awx046. [21] Pontecorvo MJ, Devous MD Sr, Navitsky M, et al. Relationships between flortaucipir PET tau binding and amyloid burden, clinical diagnosis, age and cognition[J]. Brain, 2017, 140(3): 748−763. DOI: 10.1093/brain/aww334. [22] Koychev I, Gunn RN, Firouzian A, et al. PET tau and amyloid-β burden in mild Alzheimer's disease: divergent relationship with age, cognition, and cerebrospinal fluid biomarkers[J]. J Alzheimers Dis, 2017, 60(1): 283−293. DOI: 10.3233/JAD-170129. [23] Iaccarino L, Tammewar G, Ayakta N, et al. Local and distant relationships between amyloid, tau and neurodegeneration in Alzheimer's disease[J/OL]. Neuroimage Clin, 2017, 17: 452−464[2019-05-07]. https://www.ncbi.nlm.nih.gov/pmc/journals/2173. DOI: 10.1016/j.nicl.2017.09.016. [24] Dubois B, Feldman HH, Jacova C, et al. Advancing research diagnostic criteria for Alzheimer's disease: the IWG-2 criteria[J]. Lancet Neurol, 2014, 13(6): 614−629. DOI: 10.1016/S1474-4422(14)70090-0. [25] Sarazin M, Lagarde J, Bottlaender M. Distinct tau PET imaging patterns in typical and atypical Alzheimer's disease[J]. Brain, 2016, 139(5): 1321−1324. DOI: 10.1093/brain/aww041. [26] Ossenkoppele R, Schonhaut DR, Schöll M, et al. Tau PET patterns mirror clinical and neuroanatomical variability in Alzheimer's disease[J]. Brain, 2016, 139(5): 1551−1567. DOI: 10.1093/brain/aww027. [27] Xia CJ, Makaretz SJ, Caso C, et al. Association of in vivo [18F]AV-1451 Tau PET imaging results with cortical atrophy and symptoms in typical and atypical Alzheimer disease[J]. JAMA Neurol, 2017, 74(4): 427−436. DOI: 10.1001/jamaneurol.2016.5755. [28] Cho H, Choi JY, Lee HS, et al. Progressive tau accumulation in Alzheimer's disease: two-year follow-up study[J]. J Nucl Med, 2019, 60(11): 1611−1621. DOI: 10.2967/jnumed.118.221697. [29] Seeley WW, Crawford RK, Zhou J, et al. Neurodegenerative diseases target large-scale human brain networks[J]. Neuron, 2009, 62(1): 42−52. DOI: 10.1016/j.neuron.2009.03.024. [30] Jones DT, Graff-Radford J, Lowe VJ, et al. Tau, amyloid, and cascading network failure across the Alzheimer's disease spectrum[J]. Cortex, 2017, 97: 143−159. DOI: 10.1016/j.cortex.2017.09.018. [31] Grothe MJ, Teipel SJ. Spatial patterns of atrophy, hypometabolism, and amyloid deposition in Alzheimer's disease correspond to dissociable functional brain networks[J]. Hum Brain Mapp, 2016, 37(1): 35−53. DOI: 10.1002/hbm.23018. [32] Jones DT, Knopman DS, Gunter JL, et al. Cascading network failure across the Alzheimer's disease spectrum[J]. Brain, 2016, 139(2): 547−562. DOI: 10.1093/brain/awv338. [33] de Calignon A, Polydoro M, Suárez-Calvet M, et al. Propagation of tau pathology in a model of early Alzheimer's disease[J]. Neuron, 2012, 73(4): 685−697. DOI: 10.1016/j.neuron.2011.11.033. [34] Liu L, Drouet V, Wu JW, et al. Trans-synaptic spread of tau pathology in vivo[J/OL]. PLoS One, 2012, 7(2): e31302[2019-05-07]. http://www.plosone.org. DOI: 10.1371/journal.pone.0031302. [35] Hoenig MC, Bischof GN, Seemiller J, et al. Networks of tau distribution in Alzheimer's disease[J]. Brain, 2018, 141(2): 568−581. DOI: 10.1093/brain/awx353. [36] Hansson O, Grothe MJ, Strandberg TO, et al. Tau pathology distribution in Alzheimer's disease corresponds differentially to cognition-relevant functional brain networks[J]. Front Neurosci, 2017, 11: 167. DOI: 10.3389/fnins.2017.00167. [37] Wiepert DA, Lowe VJ, Knopman DS, et al. A robust biomarker of large-scale network failure in Alzheimer's disease[J/OL]. Alzheimers Dement(Amst), 2017, 6: 152−161[2019-05-07]. https://alz-journals.onlinelibrary.wiley.com/journal/23528729. DOI: 10.1016/j.dadm.2017.01.004. [38] Choi JY, Cho H, Ahn SJ, et al. Off-target 18F-AV-1451 binding in the basal ganglia correlates with age-related iron accumulation[J]. J Nucl Med, 2018, 59(1): 117−120. DOI: 10.2967/jnumed.117.195248. [39] Vermeiren C, Motte P, Viot D, et al. The tau positron-emission tomography tracer AV-1451 binds with similar affinities to tau fibrils and monoamine oxidases[J]. Mov Disord, 2018, 33(2): 273−281. DOI: 10.1002/mds.27271. [40] Hansen AK, Brooks DJ, Borghammer P, et al. MAO-B inhibitors do not block in vivo flortaucipir([18F]-AV-1451) binding[J]. Mol Imaging Biol, 2018, 20(3): 356−360. DOI: 10.1007/s11307-017-1143-1. [41] Marquié M, Verwer EE, Meltzer AC, et al. Lessons learned about [F-18]-AV-1451 off-target binding from an autopsy-confirmed Parkinson's case[J/OL]. Acta Neuropathol Commun, 2017, 5(1): 75[2019-05-07]. https://actaneurocomms.biomedcentral.com. DOI: 10.1186/s40478-017-0482-0. [42] Wong DF, Comley RA, Kuwabara H, et al. Characterization of 3 novel tau radiopharmaceuticals, 11C-RO-963, 11C-RO-643, and 18F-RO-948, in healthy controls and in Alzheimer subjects[J]. J Nucl Med, 2018, 59(12): 1869−1876. DOI: 10.2967/jnumed.118.209916. [43] Hostetler ED, Walji AM, Zeng ZZ, et al. Preclinical characterization of 18F-MK-6240, a promising PET tracer for in vivo quantification of human neurofibrillary tangles[J]. J Nucl Med, 2016, 57(10): 1599−1606. DOI: 10.2967/jnumed.115.171678. [44] Kroth H, Oden F, Molette J, et al. Discovery and preclinical characterization of [18F]PI-2620, a next-generation tau PET tracer for the assessment of tau pathology in Alzheimer's disease and other tauopathies[J]. Eur J Nucl Med Mol Imaging, 2019, 46(10): 2178−2189. DOI: 10.1007/s00259-019-04397-2. [45] Jack CR Jr, Bennett DA, Blennow K, et al. NIA-AA research framework: toward a biological definition of Alzheimer's disease[J]. Alzheimers Dement, 2018, 14(4): 535−562. DOI: 10.1016/j.jalz.2018.02.018. -





 下载:
下载: