-
前列腺癌是男性最常见的恶性肿瘤之一,在发达国家其发病率位居男性恶性肿瘤的首位;病死率仅次于肺癌和结直肠癌,位居男性恶性肿瘤的第3位[1]。前列腺癌在某种意义上是一种异质性疾病,尽管该病在某些患者中可能处于休眠状态,但在有些患者中可以迅速发展[2]。研究结果显示,前列腺癌抗雄激素治疗后1~5个月原发灶和转移灶的18F-FDG摄取减少,这与血清前列腺特异性抗原水平下降和CT上病变大小减小一致[3-4]。 目前, 18F-FDG是应用最为广泛的糖代谢正电子显像剂[5],在多种肿瘤的探测、鉴别诊断及分期上具有独特优势。由于前列腺癌的生物学和组织学特性具有多样化的特点,其对18F-FDG的摄取也表现出不同程度的差异。国内文献报道,18F-FDG PET/CT对于前列腺癌的检出率仅为61%[6]。故目前对前列腺癌的诊断仍存在争议,临床上正常前列腺18F-FDG PET/CT摄取异常的现象并不少见[7]。目前国内对于正常前列腺生理性摄取18F-FDG的相关研究相对较少。因此,我们通过分析正常前列腺18F-FDG PET/CT代谢显像的增龄变化,旨在构建前列腺葡萄糖代谢正常值评价体系以及对18F-FDG PET/CT在前列腺癌中的精确诊断提供对比参照。
-
回顾性分析2018年6月至2019年2月于安徽医科大学第二附属医院行18F-FDG PET/CT的成年男性非前列腺癌患者181例,年龄19~94(60.6±14.5)岁,其中淋巴瘤64例、肺癌53例、胃癌20例、其他肿瘤30例、非肿瘤性病变14例。纳入标准:①成年男性且非前列腺癌患者;②检查前1个月内未行化疗;③无前列腺手术史;④血清前列腺特异性抗原水平在正常范围内。排除标准:①前列腺内有明显钙化灶;②检查前3个月内盆腔接受过体外放疗;③有前列腺疾病史或临床症状;④前列腺转移性肿瘤;⑤尿道前列腺部有明显放射性滞留。
参考我国年龄段划分标准,将所有患者按年龄段分成4组:19~39岁16例、40~59岁57例、60~79岁94例、80~99岁14例,近似对应中青年、中年、中老年及老年。
-
患者检查前24 h内避免剧烈运动,禁食4~6 h,检查前6~8 h禁输葡萄糖和肠内外营养液,一周内未做过钡餐检查。采用上海联影公司uMI510型PET/CT,显像剂为18F-FDG,由南京江原安迪科正电子研究发展有限公司提供,放射化学纯度>90%。患者静脉注射18F-FDG 2.96~4.44 MBq/kg,随后静卧休息,注射显像剂后需饮水500 mL,50 min后行常规PET/CT显像,显像前排空大小便。体部CT平扫范围自颅底至股骨中段;随后采集PET图像,采集5~7个床位,每个床位4 min。PET图像重建采用有序子集最大期望值法,采用CT采集数据进行图像衰减校正。CT采用标准法重建,矩阵512×512,管电压120 kV,管电流220 mAs,重建图像层厚均为3 mm。所有患者检查前均签署了知情同意书。
-
采用上海联影公司后处理工作站对所有图像进行处理分析。由2名具备5年以上工作经验的核医学主治医师采用盲法分别对图像进行分析。在PET/CT横断位选取最大层面测量前列腺左右径(简称最大横径)。CT值测量是以前列腺横径最大层面为中心,上下各取相邻一层,手工勾画ROI,ROI范围为3~4 cm2,计算获得3个层面CT值的平均值,按照上述方法重复测量3次,取平均值作为前列腺最终CT值(CTmean)。通过工作站容积测量获得前列腺SUVmax及平均标准化摄取值(mean standardized uptake value,SUVmean)。
-
使用SPSS 16.0软件进行统计学分析。对所有计量资料进行正态性检验及方差分析,符合正态分布的以均数±标准差(
$ \bar x $ ±s)表示。采用Pearson相关性分析、散点图和线性回归趋势线分析前列腺最大横径、SUVmax、SUVmean、CTmean和年龄之间的相关性。采用方差分析及LSD-t检验对不同年龄段的各组患者相关参数的均值进行多重比较。P<0.05为差异有统计学意义。 -
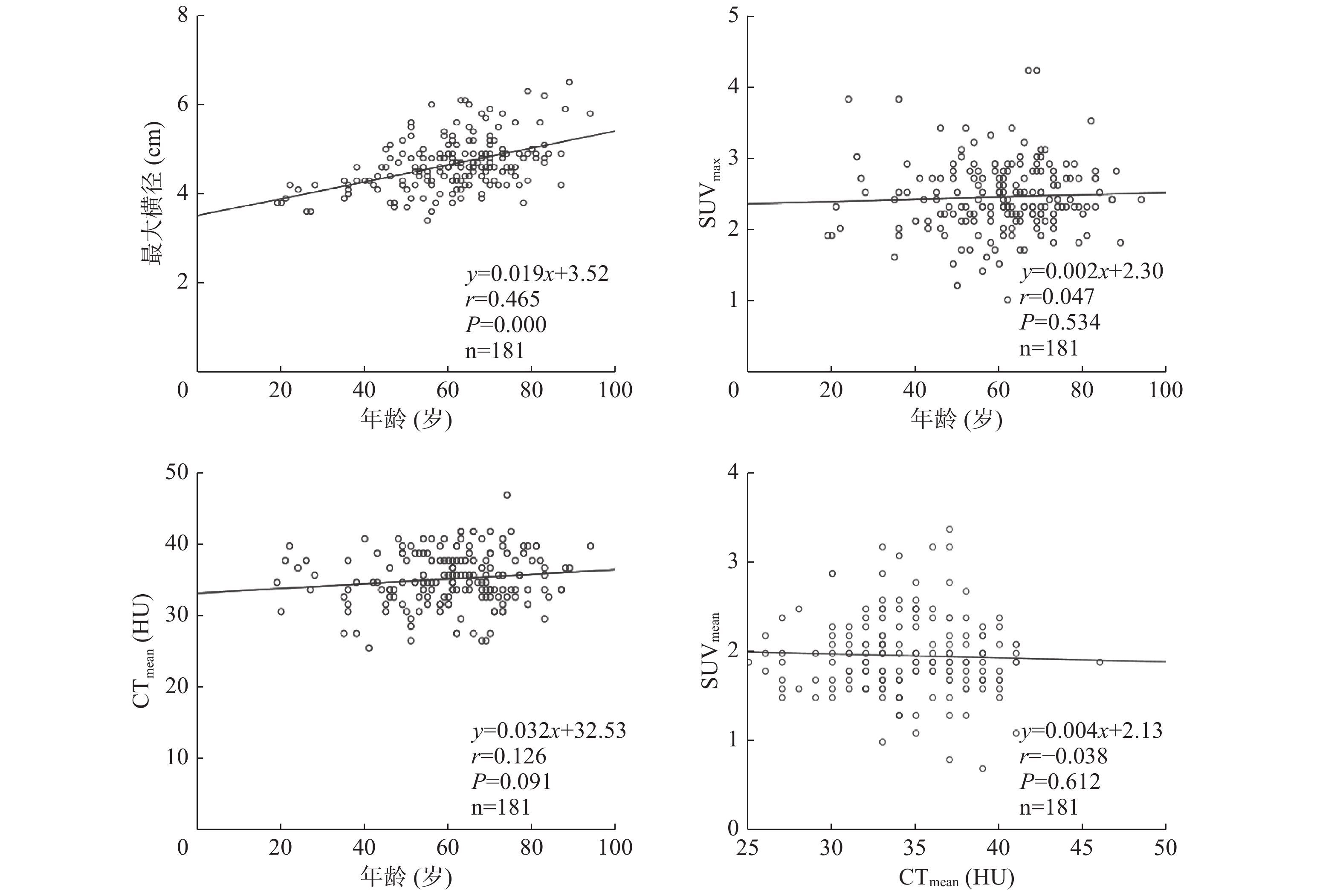
181例患者的前列腺最大横径为3.4~6.5(4.66±0.59) cm,SUVmax为1.0~4.2(2.44±0.49),SUVmean为0.7~3.4( 1.97±0.44),CTmean为25~46( 34.48±3.72) HU。前列腺最大横径与患者年龄呈正相关(r=0.465,P<0.001),CTmean随患者年龄的增长而增加,两者呈极弱相关性或无相关性(r=0.126,P=0.091);而SUVmax、SUVmean与患者年龄、前列腺最大横径无相关性(r=0.047、0.071、0.040、0.035,均P>0.05)(表1,图1)。不同年龄段的各组患者的最大横径均值间的差异有统计学意义(F=16.278,P<0.001),而SUVmax、SUVmean、CTmean均值间的差异均无统计学意义(F=0.485、1.114、1.025,均P>0.05)(表2)。
因变量 自变量 截距 斜率 r值 P值 最大横径 年龄 3.52 0.019 0.465 0.000 SUVmax 年龄 2.34 0.002 0.047 0.534 SUVmean 年龄 1.85 0.002 0.071 0.344 CTmean 年龄 32.53 0.032 0.126 0.091 SUVmax 最大横径 2.28 0.033 0.040 0.591 SUVmean 最大横径 1.86 0.026 0.035 0.644 CTmean 最大横径 33.97 0.111 0.018 0.814 SUVmean CTmean 2.13 −0.004 −0.038 0.612 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;SUVmean:平均标准化摄取值;CTmean:平均CT值 表 1 181例非前列腺癌患者的18F-FDG PET/CT参数及患者 年龄的相关性分析
Table 1. Correlation analysis among 18F-FDG PET/CT parameters, and patient age of 181 non prostate cancer
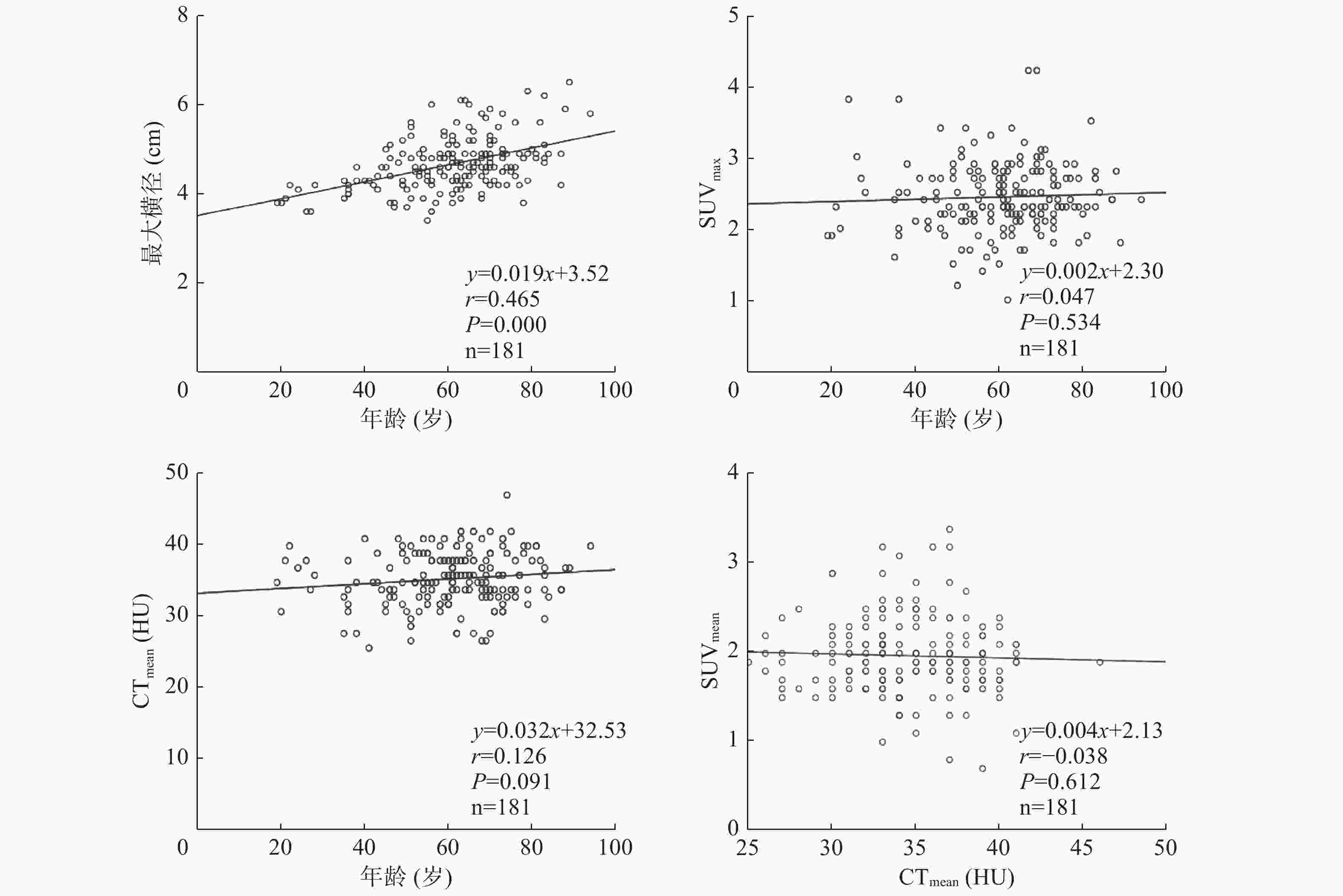
图 1 非前列腺癌患者18F-FDG PET/CT参数及患者年龄相关性分析的散点图及线性回归趋势线
Figure 1. Scatter plot and fit straight line of correlation analysis among 18F-FDG PET/CT parameters, and age of non prostate cancer
年龄段 例数 最大横径(cm) SUVmax SUVmean CTmean (HU) 19~39岁 16 4.04±0.27 2.48±0.65 2.03±0.51 33.25±3.59 40~59岁 57 4.52±0.53 2.38±0.50 1.90±0.44 34.19±3.76 60~79岁 94 4.77±0.54 2.46±0.47 2.00±0.42 34.76±3.80 80~99岁 14 5.24±0.65 2.48±0.42 2.05±0.41 35.29±2.97 F值 16.278 0.485 1.114 1.025 P值 0.000 0.693 0.345 0.383 LSD-t值 3.106 0.352 0.835 0.933 P值 0.001 0.772 0.442 0.355 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;SUVmean:平均标准化摄取值;CTmean:平均CT值 表 2 181例不同年龄段非前列腺癌患者的18F-FDG PET/CT 的参数比较(
$\bar x \pm s $ Table 2. Comparison of 18F-FDG PET/CT parameters of 181 non prostate cancer in all age groups (
$\bar x \pm s $ -
Takahashi等[8]认为,18F-FDG PET/CT显像可能不适用于前列腺癌的诊断。这可能是由于前列腺肿瘤18F-FDG代谢活动具有异质性,可以与正常前列腺组织和良性前列腺增生发生重叠,但Gleason评分>7的侵袭性原发性肿瘤倾向于高18F-FDG摄取,因此18F-FDG PET/CT可用于侵袭性原发性肿瘤的临床分期。有研究结果显示,在所有进行PET/CT检查的患者中,约2.1%的患者可检测到18F-FDG阳性的前列腺偶发瘤,其中7.5%为恶性,SUVmax对于区分良性与恶性偶发性前列腺病变无效,对于18F-FDG PET/CT显像阳性的前列腺偶发瘤应进一步检验血清前列腺特异性抗原[9]。Pietrzak等[10]研究结果表明,转移性骨肿瘤中癌细胞的葡萄糖代谢对骨质破坏后骨重构的葡萄糖利用的影响可忽略不计,与99Tcm-MDP显像相比,18F-FDG PET/CT在诊断骨转移方面的特异度要好得多。SUVmax及病变数量可为转移性去势敏感性前列腺癌激素治疗失败的患者提供独立的预后信息[11]。
近年来随着PET/CT的广泛应用,PET与CT的图像融合已经可以精确地定位人体各器官结构的代谢活动。为了准确地辨别正常与异常的组织结构,很有必要了解各种组织脏器结构的葡萄糖代谢及其随年龄增长的变化。国外已有一些基于18F-FDG PET/CT代谢显像在人体各正常组织中的生理学分布的报道,其中Wang等[12]对24名男性的正常前列腺的研究结果显示,SUVmax为1.9±0.35(1.6~3.4),但因其样本量较小,易产生偏差。Jadvar等[13]的研究纳入了145例非前列腺疾病的患者,结果显示前列腺最大径为(4.3±0.5) cm,CT值为(36.0±5.1) HU,SUVmax为1.6±0.4,SUVmean为1.3±0.4。这与本研究结果略有差异,有待于进一步的多中心研究,探究人种及生活饮食习惯等影响因素所致的差异。
Well等[14]研究结果显示,各种正常组织的结构和代谢随年龄变化很大。例如,前列腺体积从20岁的(23.5±6.2) cm3增至80岁的(47.5±41.6) cm3,前列腺中央带体积也从(9.9±3.9) cm3增至(29.5±28.9) cm3。在本研究中,前列腺最大横径表现出随着年龄增长而逐渐增大的趋势,二者呈正相关,这一结果与Jadvar等[13]的结论一致。但各年龄段患者前列腺18F-FDG代谢变化差异无统计学意义。另外,本研究结果显示前列腺CT值与年龄的相关系数(r=0.126)在0.1~0.3范围内,界定为极弱正相关或无相关,这可能是由于随着年龄的增长,前列腺增生的发生率也随之升高,导致细胞密度增加,进而影响CT值[15],同时部分高龄而无前列腺增生患者抵消了这些因前列腺增生导致CT值增加的影响。
由于临床实际和伦理原因,组织学活检不能用于没有临床证据的前列腺病变的患者,因此本研究局限于无临床症状、无影像学异常的前列腺,缺少病理学证据。良性前列腺增生和微小前列腺癌可以同时发生在正常的前列腺组织中。前列腺癌细胞对18F-FDG的摄取还可能取决于肿瘤的缺氧水平,其可以随肿瘤大小和等级而变化[16]。因此,临床资料和实验室检查的完善将有助于今后的进一步研究。
总之,我们对正常前列腺葡萄糖代谢的研究,有助于前列腺葡萄糖代谢正常值评价体系的构建,更有助于将来为18F-FDG PET/CT在前列腺癌中的精确诊断提供对比参照。正常前列腺最大横径随着年龄的增长而增加,但年龄不会显著影响前列腺的葡萄糖代谢和CT密度,因此可能不需要对这些参数进行年龄校正。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 黄山负责数据的统计分析、论文的撰写;李飞负责研究方案的设计、论文撰写的指导;庞小溪、高磊负责入组病例的提供与分析;张罡负责病例的收集与整理。
正常前列腺18F-FDG PET/CT代谢显像增龄变化的研究
Study on 18F-FDG PET/CT metabolic imaging of normal prostate with increasing age
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG) PET/CT显像中正常前列腺标准化摄取值(SUV)、CT值、PET/CT横断位最大层面测量的前列腺左右径(简称最大横径)和患者年龄之间的关系。 方法 回顾性分析2018年6月至2019年2月在安徽医科大学第二附属医院行18F-FDG PET/CT显像的非前列腺癌男性患者181例,年龄19~94(60.6±14.5)岁。将患者按年龄段分为4组:19~39岁16例、40~59岁57例、60~79岁94例、80~99岁14例。采用勾画感兴趣区(ROI)的方法测量各组患者前列腺18F-FDG最大标准化摄取值(SUVmax)、平均标准化摄取值(SUVmean)和平均CT值(CTmean),并在前列腺横断位最大层面测量前列腺最大横径。采用Pearson相关性分析、散点图和线性回归趋势线分析前列腺最大横径、SUVmax、SUVmean、CTmean和年龄之间的相关性,采用单因素方差分析及LSD-t检验对各组患者相关参数的均值进行多重比较。 结果 181例患者的前列腺最大横径为3.4~6.5(4.66±0.59) cm,SUVmax为1.0~4.2(2.44±0.49),SUVmean为0.7~3.4(1.97±0.44),CTmean为25~46(34.48±3.72) HU。前列腺最大横径与患者年龄呈正相关(r=0.465,P<0.001);前列腺SUVmax、SUVmean与患者年龄、前列腺最大横径无相关性(r=0.047、0.071、0.040、0.035,均P>0.05);前列腺CTmean随患者年龄的增长而增加,两者呈极弱相关性或无相关(r=0.126,P=0.091)。不同年龄段的各组患者的前列腺最大横径分别为(4.04±0.27)、(4.52±0.53)、(4.77±0.54)、(5.24±0.65)cm;SUVmax分别为(2.48±0.65)、(2.38±0.50)、(2.46±0.47)和(2.48±0.42);SUVmean分别为(2.03±0.51)、(1.90±0.44)、(2.00±0.42)和(2.05±0.41);CTmean分别为(33.25±3.59)、(34.19±3.76)、(34.76±3.80)、(35.29±2.97) HU。不同年龄段的各组患者前列腺最大横径之间的差异有统计学意义(F=16.278,P<0.001),而SUVmax、SUVmean和CTmean之间的差异均无统计学意义。 结论 前列腺最大横径随着患者年龄的增长而增加,但患者年龄不会显著影响前列腺的糖代谢和CT密度。 -
关键词:
- 前列腺 /
- 年龄组 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18 /
- 标准化摄取值
Abstract:Objective To investigate the correlations among standardized uptake value (SUV), CT value, maximum transverse diameter of normal prostate, and patient age through 18F-fluorodeoxyglucose (FDG) PET/CT. Methods Retrospective analysis of 181 male patients aged 19–94 (60.6±14.5) years who underwent 18F-FDG PET/CT in the Second Hospital of Anhui Medical University from June 2018 to February 2019 was performed. The patients were divided into four groups by age group (19–39 years, 16 cases; 40–59 years, 57 cases; 60–79 years, 94 cases; and 80–99 years, 14 cases). The maximum standardized uptake value (SUVmax), mean standardized uptake value (SUVmean), and mean CT value (CTmean) of prostate 18F-FDG were measured through a delineated region of interest method, and the maximum transverse diameter of the prostate was measured at the maximum transverse plane of the prostate. SPSS 16.0 statistical software was used in analyzing the correlations among the maximum transverse diameter of the prostate, SUVmax, SUVmean, CTmean, and age on the basis of the Pearson correlation coefficient, scatter plot, and linear regression trend line. One-way ANOVA and LSD-t test were used for each parameter. Results The maximum transverse diameter of the normal prostate was 3.4–6.5(4.66±0.59) cm, SUVmax was 1.0–4.2 (2.44±0.49), SUVmean was 0.7–3.4(1.97±0.44), CTmean was 25–46(34.5±3.72) HU. The maximum transverse diameter of the prostate was positively correlated with age (r=0.465, P<0.001). No significant correlation between prostate SUVmax, SUVmean and age, the maximum transverse diameter of the prostate (r=0.047, 0.071, 0.040, 0.035, all P>0.05). Prostate CTmean increased with age, and an extremely weak correlation or no correlation was observed between them (r=0.126, P=0.091). The maximum transverse diameters of all the age groups (19–39, 40–59, 60–79, and 80–99 years) were (4.04±0.27), (4.52±0.53), (4.77±0.54), and (5.24±0.65) cm, respectively, the SUVmax were 2.48±0.65, 2.38±0.50, 2.46±0.47, 2.48±0.42, respetively; the SUVmean were 2.03±0.51, 1.90±0.44, 2.00±0.42, and 2.05±0.41, respectively; and the CTmean were (33.25±3.59), (34.19±3.76), (34.76±3.80), and (35.29±2.97) HU, respectively. Significant differences were found among the maximum transverse diameters of the age groups (F=16.278, P<0.001), whereas no significant difference was found among SUVmax, SUVmean, and CTmean. Conclusion The maximum transverse diameter of the prostate increases with age, but age does not significantly affect the glucose metabolism and CT density of the prostate. -
表 1 181例非前列腺癌患者的18F-FDG PET/CT参数及患者 年龄的相关性分析
Table 1. Correlation analysis among 18F-FDG PET/CT parameters, and patient age of 181 non prostate cancer
因变量 自变量 截距 斜率 r值 P值 最大横径 年龄 3.52 0.019 0.465 0.000 SUVmax 年龄 2.34 0.002 0.047 0.534 SUVmean 年龄 1.85 0.002 0.071 0.344 CTmean 年龄 32.53 0.032 0.126 0.091 SUVmax 最大横径 2.28 0.033 0.040 0.591 SUVmean 最大横径 1.86 0.026 0.035 0.644 CTmean 最大横径 33.97 0.111 0.018 0.814 SUVmean CTmean 2.13 −0.004 −0.038 0.612 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;SUVmean:平均标准化摄取值;CTmean:平均CT值 表 2 181例不同年龄段非前列腺癌患者的18F-FDG PET/CT 的参数比较(
$\bar x \pm s $ Table 2. Comparison of 18F-FDG PET/CT parameters of 181 non prostate cancer in all age groups (
$\bar x \pm s $ 年龄段 例数 最大横径(cm) SUVmax SUVmean CTmean (HU) 19~39岁 16 4.04±0.27 2.48±0.65 2.03±0.51 33.25±3.59 40~59岁 57 4.52±0.53 2.38±0.50 1.90±0.44 34.19±3.76 60~79岁 94 4.77±0.54 2.46±0.47 2.00±0.42 34.76±3.80 80~99岁 14 5.24±0.65 2.48±0.42 2.05±0.41 35.29±2.97 F值 16.278 0.485 1.114 1.025 P值 0.000 0.693 0.345 0.383 LSD-t值 3.106 0.352 0.835 0.933 P值 0.001 0.772 0.442 0.355 注:表中,FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值;SUVmean:平均标准化摄取值;CTmean:平均CT值 -
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7−30. DOI: 10.3322/caac.21387. [2] Algaba F, Trias I, Arce Y. Natural history of prostatic carcinoma: the pathologist's perspective[J]. Recent Results Cancer Res, 2007, 175: 9−24. DOI: 10.1007/978-3-540-40901-4_2. [3] Oyama N, Akino H, Suzuki Y, et al. The increased accumulation of [18F] fluorodeoxyglucose in untreated prostate cancer[J]. Jpn J Clin Oncol, 1999, 29(12): 623−629. DOI: 10.1093/jjco/29.12.623. [4] Agus DB, Golde DW, Sgouros G, et al. Positron emission tomography of a human prostate cancer xenograft: association of changes in deoxyglucose accumulation with other measures of outcome following androgen withdrawal[J]. Cancer Res, 1998, 58(14): 3009−3014. [5] 王治国, 郭佳, 石庆学, 等. 18F-FDG PET/CT在前列腺癌诊断中的应用价值[J]. 临床军医杂志, 2014, 42(4): 409−411. DOI: 10.3969/j.issn.1671-3826.2014.04.26.
Wang ZG, Guo J, Shi QX, et al. Value of 18F-FDG PET/CT in diagnosis of prostate cancer[J]. Clin J Med Offic, 2014, 42(4): 409−411. DOI: 10.3969/j.issn.1671-3826.2014.04.26.[6] 林美福, 周硕, 陈文新, 等. 18F-FDG、18F-FECH双示踪剂PET/CT在前列腺癌诊疗中的应用[J]. 福建医科大学学报, 2012, 46(5): 366−369. DOI: 10.3969/j.issn.1672-4194.2012.05.019.
Lin MF, Zhou S, Chen WX, et al. The clinical value of dual agents PET/CT in the diagnosis and treatment of prostate cancer using 18F-FDG and 18F-FECH[J]. J Fujian Med Univ, 2012, 46(5): 366−369. DOI: 10.3969/j.issn.1672-4194.2012.05.019.[7] Yang ZY, Hu SL, Cheng JY, et al. Prevalence and risk of cancer of incidental uptake in prostate identified by fluorine-18 fluorodeoxyglucose positron emission tomography/computed tomography[J]. Clin Imaging, 2014, 38(4): 470−474. DOI: 10.1016/j.clinimag.2014.01.019. [8] Takahashi N, Inoue T, Lee J, et al. The roles of PET and PET/CT in the diagnosis and management of prostate cancer[J]. Oncology, 2007, 72(3/4): 226−233. DOI: 10.1159/000112946. [9] Makis W, Ciarallo A. Clinical significance of 18F-Fluorodeoxyglucose avid prostate gland incidentalomas on positron emission tomography/computed tomography[J]. Mol Imaging Radionucl Ther, 2017, 26(2): 76−82. DOI: 10.4274/mirt.07769. [10] Pietrzak A, Czepczynski R, Wierzchoslawska E, et al. Metabolic activity in bone metastases of breast and prostate cancer were similar as studied by 18F-FDG PET/CT. The role of 99mTc-MDP[J]. Hell J Nucl Med, 2017, 20(3): 237−240. DOI: 10.1967/s002449910608. [11] Jadvar H, Velez EM, Desai B, et al. Prediction of time to hormonal treatment failure in metastatic castration-sensitive prostate cancer with 18F-FDG PET/CT[J]. J Nucl Med, 2019, 60(11): 1524−1530. DOI: 10.2967/jnumed.118.223263. [12] Wang YB, Chiu E, Rosenberg J, et al. Standardized uptake value atlas: characterization of physiological 2-deoxy-2-[18F]fluoro-D-glucose uptake in normal tissues[J]. Mol Imaging Biol, 2007, 9(2): 83−90. DOI: 10.1007/s11307-006-0075-y. [13] Jadvar H, Ye W, Groshen S, et al. [F-18]-fluorodeoxyglucose PET-CT of the normal prostate gland[J]. Ann Nucl Med, 2008, 22(9): 787−793. DOI: 10.1007/s12149-008-0177-5. [14] Well D, Yang H, Houseni M, et al. Age-related structural and metabolic changes in the pelvic reproductive end organs[J]. Semin Nucl Med, 2007, 37(3): 173−184. DOI: 10.1053/j.semnuclmed.2007.01.004. [15] Britt RH, Lyons BE, Enzmann DR, et al. Correlation of neuropathologic findings, computerized tomographic and high-resolution ultrasound scans of canine avian sarcoma virus-induced brain tumors[J]. J Neurooncol, 1987, 4(3): 243−268. DOI: 10.1007/BF00150616. [16] Pugachev A, Ruan S, Carlin S, et al. Dependence of FDG uptake on tumor microenvironment[J]. Int J Radiat Oncol Biol Phys, 2005, 62(2): 545−553. DOI: 10.1016/j.ijrobp.2005.02.009. -





 下载:
下载: