-
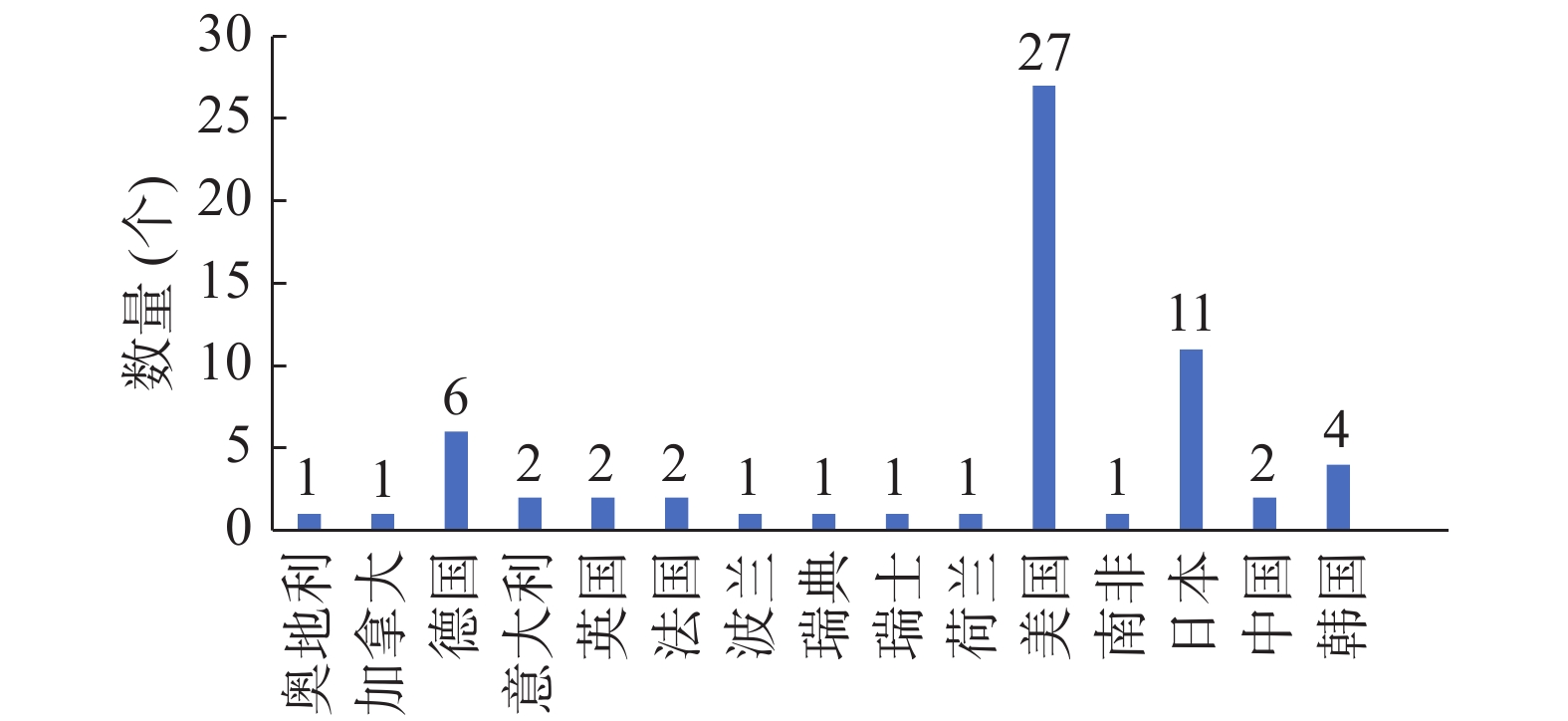
质子束治疗(proton beam therapy,PBT)是一种先进的放疗方法。与常规的X射线束放疗相比,PBT引起的不良反应少,治疗效果更好[1]。目前,PBT已成为世界各国令人瞩目和优先发展的肿瘤放疗技术。质子束的医学应用是1946年由Wilson首次提出的[2]。1954年,Tobias等[3]在美国加利福尼亚州大学的劳伦斯伯克利国家实验室开展了世界上第一例PBT。此后,瑞典、前苏联等国家相继开展了PBT的临床研究。迄今为止,全世界已建立了63个癌症PBT中心,仅在美国就有27个,目前按照各国的发展计划,预计到2020年全球PBT中心将有望达到123个(图1~2),截至2018年初,接受PBT的患者已超过15万例(表1)。
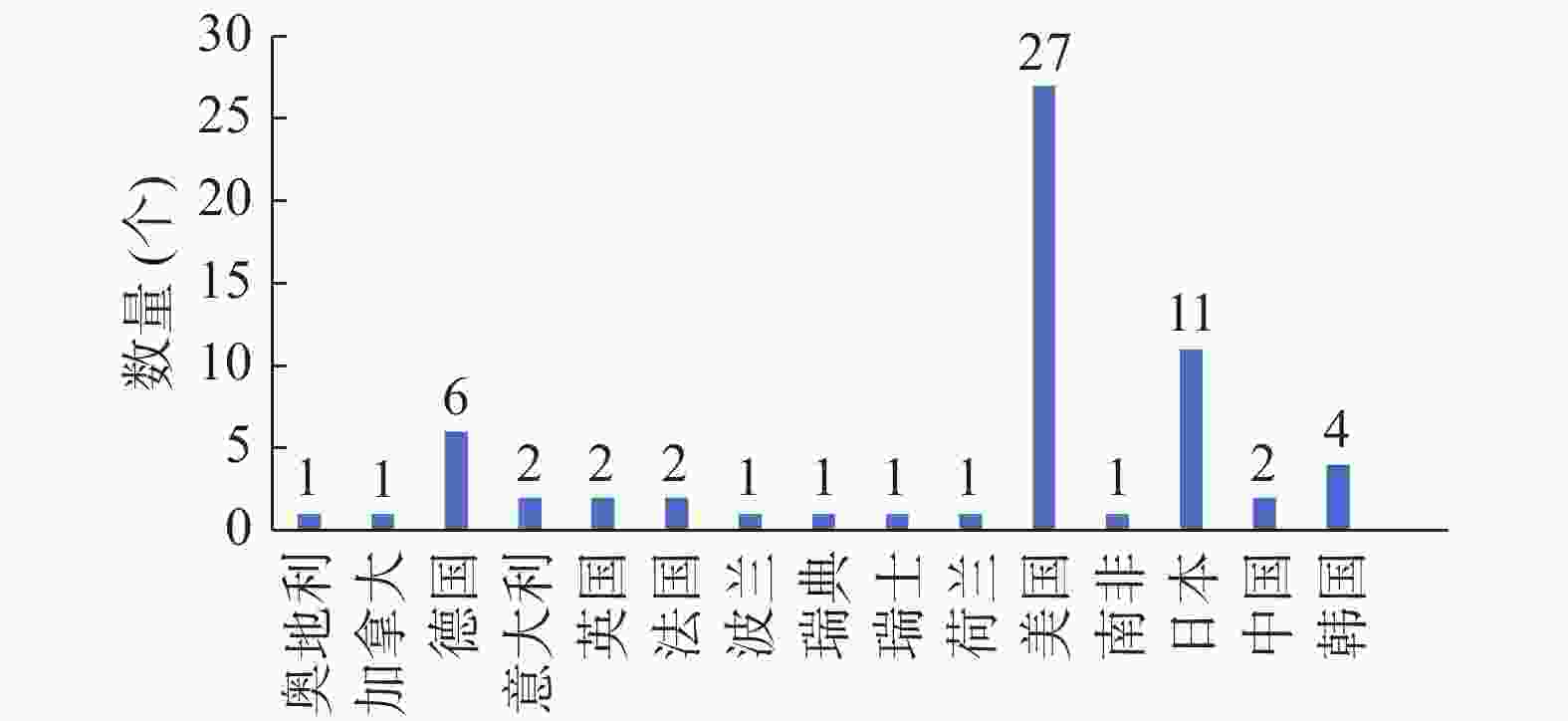
图 1 2018年全球质子束治疗中心的数量及分布情况
Figure 1. The number and distribution of global proton beam therapy center of 2018
国家 第一次治疗
的年份(年)患者总
数(例)最后一次更新
数据的日期奥地利 2017 79 2017年12月 比利时 1991 21 1993年12月 加拿大 1995 204 2017年12月 捷克共和国 2012 2428 2017年12月 中国 2004 2725 2017年12月 英格兰 1989 3223 2017年12月 法国 1991 14 880 2017年12月 德国 1998 10 082 2018年 2 月 意大利 2002 1302 2017年12月 日本 1979 26 764 2017年12月 波兰 2011 276 2017年12月 俄罗斯 1967 7128 2017年12月 南非 1993 524 2017年12月 韩国 2007 3200 2017年12月 瑞典 1957 1911 2017年12月 瑞士 1984 8448 2017年12月 美国 1954 87 370 2017年12月 总计 170 565 表 1 截至2018年初全球接受质子束治疗患者的统计数据 (由粒子治疗合作组收集的数据)
Table 1. Statistics of proton beam therapy patients as of the beginning of 2018 (Data collected by PTCOG)
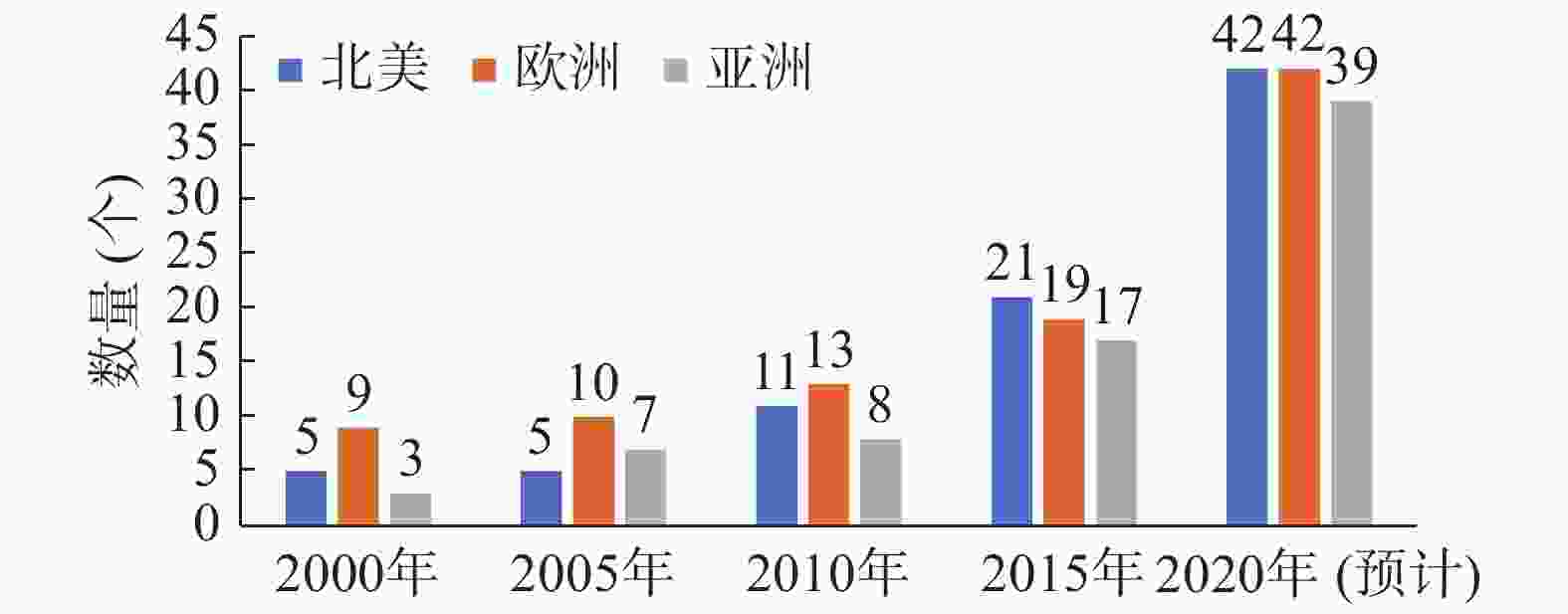
图 2 2000年至2020年全球已运行的质子束治疗中心数量
Figure 2. Number of proton beam therapy centers in operation in the world from 2000 to 2020
PBT系统由加速器、束流传输系统、旋转机架、治疗头、患者治疗专用部件和治疗床及治疗计划系统、影像系统、安全控制系统、质量系统等组成,其中加速器是一种用控制电磁的方法达到有效加速带电粒子的装置,将质子加速至接近光速水平,用于肿瘤治疗。PBT系统中常见的加速器有回旋加速器和同步加速器两种。这两种加速器的体积较大、成本高,是目前运营及筹建中最常用的加速器。随着新技术的发展, 将会开展更多激光加速器的研究并逐步应用于临床。激光加速器不仅可以产生高能质子,而且加速器部件将更加紧凑(质子磁体减少、机架体积减小等),同时改变了质子脉冲强度,通过笔形离子束扫描照射局部肿瘤区域。PBT中采用的蒙特卡洛剂量算法和强大的计划系统(如四维CT、运动器官门控、非门控治疗计划、鲁棒优化等)可提高放疗计划的精准性[4]。
-
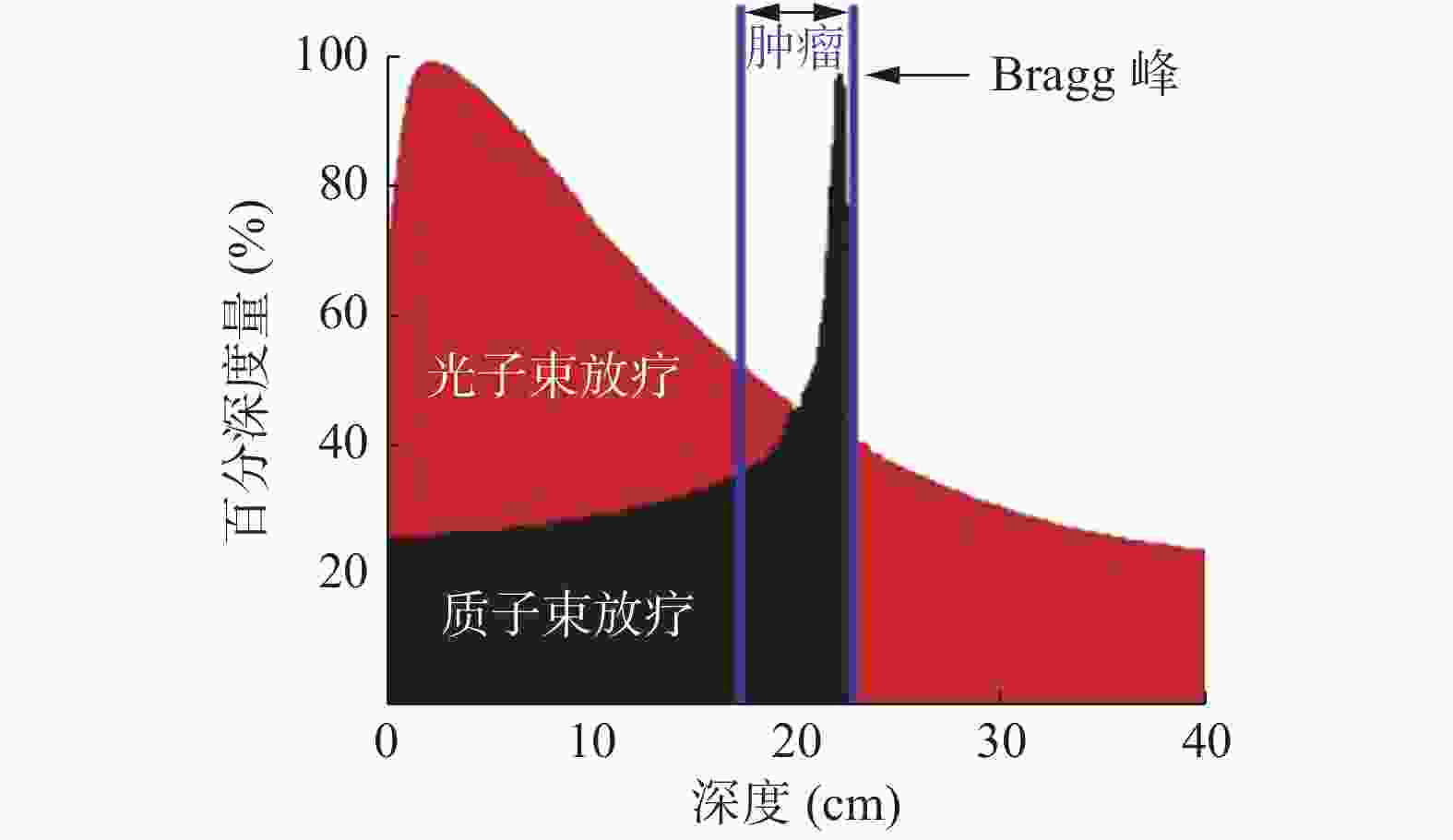
质子是携带1个正电荷的粒子,其质量大约是电子的1836倍。PBT使用的质子是氢原子,氢电离后成为质子,其能量一般为70~250 MeV,经过同步加速器或回旋加速器加速到接近光速的三分之二后用于肿瘤的治疗[1]。质子束速度随着穿过物质的深度增加而减慢,其能量损失率随速度的减慢而增加。一定能量的质子束进入人体组织时,在一定深度会产生一个急剧上升的Bragg峰;在形成 Bragg峰之前,是一个低平坦段;而在Bragg峰的后面,其能量则骤降为零;多峰叠加可产生扩展的Bragg峰,以完整覆盖靶区;Bragg峰是能量依赖型的,因此通过调节质子束能量,并且按不同肿瘤大小适当地扩展峰的宽度,可使高能量区集中在不同深度和大小的肿瘤部位(图3)[5]。在治疗的过程中,质子束递送至肿瘤部位,高剂量的放射线紧密聚焦在肿瘤区,最大限度地杀死肿瘤,提高肿瘤的局部控制率;与此同时,大大降低了对正常器官和组织的放射剂量,减轻了与辐射相关的不良反应,避免了因免疫细胞损伤而导致的机体免疫功能降低,同时将辐射诱发二次肿瘤的风险降到最低。在高能光子束放疗中,X射线以直线束方式穿过患者身体,当光子束照射肿瘤靶区时,其能量随着组织器官的深度增加不断衰减,肿瘤前区域接受的放射剂量较高,穿过肿瘤区域后仍会残存稍高的辐射剂量。因而,PBT是当前精准放疗中的典型代表。
-
在放疗中,质子的剂量是以Gy表示的,其由物理剂量(每单位质量沉积的能量)乘以相对的生物学效应(relative biological effectiveness,RBE)来确定的。光子和电子的RBE通常为1,而质子的RBE通常被认为是1.1[6-7]。质子的RBE与光子相似或略大于光子,其受到剂量水平、能量损失率以及组织类型等多种因素的影响。质子的RBE具有复杂性和不确定性,目前较公认的是质子辐射导致肿瘤细胞DNA损伤,包括糖基破坏、DNA单链和(或)双链的断裂以及DNA链铰链等[8]。质子的RBE与光子相比并无较大差异,而且,人体组织之间的相互作用也存在一些不确定性,所以需要在今后的工作中进行深入研究[9]。
-
PBT治疗肿瘤的技术主要是主动扫描技术和被动散射技术,通过调制器、准直器等获得质子扩展的Bragg峰。目前,国际上质子应用于临床肿瘤放疗常见的治疗方式有以下几种:①质子点扫描照射,实现对肿瘤的精确调控,但操作过程较为复杂;②质子立体定向放疗,其主要治疗方式为靶区大剂量照射和分次照射,但在临床上对肿瘤治疗的应用较局限;③质子适形与调强质子治疗(intensity-modulated proton therapy,IMPT),实现了剂量强度调制,优化了剂量分布,尤其是笔形束扫描在IMPT中的应用,避免或减少了对周围正常组织的照射剂量。在治疗头颈部肿瘤时,PBT可提高靶区的照射剂量,降低危及器官的毒性[10-12]。
-
新版的2018年美国国家综合癌症网络指南将PBT作为头颈部肿瘤和食管癌治疗的标准治疗方法之一[13-14]。在此之前,美国国家综合癌症网络指南已经将PBT纳入了肝胆肿瘤治疗指南中[15]。
-
近期对鼻腔和鼻窦黏膜恶性黑色素瘤的系统回顾和荟萃分析结果表明,与X射线照射和手术相比,采用大分割、高剂量的质子束对靶区照射,可显著提高患者的生存率和局部控制率。鼻腔和鼻窦黏膜恶性黑色素瘤患者的相对5年无病生存率可提高44%[16]。日本的头颈癌指南指出,PBT是鼻腔、颅底肿瘤治疗的选择之一[1]。
目前,手术切除治疗眼内葡萄膜黑色素瘤的效果最佳,然而,由于眼部的低敏感性和眼部肿瘤周围复杂的解剖结构,PBT被认为是更安全有效的放疗模式。Seibel 等[17]回顾性分析了2466份PBT报告,结果显示PBT对葡萄膜黑色素瘤有很高的控制率和眼球保存率;5年局部控制率为95.9%,5年和10年的眼球保存率分别为94.8%和93.2%。葡萄膜黑色素瘤患者无需手术和住院,治疗一般在5个工作日内完成,因其具有良好的局部控制率、较高的眼球保存率、能保持眼部视力、降低新生血管性青光眼的发病率,成为越来越多患者的选择[18]。
-
PBT脑膜瘤的研究结果表明,其3年局部控制率为92%~100%,发生3级或更高级不良反应的概率为0~12.5%[11]。Wenkel等[19]对采用PBT的46例良性脑膜瘤患者的资料进行分析,结果发现,其5年局部控制率为100%,10年局部控制率为88%,发生3级或更高级不良反应的概率为22.2%。Weber等[20]对34例脑膜瘤患者(Ⅰ级脑膜瘤患者24例,Ⅱ~Ⅲ级脑膜瘤患者10例)的研究发现,PBT的处方剂量是56 Gy,1.8~2 Gy/次,5年局部控制率为84.8%,总生存率为81.8%,出现3级或更高级不良反应的概率约为15.5%。但以上研究均为回顾性研究,目前缺乏大量临床前瞻性研究,因此,PBT对于脑膜瘤的疗效尚存争议[21]。
-
PBT已广泛应用于颅底脊索瘤的治疗,其效果较光子束放疗明显提高,部分患者可在避免手术的情况下获得根治。在许多研究中,PBT的疾病局部控制率接近80%[22-23],PBT结束后3个月,患者发生的不良反应更少,患者能更快恢复健康,并且发生第二次肿瘤的风险降低一半[23]。
PBT与传统X射线放疗相比,降低了颞叶、中枢神经系统等关键器官的受照剂量,减少了周围正常器官和组织(视神经、视交叉、大脑、垂体、海绵窦等中枢神经系统的关键器官)的不良反应,进一步改善了对肿瘤的治疗效果[12-24]。
-
PBT可明显提高对NSCLC的治疗效果,PBT可提高靶区肿瘤照射剂量,并不增加甚至可降低对肺和纵隔的放射性损伤。一项系统性回顾分析结果表明,早期NSCLC PBT的5年生存率为60%,而体部立体定向放疗的5年生存率仅为41%;PBT的疗效显著优于光子束治疗,可能对早期NSCLC的治疗更安全有效[25]。
2011年Chang等[26]进行了PBT联合化疗Ⅱ期临床试验研究:对44例Ⅲ期NSCLC患者行同步放(74 Gy)化疗,结果未发生4级以上不良反应,患者的中位生存时间为29.4个月。Oshiro等[27]对局部晚期NSCLC患者采用同步化疗联合PBT的Ⅱ期研究,结果显示未出现4级或更高的肺部不良反应,患者的中位生存时间达26.7个月。而且,多个研究结果表明,PBT同步化疗或PBT治疗局部晚期的NSCLC是安全可行的[28-29]。
PBT可能对放疗后再复发的NSCLC患者也有较好的治疗效果。McAvoy等[30]对宾夕法尼亚大学的33例接受质子束再程放疗后复发的NSCLC患者的疗效进行了回顾性分析,中位随访时间为11个月,患者再程放疗后1年总生存率为47%,无进展生存率为28%,局部控制率为54%,无远处转移生存率为39%。该研究结果显示:质子可作为复发NSCLC患者的可选治疗方案之一,但出现局部复发、远处转移和不良反应的可能性也比较高。
IMPT具有显著的剂量学效益,其具有良好的适形剂量分布和肺部最低的照射剂量[31],能够进一步提高PBT的精准性。对于NSCLC患者,在治疗期间肿瘤移动<5 mm的情况下,IMPT剂量学指标较标准PBT具有明显的优势。IMPT可以改善肺、心脏和食管剂量参数,IMPT和被动散射PBT能够保持与目标剂量覆盖率的最大偏差在5%之内,四维CT和质子束技术的应用,可以有效评估呼吸周期中肿瘤的运动,提高质子束对靶区照射的准确度[23-32]。
-
食管癌的治疗以手术和放化疗为主,同步放化疗是局部进展期食管癌的标准治疗方法。PBT具有较低的入口剂量,出口剂量几乎为零。马里兰大学、梅奥诊所、安德森癌症中心对582例食管癌患者的术前PBT与光子束放疗进行了比较,所有患者均接受了新辅助放化疗,其中三维适形放疗215例、IMRT 256例、PBT 111例。结果显示,PBT能够提供符合靶体积的远侧和近端边缘的剂量分布,显著减少肺、心脏、脊髓的递送剂量,肺部并发症的发生率整体降低5.1%~22.8%,患者平均住院时间可缩短3~4 d[33]。PBT的剂量递增可用于食管癌化疗后的放疗,对于局部复发的食管癌患者还可行PBT。因此,PBT联合化疗或者参与局部复发患者的放疗将会有更多的临床应用[34]。
-
在对乳腺癌的治疗中,相比于腔内和间质近距离放疗,PBT具有较高的治疗成本效益[35]。与传统放疗相比,PBT的靶区剂量分布更均匀,对侧乳房所受剂量更低,对于器官运动的鲁棒性更高,照射野更少,治疗时间更短;PBT的心脏总体受照射剂量是光子束的1/18~1/8,治疗5年后,97%的乳腺癌患者无肿瘤复发[36]。Darby等[37]研究发现,无论乳腺癌诊断时心脏危险因素如何,心脏平均照射剂量每增加1 Gy,心脏不良反应的发生率就会增加7%。PBT对左侧局部乳房的照射可能更安全有效,因为其可以减少对心脏的照射剂量[38]。
-
Nakayama等[39]回顾性分析了2001年至2007年行PBT的318例肝细胞癌(hepatocellular carcinoma,HCC)患者的相关资料,结果发现其1年、3年和5年总生存率分别为89.5%(95%CI,85.7%~93.1%)、64.7%(95%CI,56.6%~72.9%)和44.6%(95%CI,29.7%~59.5%)。美国Loma Linda 大学的Ⅱ期临床试验研究了76例行PBT的HCC患者,结果发现患者的中位无疾病进展生存时间是36个月,按米兰标准,其3年无疾病生存率是60%[40]。原发性肝癌的双散射PBT为主要临床模式。一项回顾性分析显示,PBT在HCC的再照射治疗中是安全、可行、有效的,没有产生严重的不良反应和放射性肝功能障碍[41]。PBT减少了HCC患者治疗后的不良反应和严重的并发症,而且在合理范围内,可通过照射剂量的增加来改善肿瘤控制率和提高患者的生存率[42]。PBT对老年HCC、巨大HCC(直径>10 cm)、严重肝硬化或肝腹水HCC等的治疗都可能是安全和有效的。
-
胰腺被胃肠道包绕,PBT可提高靶区剂量均匀度,减少对胃肠道、肝脏、肾脏、脊髓的照射剂量。Terashima等[43]和Loehrer等[44]报道了吉西他滨联合PBT(67.5 Gy)在50例局部晚期胰腺癌患者中的Ⅰ~Ⅱ期研究结果:局部疗效高,平均生存时间为23个月。
-
在对各类肿瘤的治疗中,行前列腺癌PBT的患者是最多的。经PBT后,生活质量不受影响的患者数是其他前列腺癌治疗方式的2倍[45]。已经证实,PBT在前列腺癌的治疗中更加安全有效,其治愈率和患者的生存率都较高,PBT可使患者5年总生存率整体提高4.9%,膀胱剂量减少35%,直肠剂量减少59%;在增加前列腺癌照射剂量时,IMPT的肿瘤区的剂量均匀度明显优于光子束放疗,可减少急性和长期辐射不良反应[46]。但是,其他一些研究结果表明,相比于腔内照射技术、前列腺癌切除术和IMRT,PBT没有明显的成本效益[47]。因此,需要进一步地研究来评估PBT在前列腺癌中的临床应用。
-
近期的一项Ⅱ期单臂临床试验纳入了麻省总医院的59例髓母细胞瘤患儿,结果显示,接受全脑全脊髓PBT的患者无一例发生长期心脏、肺部或胃肠道不良反应,在以往X射线放疗的研究中有25%~50%的患者发生了上述晚期并发症;而且,PBT的疾病控制率与X射线放疗相似[48]。
-
一项针对54例脑肿瘤患儿的研究结果显示,接受X射线放疗的患儿的智商每年下降1.57分,行PBT后,患儿的智商得分则保持稳定(P=0.026)。由于放疗可严重影响神经认知功能,年龄较小的患儿从PBT中的受益更加明显,尤其是5岁以下的患儿[49]。早期研究结果显示,PBT和X射线放疗可获得相似的生存结果,一项研究分析了32例接受PBT的低级别胶质瘤患儿,8年无进展生存率和总生存率分别为82.8%和100%[50]。支持儿童高级别胶质瘤应用PBT的数据很有限,但PBT对于Ⅲ级胶质瘤有较好的治疗效果[51]。
-
一项研究纳入了52例接受X射线放疗(31例)或PBT(21例)的颅咽管瘤患儿(中位年龄为9.1岁),中位剂量为50.4 Gy,结果发现,两组患儿的3年总生存率为96%,并且X射线放疗组和PBT组患儿的局部控制率和总生存率差异无统计学意义[52]。Weber等[53]的回顾性研究纳入了16例患者(年龄为7~34岁),PBT的剂量为50.4~59.4 Gy,最终对15例患者进行了分析,3年的总生存率为75%。PBT的治疗效果与X射线放疗相似,但PBT可在实施更高剂量照射的同时,更好地保护颞叶和海马结构[54]。
-
PBT横纹肌肉瘤的治疗效果与X射线放疗相似,局限性横纹肌肉瘤或转移性胚胎性横纹肌肉瘤患者的5年总生存率、局部控制率和无事件生存率分别为78%、81%和69%;脑膜旁横纹肌肉瘤患者的5年总生存率、局部控制率、无事件生存率、无进展生存率和无失败生存率分别为64%~73%、67.5%~77%、60%、72%和59%。对于所有分级的横纹肌肉瘤,与X射线调强放疗的长期不良反应发生率(32%~47%)相比,PBT晚期不良反应发生率(18%~35%)较低[53-56]。PBT儿童横纹肌肉瘤的前景光明。尽管高剂量区内的组织受照后可致生长发育损伤(尤其是对低龄患儿来说),但在治疗儿童患者或肿瘤解剖位置复杂时应该考虑使用PBT[53,57]。
-
麻省总医院进行了一项回顾性研究,分析了30例接受PBT的尤文氏肉瘤患儿(中位年龄10岁),中位照射剂量为54 Gy,中位随访时间为38.4个月,结果发现,这些患儿的3年局部控制率和总生存率分别为86%和89%,20%的患儿出现了3级不良反应[58]。
-
一项研究结果显示,未完全切除的骨肉瘤患儿接受PBT(中位剂量66 Gy,伴或不伴X射线放疗)后的5年局部控制率为68%,PBT对微小残留病灶更加有效[59]。
采用传统的放疗方法治疗儿童肿瘤可导致患儿出现不可逆性长期不良反应(包括生长发育异常,神经认知障碍,耳、肾、内分泌和性功能障碍及放射线相关二次原发肿瘤),严重影响患儿的生活质量。日前,离子治疗合作小组儿科委员会、儿童放射肿瘤学协会和欧洲离子治疗网络发表了最新的PBT儿童肿瘤的联合共识,PBT可适用于儿童中枢神经系统肿瘤(髓母细胞瘤、室管膜瘤、胶质瘤、横纹肌肉瘤、颅咽管瘤、生殖细胞肿瘤);也可适用于儿童非中枢系统肿瘤(脊索瘤、软骨肉瘤、尤文氏肉瘤、骨肉瘤、视网膜母细胞瘤、淋巴瘤、神经母细胞瘤、肾母细胞瘤)[52]。目前即便已经制定了儿童肿瘤和颅底肿瘤PBT适应证的共识,但仍然缺乏高质量、前瞻性、长期临床试验和数据。随着越来越多的PBT中心在全球范围内投入使用,PBT相关前瞻性临床研究势必会越来越多。
-
PBT面临的挑战是缺乏足够的临床证据、尚未完全明确的RBE、专业的技术人员匮乏等,克服这些不足会更好地促进PBT的快速发展。因此,随着科技的不断进步,人工智能和自动化技术的不断创新,未来质子的FLASH治疗技术、点扫描弧形治疗技术、笔形束治疗技术将会得到广泛应用。随着快速成像技术的不断提高,可延伸材料的应用对患者快速定位,PBT运行成本逐渐减少等,将会有更多的患者在PBT中获益[61]。质子独特的Bragg峰,可实现对肿瘤靶区的“定向爆破”,提高肿瘤治疗的精确度,降低发生二次原发肿瘤和免疫系统损伤的风险。采用PBT治疗癌症,患者的获益还是可预见的,随着质子加速器等技术的进步,从PBT中获益的患者数也会不断增加。我们坚信随着科学技术的发展和研究的深入,PBT总费用的减少、加速器中质子能量转换时间的缩短、质子在肿瘤区域靶区周围散射的降低以及RBE技术等问题,都将逐步完善,未来PBT势必将成为治疗肿瘤的更好的方式。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 宋帅负责文献的搜集整理和论文的撰写;罗辉负责协助文献的搜集整理和论文的撰写;葛红负责提出论文的命题、指导论文的撰写和最终版本的修订。
质子束放疗在肿瘤中的研究进展
Overview of proton beam therapy in cancer treatment
-
摘要: 肿瘤放疗的基本准则是提高肿瘤靶区的放射剂量,同时更好地保护肿瘤周围的正常组织器官。质子束治疗(PBT)是目前全球最先进的放疗技术之一,其能更好地体现这一准则。理论上,质子束以其特有的Bragg峰和优越的相对生物学效应,可给予肿瘤靶区最大剂量,同时降低肿瘤周围正常组织器官的接受剂量,实现对肿瘤靶区的“定向爆破”,提高肿瘤的局部治疗率和控制率,优于传统光子治疗。目前已应用于临床的研究包括黑色素瘤、肺癌、食管癌、乳腺癌、肝癌、前列腺癌和儿童恶性肿瘤等多种病变,但多为回顾性研究,而且建立和维护质子设备的成本巨大,因此用PBT治疗恶性肿瘤尚存争议。PBT面临的挑战是缺乏足够的临床证据和不明确的生物学效应等,克服这些不足可能会更好地促进PBT的快速发展。笔者详细论述了PBT的物理、生物学特性及其在肿瘤治疗中的研究和应用进展。Abstract: Tumor radiotherapy increases radiation dose in a tumor target area and improves protection for normal tissues and organs around tumors. Proton beam therapy (PBT) is the most advanced radiotherapy technology worldwide. In theory, the unique Bragg peak and superior relative biological effect of proton beam can deliver a maximum dose to tumor target areas, reduce the dose received by normal tissues and organs around tumors, achieve the "directional blasting" of a tumor target area, and improve the local treatment and control rates of tumors. This method has better features than traditional photon therapy. Currently, existing clinical studies focus on melanoma; lung, esophageal, breast, liver, and prostate cancers; childhood malignant tumor; and other diseases. However, most of these studies are retrospective clinical studies, and the cost of establishing and maintaining a proton equipment is immense. Thus, proton therapy for malignant tumors remains controversial. Future studies must address the insufficient clinical evidence of PBT, and biological effects are still under investigation. Overcoming these deficiencies is associated with the rapid development of PBT. This review discusses the physical and biological characteristics of PBT, and its application in cancer therapy.
-
Key words:
- Proton beam therapy /
- Radiation therapy /
- Tumor
-
表 1 截至2018年初全球接受质子束治疗患者的统计数据 (由粒子治疗合作组收集的数据)
Table 1. Statistics of proton beam therapy patients as of the beginning of 2018 (Data collected by PTCOG)
国家 第一次治疗
的年份(年)患者总
数(例)最后一次更新
数据的日期奥地利 2017 79 2017年12月 比利时 1991 21 1993年12月 加拿大 1995 204 2017年12月 捷克共和国 2012 2428 2017年12月 中国 2004 2725 2017年12月 英格兰 1989 3223 2017年12月 法国 1991 14 880 2017年12月 德国 1998 10 082 2018年 2 月 意大利 2002 1302 2017年12月 日本 1979 26 764 2017年12月 波兰 2011 276 2017年12月 俄罗斯 1967 7128 2017年12月 南非 1993 524 2017年12月 韩国 2007 3200 2017年12月 瑞典 1957 1911 2017年12月 瑞士 1984 8448 2017年12月 美国 1954 87 370 2017年12月 总计 170 565 -
[1] Sakurai H, Ishikawa H, Okumura T. Proton beam therapy in Japan: current and future status[J]. Jpn J Clin Oncol, 2016, 46(10): 885−892. DOI: 10.1093/jjco/hyw102. [2] Wilson RR. Radiological Use of Fast Protons[J]. Radiology, 1946, 47(5): 487−491. DOI: 10.1148/47.5.487. [3] Tobias CA, Lawrence JH, Born JL, et al. Pituitary Irradiation with High-Energy Proton Beams A Preliminary Report[J]. Cancer Res, 1958, 18(2): 121−134. [4] 田素青, 王俊杰. 医用小型激光质子加速器在肿瘤治疗中的研究进展[J]. 癌症进展, 2018, 16(8): 932−934. DOI: 10.11877/j.issn.1672−1535.2018.16.08.02.
Tian SQ, Wang JJ. Research progress of small medical laser proton accelerator in cancer treatment[J]. Oncology Progress, 2018, 16(8): 932−934. DOI: 10.11877/j.issn.1672−1535.2018.16.08.02.[5] Szeto YZ, Witte MG, van Kranen SR, et al. Effects of anatomical changes on pencil beam scanning proton plans in locally advanced nsclc patients[J]. Radiother Oncol, 2016, 120(2): 286−292. DOI: 10.1016/j.radonc.2016.04.002. [6] Jäkel O, Smith AR, Orton CG. The more important heavy charged particle radiotherapy of the future is more likely to be with heavy ions rather than protons[J]. Med Phys, 2013, 40(9): 090601. DOI: 10.1118/1.4798945. [7] Brada M, Bortfeld T. Proton Therapy: The Present and the Future[J]. Semin Radiat Oncol, 2013, 23(2): 75−76. DOI: 10.1016/j.semradonc.2012.11.001. [8] Olive PL. DNA damage and repair in individual cells: applications of the comet assay in radiobiology[J]. Int J Radiat Biol, 1999, 75(4): 395−405. DOI: 10.1080/095530099140311. [9] Giovannini G, Böhlen T, Cabal G, et al. Variable rbe in proton therapy: comparison of different model predictions and their influence on clinical-like scenarios[J/OL]. Radiat Oncol, 2016, 11: 68[2019-01-05]. https://ro-journal.biomedcentral.com/articles/10.1186/s13014-016-0642-6. DOI: 10.1186/s13014−016−0642−6. [10] Cotter SE, Mcbride SM, Yock TI. Proton radiotherapy for solid tumors of childhood[J]. Technol Cancer Res Treat, 2012, 11(3): 267−278. DOI: 10.7785/tcrt.2012.500295. [11] Weber DC, Lomax AJ, Rutz HP, et al. Spot-scanning proton radiation therapy for recurrent, residual or untreated intracranial meningiomas[J]. Radiother Oncol, 2004, 71(3): 251−258. DOI: 10.1016/j.radonc.2004.02.011. [12] Frank SJ, Cox JD, Gillin M, et al. Multifield Optimization Intensity Modulated Proton Therapy For Head and Neck Tumors: A Translation to Practice[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 846−853. DOI: 10.1016/j.ijrobp.2014.04.019. [13] Colevas AD, Yom SS, Pfister DG, et al. NCCN Guidelines Insights: Head and Neck Cancers, Version 1.2018[J]. J Natl Compr Canc Netw, 2018, 16(5): 479−490. DOI: 10.6004/jnccn.2018.0026. [14] Chang JY, Zhang XD, Knopf A, et al. Consensus Guidelines for Implementing Pencil-Beam Scanning Proton Therapy for Thoracic Malignancies on Behalf of the PTCOG Thoracic and Lymphoma Subcommittee[J]. Int J Radiat Oncol Biol Phys, 2017, 99(1): 41−50. DOI: 10.1016/j.ijrobp.2017.05.014. [15] Benson III AB, D'Angelica MI, Abbott DE, et al. NCCN Guidelines Insights: Hepatobiliary Cancers, Version 1.2017[J]. J Natl Compr Canc Netw, 2017, 15(5): 563−573. DOI: 10.6004/jnccn.2017.0059. [16] Zenda S, Akimoto T, Mizumoto M, et al. Phase Ⅱ study of proton beam therapy as a nonsurgical approach for mucosal melanoma of the nasal cavity or para-nasal sinuses[J]. Radiother Oncol, 2016, 118(2): 267−271. DOI: 10.1016/j.radonc.2015.10.025. [17] Seibel I, Riechardt AI, Heufelder J, et al. Adjuvant ab interno tumor treatment after proton beam irradiation[J]. Am J Ophthalmol, 2017, 178: 94−100. DOI: 10.1016/j.ajo.2017.03.027. [18] Moriarty JP, Borah BJ, Foote RL, et al. Cost-Effectiveness of Proton Beam Therapy for Intraocular Melanoma[J/OL]. PLoS One, 2015, 10(5): e0127814[2019-01-05]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0127814. DOI: 10.1371/journal.pone.0127814. [19] Wenkel E, Thornton AF, Finkelstein D, et al. Benign meningioma: Partially resected, biopsied, and recurrent intracranial tumors treated with combined proton and photon radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2000, 48(5): 1363−1370. DOI: 10.1016/S0360−3016(00)01411−5. [20] Weber DC, Schneider R, Goitein G, et al. Spot Scanning-Based Proton Therapy for Intracranial Meningioma: Long-Term Results From the Paul Scherrer Institute[J]. Int J Radiat Oncol Biol Phys, 2012, 83(3): 865−871. DOI: 10.1016/j.ijrobp.2011.08.027. [21] Goldbrunner R, Minniti G, Preusser M, et al. Eano guidelines for the diagnosis and treatment of meningiomas[J]. Lancet Oncol, 2016, 17(9): E383−E391. DOI: 10.1016/S1470−2045(16)30321−7. [22] Allen AM, Pawlicki T, Dong L, et al. An evidence based review of proton beam therapy: The report of ASTRO's emerging technology committee[J]. Radiother Oncol, 2012, 103(1): 8−11. DOI: 10.1016/j.radonc.2012.02.001. [23] Ahmed KA, Demetriou SK, McDonald M, et al. Clinical benefits of proton beam therapy for tumors of the skull base[J]. Cancer Control, 2016, 23(3): 213−219. DOI: 10.1177/107327481602300304. [24] Holliday EB, Frank SJ. Proton Radiation Therapy for Head and Neck Cancer: A Review of the Clinical Experience to Date[J]. Int J Radiat Oncol Biol Phys, 2014, 89(2): 292−302. DOI: 10.1016/j.ijrobp.2014.02.029. [25] Berman AT, James SS, Rengan R. Proton Beam Therapy for Non-Small Cell Lung Cancer: Current Clinical Evidence and Future Directions[J]. Cancers (Basel), 2015, 7(3): 1178−1190. DOI: 10.3390/cancers7030831. [26] Chang JY, Komaki R, Lu C, et al. Phase 2 study of high-dose proton therapy with concurrent chemotherapy for unresectable stage Ⅲ nonsmall cell lung cancer[J]. Cancer, 2011, 117(20): 4707−4713. DOI: 10.1002/cncr.26080. [27] Oshiro Y, Okumura T, Kurishima K, et al. High-dose concurrent chemo-proton therapy for Stage Ⅲ NSCLC: Preliminary results of a Phase Ⅱ study[J]. J Radiat Res, 2014, 55(5): 959−965. DOI: 10.1093/jrr/rru034. [28] Nguyen QN, Ly NB, Komaki R, et al. Long-term outcomes after proton therapy, with concurrent chemotherapy, for stage Ⅱ-Ⅲ inoperable non-small cell lung cancer[J]. Radiother Oncol, 2015, 115(3): 367−372. DOI: 10.1016/j.radonc.2015.05.014. [29] Zschaeck S, Simon M, Löck S, et al. PRONTOX-proton therapy to reduce acute normal tissue toxicity in locally advanced non-small-cell lung carcinomas (NSCLC): study protocol for a randomised controlled trial[J/OL]. Trials, 2016, 17(1): 543[2019-01-05]. https://trialsjournal.biomedcentral.com/articles/10.1186/s13063-016-1679-4. DOI: 10.1186/s13063−016−1679−4. [30] McAvoy SA, Ciura KT, Rineer JM, et al. Feasibility of proton beam therapy for reirradiation of locoregionally recurrent non-small cell lung cancer[J]. Radiother Oncol, 2013, 109(1): 38−44. DOI: 10.1016/j.radonc.2013.08.014. [31] Seco J, Gu G, Marcelos T, et al. Proton Arc Reduces Range Uncertainty Effects and Improves Conformality Compared With Photon Volumetric Modulated Arc Therapy in Stereotactic Body Radiation Therapy for Non-Small Cell Lung Cancer[J]. Int J Radiat Oncol Biol Phys, 2013, 87(1): 188−194. DOI: 10.1016/j.ijrobp.2013.04.048. [32] Chang JY, Li H, Zhu XR, et al. Clinical Implementation of Intensity Modulated Proton Therapy for Thoracic Malignancies[J]. Int J Radiat Oncol Biol Phys, 2014, 90(4): 809−818. DOI: 10.1016/j.ijrobp.2014.07.045. [33] Chuong MD, Hallemeier CL, Jabbour SK, et al. Improving Outcomes for Esophageal Cancer using Proton Beam Therapy[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 488−497. DOI: 10.1016/j.ijrobp.2015.11.043. [34] Plastaras JP, Berman AT, Freedman GM. Special Cases for Proton Beam Radiotherapy: Re-irradiation, Lymphoma, and Breast Cancer[J]. Semin Oncol, 2014, 41(6): 807−819. DOI: 10.1053/j.seminoncol.2014.10.001. [35] Reiazi R, Norozi A, Etedadialiabadi M. A Literature Survey on Cost-Effectiveness of Proton Beam Therapy in the Management of Breast Cancer Patients[J]. Iran J Cancer Prev, 2015, 8(6): e4373. DOI: 10.17795/ijcp−4373. [36] Bush DA, Do S, Lum S, et al. Partial Breast Radiation Therapy With Proton Beam: 5-Year Results With Cosmetic Outcomes[J]. Int J Radiat Oncol Biol Phys, 2014, 90(3): 501−505. DOI: 10.1016/j.ijrobp.2014.05.1308. [37] Darby SC, Ewertz M, McGale P, et al. Risk of Ischemic Heart Disease in Women After Radiotherapy for Breast Cancer[J]. N Engl J Med, 2013, 368(11): 987−998. DOI: 10.1056/NEJMoa1209825. [38] Durante M, Orecchia R, Loeffler JS. Charged-particle therapy in cancer: clinical uses and future perspectives[J]. Nat Rev Clin Oncol, 2017, 14(8): 483−495. DOI: 10.1038/nrclinonc.2017.30. [39] Nakayama H, Sugahara S, Tokita M, et al. Proton beam therapy for hepatocellular carcinoma: The University of Tsukuba experience[J]. Cancer, 2009, 115(23): 5499−5506. DOI: 10.1002/cncr.24619. [40] Bush DA, Kayali Z, Grove R, et al. The safety and efficacy of high-dose proton beam radiotherapy for hepatocellular carcinoma: a phase 2 prospective trial[J]. Cancer, 2011, 117(13): 3053−3059. DOI: 10.1002/cncr.25809. [41] Oshiro Y, Mizumoto M, Okumura T, et al. Analysis of repeated proton beam therapy for patients with hepatocellular carcinoma[J]. Radiother Oncol, 2017, 123(2): 240−245. DOI: 10.1016/j.radonc.2017.03.004. [42] Qi WX, Fu S, Zhang Q, et al. Charged particle therapy versus photon therapy for patients with hepatocellular carcinoma: A systematic review and meta-analysis[J]. Radiother Oncol, 2015, 114(3): 289−295. DOI: 10.1016/j.radonc.2014.11.033. [43] Terashima K, Demizu Y, Hashimoto N, et al. A phase Ⅰ/Ⅱ study of gemcitabine-concurrent proton radiotherapy for locally advanced pancreatic cancer without distant metastasis[J]. Radiother Oncol, 2012, 103(1): 25−31. DOI: 10.1016/j.radonc.2011.12.029. [44] Loehrer PJ Sr, Feng Y, Cardenes H, et al. Gemcitabine Alone Versus Gemcitabine Plus Radiotherapy in Patients with Locally Advanced Pancreatic Cancer: An Eastern Cooperative Oncology Group Trial[J]. J Clin Oncol, 2011, 29(31): 4105−4112. DOI: 10.1200/JCO.2011.34.8904. [45] Mahal BA, Chen YW, Efstathiou JA, et al. National Trends and Determinants of Proton Therapy Use for Prostate Cancer: A National Cancer Data Base Study[J]. Cancer, 2016, 122(10): 1505−1512. DOI: 10.1002/cncr.29960. [46] Hoppe BS, Michalski JM, Mendenhall NP, et al. Comparative effectiveness study of patient-reported outcomes after proton therapy or intensity-modulated radiotherapy for prostate cancer[J]. Cancer, 2014, 120(7): 1076−1082. DOI: 10.1002/cncr.28536. [47] Verma V, Mishra MV, Mehta MP. A systematic review of the cost and cost-effectiveness studies of proton radiotherapy[J]. Cancer, 2016, 122(10): 1483−1501. DOI: 10.1002/cncr.29882. [48] Yock TI, Yeap BY, Ebb DH, et al. Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: A phase 2 single-arm study[J]. Lancet Oncol, 2016, 17(3): 287−298. DOI: 10.1016/S1470−2045(15)00167−9. [49] Kahalley LS, Ris MD, Grosshans DR, et al. Comparing Intelligence Quotient Change After Treatment With Proton Versus Photon Radiation Therapy for Pediatric Brain Tumors[J]. J Clin Oncol, 2016, 34(10): 1043−1049. DOI: 10.1200/JCO.2015.62.1383. [50] Greenberger BA, Pulsifer MB, Ebb DH, et al. Clinical Outcomes and Late Endocrine, Neurocognitive, and Visual Profiles of Proton Radiation for Pediatric Low-Grade Gliomas[J]. Int J Radiat Oncol Biol Phys, 2014, 89(5): 1060−1068. DOI: 10.1016/j.ijrobp.2014.04.053. [51] Weber DC, Habrand JL, Hoppe BS, et al. Proton therapy for pediatric malignancies: Fact, figures and costs. A joint consensus statement from the pediatric subcommittee of PTCOG, PROS and EPTN[J]. Radiother Oncol, 2018, 128(1): 44−55. DOI: 10.1016/j.radonc.2018.05.020. [52] Bishop AJ, Greenfield B, Mahajan A, et al. Proton Beam Therapy Versus Conformal Photon Radiation Therapy for Childhood Craniopharyngioma: Multi-Institutional Analysis of Outcomes, Cyst Dynamics, and Toxicity[J]. Int J Radiat Oncol Biol Phys, 2014, 90(2): 354−361. DOI: 10.1016/j.ijrobp.2014.05.051. [53] Weber DC, Ares C, Albertini F, et al. Pencil Beam Scanning Proton Therapy for Pediatric Parameningeal Rhabdomyosarcomas: Clinical Outcome of Patients Treated at the Paul Scherrer Institute[J]. Pediatr Blood Cancer, 2016, 63(10): 1731−1736. DOI: 10.1002/pbc.25864. [54] Luu QT, Loredo LN, Archambeau JO, et al. Fractionated Proton Radiation Treatment for Pediatric Craniopharyngioma: Preliminary Report[J]. Cancer J, 2006, 12(2): 155−159. [55] Wolden SL, Lyden ER, Arndt CA, et al. Local Control for Intermediate-Risk Rhabdomyosarcoma: Results from D9803 According to Histology, Group, Site, and Size: A Report from the Children's Oncology Group[J]. Int J Radiat Oncol Biol Phys, 2015, 93(5): 1071−1076. DOI: 10.1016/j.ijrobp.2015.08.040. [56] Koscielniak E, Feuchtgruber S, Sparber-Sauer M, et al. Prognosis of patients with parameningeal rhabdomyosarcoma (PM-RMS): The long term results of five consecutive CWS studies 1981-2009[J]. J Clin Oncol, 2016, 34(15S): S10529−10529. DOI: 10.1200/JCO.2016.34.15_suppl.10529. [57] Leiser D, Calaminus G, Malyapa R, et al. Tumour control and Quality of Life in children with rhabdomyosarcoma treated with pencil beam scanning proton therapy[J]. Radiother Oncol, 2016, 120(1): 163−168. DOI: 10.1016/j.radonc.2016.05.013. [58] Rombi B, DeLaney TF, MacDonald SM, et al. Proton Radiotherapy for Pediatric Ewing's Sarcoma: Initial Clinical Outcomes[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): 1142−1148. DOI: 10.1016/j.ijrobp.2011.03.038. [59] Frisch S, Timmermann B. The Evolving Role of Proton Beam Therapy for Sarcomas[J]. Clin Oncol, 2017, 29(8): 500−506. DOI: 10.1016/j.clon.2017.04.034. [60] 吉喆, 姜玉良. 质子放疗的临床应用研究进展[J]. 西部医学, 2016, 28(4): 580-584, 封三. DOI: 10.3969/j.issn.1672−3511.2016.04.036.
Ji Z, Jiang YL. Developments of clinical application of proton beam radiotherapy[J]. Med J West China, 2016, 28(4): 580-584, inside back cover. DOI: 10.3969/j.issn.1672−3511.2016.04.036.[61] Bortfeld TR, Loeffler JS. Three ways to make proton therapy affordable[J]. Nature, 2017, 549(7673): 451−453. DOI: 10.1038/549451a. -





 下载:
下载: